
PraktRab_4th
.pdf7.6. Примеры решений практических заданий и ответы к практическим работам раздела 7
7.6.1. Пример практической работы. Растворимость в системе
NH4H2PO4 - (NH4)2HPO4 - (C2H5)2NH2Cl - H2O при 40ºC и 45°С
По данным сведенным в табл. 7. 26-31 постройте изобарно-изотер- мическую диаграмму растворимости системы NH4H2PO4 - (NH4)2HPO4 - (C2H5)2NH2Cl - H2O при 40ºC и 45°С, выполните следующие практические работы и ответьте на вопросы:
1. Используя данные табл. 7. 21-23, постройте диаграммы растворимости оконтуривающих систем. Определите тип систем, составьте предполагаемый состав трояконасыщенного раствора и вычислите оптимальные составы ИСК для его определения прогностическим методом.
К какому типу относится эти изотермы растворимости. Для каких технологических процессов могут быть использованы результаты исследования тройных оконтуривающих систем?
Таблица 7. 26 Растворимость в системе NH4H2PO4 - (C2H5)2NH2Cl - H2O при 40 и 45°С
№ |
nD40 |
Состав насыщенного раствора, % мас. |
Донная фаза |
|||
NH4H2PO4 |
(C2H5)2NH2Cl |
|
||||
п/п |
|
|
H2O |
|
||
|
|
|
Температура |
40°С |
|
|
1 |
1.4437 |
- |
71.72 |
|
28.28 |
(C2H5)2NH2Cl |
2 |
1.4444 |
3.09 |
70.16 |
|
26.75 |
NH4H2PO4+Et2NH2Cl |
3 |
1.4365 |
3.68 |
62.50 |
|
33.82 |
NH4H2PO4 |
4 |
1.4160 |
7.32 |
45.27 |
|
47.41 |
- " - |
5 |
1.3923 |
18.55 |
21.08 |
|
60.37 |
- " - |
6 |
1.3831 |
35.73 |
- |
|
64.27 |
- " - |
|
|
|
Температура |
45°С |
|
|
1 |
1.4434 |
- |
72.07 |
|
27.93 |
(C2H5)2NH2Cl |
2 |
1.4450 |
3.44 |
71.30 |
|
25.26 |
NH4H2PO4+Et2NH2Cl |
3 |
1.4435 |
4.50 |
69.12 |
|
26.38 |
NH4H2PO4 |
4 |
1.4275 |
7.73 |
50.05 |
|
42.22 |
- " - |
5 |
1.3950 |
18.81 |
22.86 |
|
58.33 |
- " - |
6 |
1.3861 |
38.87 |
- |
|
61.13 |
- " - |
2.Постройте основные проекции диаграммы растворимости четверной системы при обеих температурах.
К какому типу относится эта изотерма растворимости?
3.Используя данные табл. 7. 26-31, определите соотношение исходных солевых компонентов в донных фазах, образующихся из оптимальных ИСК, вычисленных в задании 1, для определения состава тройного эвтонического раствора. При получении неудовлетворительных результатов измените состав предполагаемого тройного эвтонического раствора и повторите вычисления.
4.Какие методы целесообразно использовать для определения составов трояконасыщенного раствора и равновесных твердых фаз его
насыщающих. Приведите оптимальные составы ИСК для решения каждой задачи, постройте принципиальные зависимости показателя преломления жидкой фазы от состава исследуемых сечений, определите координаты углов нонвариантных областей изогидрических разрезов.
Таблица 7. 27 Растворимость в системе (NH4)2HPO4 - (C2H5)2NH2Cl - H2O при 40 и 45°С
№ |
40 |
|
Состав насыщенного раствора, % мас. |
|
|
||||
п/п |
nD |
|
|
|
|
|
|
|
Донная фаза |
|
(NH4)2HPO4 |
(C2H5)2NH2Cl |
H2O |
|
|||||
|
|
|
|
|
Температура |
40°С |
|
|
|
1 |
1.4437 |
- |
|
71.72 |
|
28.28 |
|
(C2H5)2NH2Cl |
|
2 |
1.4443 |
0.61 |
|
71.01 |
|
28.38 |
|
(NH4)2HPO4+Et2NH2Cl |
|
3 |
1.4308 |
1.26 |
|
60.26 |
|
38.48 |
|
(NH4)2HPO4 |
|
4 |
1.4085 |
4.28 |
|
40.35 |
|
55.37 |
|
- " - |
|
5 |
1.3990 |
16.07 |
|
19.91 |
|
64.02 |
|
- " - |
|
6 |
1.4030 |
26.22 |
|
|
|
|
|
- " - |
|
7 |
1.4201 |
41.96 |
|
- |
|
58.04 |
|
- " - |
|
|
|
|
|
|
Температура |
45°С |
|
|
|
1 |
1.4434 |
- |
|
72.07 |
|
27.93 |
|
(C2H5)2NH2Cl |
|
2 |
1.4445 |
0.60 |
|
72.33 |
|
27.07 |
|
(NH4)2HPO4+Et2NH2Cl |
|
3 |
1.4308 |
0.96 |
|
62.54 |
|
36.50 |
|
(NH4)2HPO4 |
|
4 |
1.4178 |
2.54 |
|
48.57 |
|
48.89 |
|
- " - |
|
5 |
1.4092 |
4.47 |
|
40.52 |
|
55.01 |
|
- " - |
|
6 |
1.4012 |
14.41 |
|
23.83 |
|
61.76 |
|
- " - |
|
7 |
1.4062 |
23.21 |
|
13.76 |
|
63.03 |
|
- " - |
|
8 |
1.4222 |
42.06 |
|
- |
|
57.94 |
|
- " - |
|
|
|
|
|
|
|
|
|
|
Таблица 7. 28 |
|
Растворимость в системе NH4H2PO4 - (NH4)2HPO4 - H2O при 40 и 45°C |
||||||||
№ |
40 |
|
Состав насыщенного раствора, % мас. |
|
|
||||
п/п |
nD |
|
|
|
|
|
|
|
Донная фаза |
|
NH4H2PO4 |
|
(NH4)2HPO4 |
|
H2O |
|
|||
|
|
|
|
|
Температура 40°С |
|
|
||
1 |
1.4201 |
- |
|
41.96 |
|
58.04 |
|
(NH4)2HPO4 |
|
2 |
1.4251 |
11.54 |
|
40.11 |
|
48.35 |
- " - |
||
3 |
1.4349 |
23.84 |
|
35.12 |
|
41.04 |
- " - |
||
4 |
1.4367 |
29.47 |
|
34.64 |
|
35.89 |
- " - |
||
5 |
1.4400 |
29.63 |
|
34.53 |
|
35.84 |
(NH4)2HPO4+NH4H2PO4 |
||
6 |
1.4405 |
29.45 |
|
34.21 |
|
36.34 |
|
NH4H2PO4 |
|
7 |
1.4329 |
30.36 |
|
30.05 |
|
39.59 |
- " - |
||
8 |
1.4021 |
33.32 |
|
11.55 |
|
55.13 |
- " - |
||
9 |
1.3831 |
35.73 |
|
- |
|
64.27 |
- " - |
||
|
|
|
|
|
Температура 45°С |
|
|
||
1 |
1.4222 |
- |
|
42.06 |
|
57.94 |
|
(NH4)2HPO4 |
|
2 |
1.4250 |
9.94 |
|
41.58 |
|
48.48 |
- " - |
||
3 |
1.4341 |
19.34 |
|
37.75 |
|
42.91 |
- " - |
||
4 |
1.4365 |
25.23 |
|
36.02 |
|
38.75 |
- " - |
||
5 |
1.4403 |
30.41 |
|
34.66 |
|
34.93 |
(NH4)2HPO4+NH4H2PO4 |
||
6 |
1.4344 |
32.12 |
|
29.20 |
|
38.68 |
|
NH4H2PO4 |
|
7 |
1.4205 |
34.27 |
|
21.05 |
|
44.68 |
- " - |
||
8 |
1.4005 |
36.16 |
|
8.83 |
|
55.01 |
- " - |
||
9 |
1.3861 |
38.87 |
|
- |
|
61.13 |
- " - |
||
Какие ошибки определения составов равновесных твердых фаз трояконасыщенных растворов наблюдаются при округлении координат вершин нонвариантных областей изогидрических разрезов до 0.01, 0.05 и 0.1 %?
|
|
|
|
|
|
|
|
|
|
|
|
|
Таблица 7. 29 |
|
Растворимость в системе NH4H2PO4-(NH4)2HPO4-(C2H5)2NH2Cl-H2O при 40ºC |
||||||||||||
№ |
|
|
|
Жидкая фаза (верхняя/нижняя), % мас. |
Донная фаза |
||||||||
п/п |
|
NH4H2PO4 |
(NH4)2HPO4 |
Et2NH2Cl |
|
|
H2O |
||||||
|
|
|
|
||||||||||
1 |
|
29.63 |
|
34.53 |
- |
|
35.84 |
(NH4)2HPO4+NH4H2PO4 |
|||||
2 |
|
3.09 |
|
- |
70.16 |
|
26.75 |
NH4H2PO4+(C2H5)2NH2Cl |
|||||
3 |
|
|
- |
|
0.61 |
71.01 |
|
28.38 |
(NH4)2HPO4+(C2H5)2NH2Cl |
||||
4 |
|
2.96 |
|
0.58 |
70.13 |
|
26.33 |
NH4H2PO4+(NH4)2HPO4+ |
|||||
|
|
|
+(C2H5)2NH2Cl |
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
5 |
|
3.05 |
|
0.62 |
69.87 |
|
26.46 |
(NH4)2HPO4+NH4H2PO4 |
|||||
6 |
|
3.58 |
|
0.65 |
61.04 |
|
34.73 |
- " - |
|||||
7 |
|
6.06 |
|
2.47 |
48.46 |
|
43.01 |
- " - |
|||||
8 |
|
10.73 |
|
6.49 |
35.96 |
|
46.82 |
- " - |
|||||
9 |
|
13.05 |
|
9.54 |
29.97 |
|
47.44 |
- " - |
|||||
10 |
|
15.97 |
|
12.72 |
25.39 |
|
45.92 |
- " - |
|||||
11 |
|
17.26/ |
|
14.40/ |
22.93/ |
|
45.41/ |
- " - |
|||||
|
20.91 |
|
18.84 |
17.37 |
|
42.88 |
|||||||
|
|
|
|
|
|||||||||
12 |
|
21.86 |
|
20.45 |
14.57 |
|
43.12 |
- " - |
|||||
13 |
|
26.61 |
|
27.34 |
7.34 |
|
38.71 |
- " - |
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
Таблица 7. 30 |
|
Растворимость в системе NH4H2PO4-(NH4)2HPO4-(C2H5)2NH2Cl-H2O при 45ºC |
||||||||||||
№ |
45 |
|
Жидкая фаза (верхняя/нижняя), % мас. |
|
|||||||||
п/п |
|
nD |
|
|
|
|
|
|
|
Донная фаза |
|||
|
|
NH4H2PO4 |
|
(NH4)2HPO4 |
Et2NH2Cl |
|
H2O |
||||||
1 |
1.4403 |
|
30.41 |
|
34.66 |
|
- |
|
34.93 |
(NH4)2HPO4+NH4H2PO4 |
|||
2 |
1.4450 |
3.44 |
- |
71.30 |
|
|
25.26 NH4H2PO4+(C2H5)2NH2Cl |
||||||
3 |
1.4445 |
- |
|
0.60 |
72.33 |
|
27.07 |
(NH4)2HPO4+(C2H5)2NH2Cl |
|||||
4 |
1.4451 |
2.91 |
0.73 |
70.95 |
|
25.41 |
NH4H2PO4+(NH4)2HPO4+ |
||||||
|
+(C2H5)2NH2Cl |
||||||||||||
|
1.4209/ |
11.63/ |
6.78/ |
36.72/ |
|
44.87/ |
|||||||
5 |
|
(NH4)2HPO4+NH4H2PO4 |
|||||||||||
1.4335 |
26.48 |
26.41 |
9.65 |
|
37.46 |
||||||||
|
|
|
|||||||||||
6 |
1.4191/ |
13.18/ |
8.45/ |
32.74/ |
|
45.63/ |
NH4H2PO4 |
||||||
1.4341 |
26.42 |
25.20 |
10.03 |
|
38.35 |
||||||||
|
|
|
|||||||||||
7 |
1.4193/ |
13.24/ |
8.59/ |
32.07/ |
|
46.10/ |
- " - |
||||||
1.4340 |
26.91 |
25.25 |
9.90 |
|
37.94 |
||||||||
|
|
|
|||||||||||
8 |
1.4190/ |
13.31/ |
8.63/ |
31.92/ |
|
46.14/ |
- " - |
||||||
1.4338 |
26.61 |
24.99 |
10.19 |
|
38.21 |
||||||||
|
|
|
|||||||||||
9 |
1.4220 |
20.21 |
15.28 |
20.36 |
|
44.15 |
- " - |
||||||
10 |
1.4193/ |
13.33/ |
8.46/ |
32.08/ |
|
46.13/ |
(NH4)2HPO4 |
||||||
1.4335 |
27.54 |
24.66 |
10.24 |
|
37.56 |
||||||||
|
|
|
|||||||||||
11 |
1.4193/ |
13.47/ |
8.56/ |
31.88/ |
|
49.09/ |
- " - |
||||||
1.4341 |
26.89 |
24.59 |
10.04 |
|
38.48 |
||||||||
|
|
|
|||||||||||
12 |
1.4262 |
7.07 |
1.68 |
52.23 |
|
|
39.02 (NH4)2HPO4+NH4H2PO4 |
||||||
13 |
1.4320 |
4.49 |
0.95 |
58.83 |
|
35.73 |
- " - |
||||||
14 |
1.4392 |
3.53 |
0.53 |
66.24 |
|
29.70 |
- " - |
||||||
15 |
1.4416 |
3.30 |
0.48 |
67.75 |
|
28.47 |
- " - |
||||||
5. Какие методы целесообразно использовать для определения положения предельной монотектической ноды и изучения всех линий моновариантных равновесий. Приведите составы ИСК для каждого метода и постройте принципиальные зависимости показателя преломления жидкой фазы от состава исследуемых сечений.
Таблица 7. 31 Состав предельного монотектического равновесия и линия моновариантного
равновесия в системе NH4H2PO4 - (NH4)2HPO4 - (C2H5)2NH2Cl - H2O при 45, 43, 41, 40 и 39ºС
t, ºC |
Жидкая фаза (верхняя/нижняя), % мас. |
Донная фаза |
||||
NH4H2PO4 |
(NH4)2HPO4 |
(C2H5)2NH2Cl |
H2O |
|||
|
|
|||||
45 |
11.63/26.48 |
6.78/26.41 |
36.72/9.65 |
44.87/37.46 |
NH4H2PO4+ |
|
(NH4)2HPO4 |
||||||
43 |
13.71/25.31 |
9.72/24.61 |
29.93/11.32 |
46.64/38.76 |
||
- " - |
||||||
41 |
15.27/24.10 |
11.80/23.14 |
26.75/13.12 |
46.18/39.64 |
- " - |
|
40 |
17.26/20.91 |
14.40/18.84 |
22.93/17.37 |
45.41/42.88 |
- " - |
|
39 |
16.24 |
13.02 |
25.07 |
45.67 |
- " - |
|
39 |
17.06 |
13.97 |
23.46 |
45.51 |
- " - |
|
39 |
19.79 |
17.84 |
18.43 |
43.94 |
- " - |
|
6.Используя данные табл. 7. 28, предложите способ определения критической температуры возникновения монотектического равновесия в системе.
7.Используя данные о растворимости в тройной оконтуривающей
системе (NH4)2НPO4 - (C2H5)2NH2Cl – H2O, вычислите потери фосфора и аммония при синтезе гидрофосфата аммония из хлорида аммония, фосфорной кислоты и диэтиламина при 40 и 45 °С.
8.Используя данные о растворимости в тройной оконтуривающей
системе NH4Н2PO4 - (C2H5)2NH2Cl – H2O, вычислите потери фосфора и аммония при синтезе дигидрофосфата аммония из хлорида аммония, фосфорной кислоты и диэтиламина при 40 и 45 °С.
9.Сведите в одну таблицу коэффициенты использования фосфора и ионов аммония. Определите оптимальные концентрационные условия синтеза индивидуальных фосфатов аммония и их удобрительных смесей (аммофоса и диаммофоса).
10.Вычислите составы ИСК для получения фосфатов аммония и их удобрительных смесей с максимальным выходом в кристаллическом виде из из хлорида аммония, фосфорной кислоты и диэтиламина при 40 и 45 °С.
Как влияет температура окончания процесса на выход фосфатов аммония в твердую фазу? Что, с точки зрения минимизации потерь, лучше получать: индивидуальные соли или их удобрительные смеси.
7.6.2. Решения заданий практической работы
Первое задание практической работы 7.7.1 предлагает построить диаграммы растворимости оконтуривающих систем. Определить тип систем, составить предполагаемый состав трояконасыщенного раствора и вычислить оптимальные составы ИСК для его определения
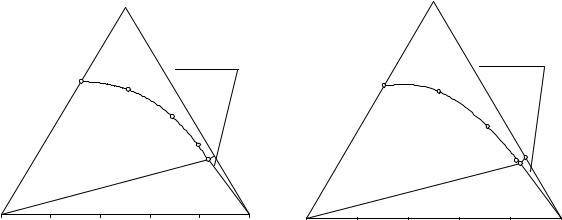
прогностическим методом, а также ответить на вопрос о том, к какому типу относятся эти изотермы растворимости и для каких технологических процессов могут быть использованы результаты исследования тройных оконтуривающих систем.
Изотерма растворимости тройной системы NH4H2PO4 - (C2H5)2NH2Cl - H2O при 40 и 45°С построена по данным табл. 7.26 и изображены на рис. 7. 1 и 7. 2. На изотерме растворимости имеются следующие фазовае области: поле ненасыщенных растворов (L); поле кристаллизации дигидрофосфата аммония (L+NH4H2PO4(S)); слабо развитое поле кристаллизации хлорида диэтиламмония (L+(C2H5)2NH2Cl(S)); область нонвариантного равновесия эвтонического раствора (Е13), кристаллов дигидрофосфата аммония и хлорида диэтиламмония ((C2H5)2NH2Cl(S)+ E13(L) + NH4H2PO4(S)). Растворимость дигидрофосфата аммония обозначена R1, а растворимость хлорида диэтиламмония - R3.
H2O |
|
|
|
H2O |
|
|
|
|
|
|
|
|
L+(C |
H ) NH Cl |
(S) |
L |
L+(C2H5)2NH2Cl(S) |
L |
2 |
5 2 2 |
R1 |
|
|
R1 |
|
|
|
|
L+NH4H2PO4(S)
 R3
R3
E13
L+NH H PO |
R3 |
||
4 |
2 |
4(S) |
|
E13 |
|
|
|
NH4H2PO4(S)+E13(L)+(C2H5)2NH2Cl(S) |
|
|
|
|
|
|
NH H PO +E |
+(C H ) NH Cl |
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
4 |
2 |
4(S) |
13(L) |
2 |
5 2 |
2 |
(S) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
40 % мас 60 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
0 |
20 |
80 |
100 |
0 |
|
20 |
40 % мас |
60 |
|
|
80 |
|
|
100 |
|||||||
|
|
NH4H2PO4 |
|
(C2H5)2NH2Cl |
|
NH H PO |
|
|
|
|
|
|
(C H ) NH Cl |
||||||||
|
|
|
|
|
|
|
4 |
2 |
4 |
|
|
|
|
|
|
2 |
|
5 2 |
2 |
|
|
|
|
Рис. 7. 1. Растворимость в системе |
|
Рис. 7. 2. Растворимость в системе |
|||||||||||||||||
NH4H2PO4 - (C2H5)2NH2Cl - H2O при 40°С |
NH4H2PO4 - (C2H5)2NH2Cl - H2O при 45°С |
||||||||||||||||||||
В системе NH4H2PO4 - (C2H5)2NH2Cl - H2O при 40 и 45ºC возможна реакция ионного обмена, следовательно, данная оконтуривающая система является диагональным разрезом четверной взаимной системы NH4+, (C2H5)2NH2+ // H2PO4-, Cl- - H2O. Изотерма растворимости при обеих температурах имеет простой эвтонический тип с явлением высаливания дигидрофосфата аммония, что свидетельствует о том, что четверная взаимная система NH4+, (C2H5)2NH2+ // H2PO4-, Cl- - H2O имеет стабильную диагональ.
Кроме того, результаты исследования данной системы позволяют определить оптимальные концентрационные условия синтеза (см. ниже) дигидрофосфата аммония из хлорида аммония, фосфорнойкислоты и диэтиламина по реакции: NH4Cl + H3PO4 +(C2H5)2NH = NH4H2PO4 + (C2H5)2NH2Cl.
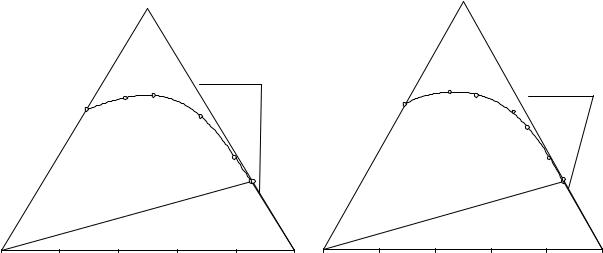
Изотерма растворимости тройной системы (NH4)2HPO4 - (C2H5)2NH2Cl - H2O при 40 и 45°С построена по данным табл. 7.27 и изображены на рис. 7. 3 и 7. 4.
На изотерме растворимости выявлены следующие фазовые области: поле ненасыщенных растворов (L); поле кристаллизации гидрофосфата аммония (L+(NH4)2HPO4(S)); слабо развитое поле кристаллизации хлорида диэтиламмония (L+(C2H5)2NH2Cl(S); область нонвариантного равновесия
эвтонического |
раствора (Е23), |
кристаллов гидрофосфата |
аммония и |
хлорида |
диэтиламмония |
((C2H5)2NH2Cl(S)+E23(L)+(NH4)2HPO4(S)). |
|
Растворимость |
гидрофосфата аммония обозначена R2, а |
растворимость |
|
хлорида диэтиламмония - R3.
В системе (NH4)2HPO4 - (C2H5)2NH2Cl - H2O при 40ºC возможна реакция ионного обмена, следовательно, данная оконтуривающая система является диагональным разрезом четверной взаимной системы NH4+, (C2H5)2NH2+ // HPO42-, Cl- - H2O. Изотерма растворимости при обеих температурах имеет простой эвтонический тип с явлением высаливания гидрофосфата аммония, что свидетельствует о том, что четверная взаимная система NH4+, (C2H5)2NH2+ // HPO42-, Cl- - H2O имеет стабильную диагональ.
H2O H2O
L |
L+(C2H5)2NH2Cl(S) |
L |
|
L+(C2H5)2NH2Cl(S) |
|
|
|
|
R2 |
|
R2 |
|
|
|
L+(NH4)2HPO4(S) |
|
L+(NH4)2HPO4(S) |
|
R3 |
R3 |
E23 |
E |
|
23 |
|
|
|
|
(NH4)2HPO4(S)+E23(L)+(C2H5)2NH2Cl(S) |
|
|
|
|
|
(NH4)2HPO4(S)+E23(L)+(C2H5)2NH2Cl(S) |
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0 |
20 |
40 |
% мас. 60 |
80 |
100 |
0 |
20 |
40 % мас. 60 |
80 |
|
100 |
||||
|
|
(NH4)2HPO4 |
|
|
(C2H5)2NH2Cl |
|
(NH4)2HPO4 |
|
(C H ) NH Cl |
||||||
|
|
|
|
|
|
|
|
|
|
|
|
2 |
5 2 |
2 |
|
|
|
Рис. 7. 3. Растворимость в системе |
|
|
|
|
Рис. 7. 4. Растворимость в системе |
|
|
||||||
|
|
(NH4)2HPO4 - Et2NH2Cl - H2O при 40°С |
|
|
|
|
(NH4)2HPO4 - Et2NH2Cl - H2O при 45°С |
||||||||
Кроме того, результаты исследования данной системы позволяют определить оптимальные концентрационные условия синтеза (см. ниже) гидрофосфата аммония из хлорида аммония, фосфорнойкислоты и диэтиламина по реакции: 2NH4Cl + H3PO4 + 2(C2H5)2NH = (NH4)2HPO4 +
2(C2H5)2NH2Cl.
Изотерма растворимости тройной системы NH4H2PO4 - (NH4)2HPO4 - H2O при 40 и 45°С построена по данным табл. 7.28 и изображены на рис. 7. 5 и 7. 6.
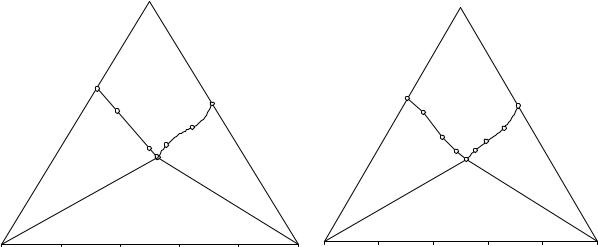
На изотерме растворимости выявлены следующие фазовае области: поле ненасыщенных растворов (L); поле кристаллизации дигидрофосфата аммония (L+NH4H2PO4(S)); поле кристаллизации гидрофосфата аммония (L+(NH4)2HPO4(S)); область нонвариантного равновесия эвтонического раствора (Е12), кристаллов дигидрофосфата аммония и гидрофосфата
аммония (NH4H2PO4(S)+E12(L)+(NH4)2HPO4(S)). Растворимость гидрофосфата аммония обозначена R2; растворимость дигидрофосфата аммония - R1.
Изотерма растворимости системы NH4H2PO4 - (NH4)2HPO4 - H2O при 45ºC имеет простой эвтонический тип с явлением взаимного всаливания фосфатов аммония.
H2O |
H O |
|
2 |
R1 |
L |
R1 |
L |
|
R2 |
||||
|
R2 |
|||
|
|
L+NH4H2PO4(S) |
E |
L+(NH ) HPO |
L+NH4H2PO4(S) |
|
L+(NH4)2HPO4(S) |
|
|
4 2 |
4(S) |
E |
|||
|
12 |
|
|
|
12 |
|
|
|
|
|
|
|
|
|
|
|
NH4H2PO4+E12(L)+(NH4)2HPO4 |
|
|
|
|
|
|
(NH4)2HPO4(S)+E12(L)+NH4H2PO4(S) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0 |
20 |
40 % мас. 60 |
80 |
|
100 |
||
0 |
20 |
40 % мас. 60 |
80 |
100 |
|
|||||||||
|
|
NH4H2PO4 |
|
(NH ) |
HPO |
|||||||||
|
|
NH4H2PO4 |
|
(NH ) HPO |
|
|
|
|
4 2 |
|
4 |
|||
|
|
|
|
4 2 |
4 |
|
|
|
|
|
|
|
|
|
|
|
Рис. 7. 5. Растворимость в системе |
|
|
|
|
Рис. 7. 6. Растворимость в системе |
|
|
|||||
|
|
NH4H2PO4 - (NH4)2HPO4 - H2O при 40°С |
|
|
|
|
NH4H2PO4 - (NH4)2HPO4 - H2O при 45°С |
|||||||
Кроме того, результаты исследования данной системы позволяют определить оптимальные концентрационные условия синтеза дигидрофосфата и гидрофосфата аммония из фосфорной кислоты и аммиака и их разделения методом политермической перекристаллизации.
Для определения предполагаемых составов тройных эвтонических растворов сведем в табл. 7. 32 все составы двойных эвтонических растворов при обеих температурах. Предполагаемый состав тройного эвтонического раствора (EPr) составим из двух двойных эвтонических растворов оконтуривающих систем (Е13 и Е23), содержащих максимальные количества высаливающего компонента и, в то же время, минимальные количества воды.
В качестве оптимального состава донной фазы (DOp) примем таковой с равным содержанием всех трех исходных солевых компонентов. Для вычисления оптимальных составов ИСК, лежащих на ноде EPr–DOp, воспользуемся уравнением прямой (6. 3). Коэффициент прямой зададим равным 0.15. Результаты вычислений округлим до 0.1 %.
Второе задание практической работы 7.7.1 просит построить основные проекции диаграммы растворимости четверной системы при
обеих температурах и ответить на вопрос о типе этих изотерм растворимости.
Таблица 7. 32 Вычисление оптимальных составов ИСК для определения тройного эвтонического
раствора в системе NH4H2PO4 - (NH4)2HPO4 - H2O при 40 и 45°С
Точка |
|
Состав, % мас |
|
|
|
Донная фаза |
|
NH4H2PO4 |
(NH4)2HPO4 |
Et2NH2Cl |
H2O |
|
|||
|
|
|
Температура |
40°С |
|
|
|
Е13 |
3.09 |
– |
70.16 |
|
26.75 |
|
NH4H2PO4+Et2NH2Cl |
Е23 |
– |
0.61 |
71.01 |
|
28.38 |
|
(NH4)2HPO4+Et2NH2Cl |
Е12 |
29.63 |
34.53 |
– |
|
35.84 |
|
(NH4)2HPO4+NH4H2PO4 |
EPr |
3.1 |
0.6 |
71.0 |
|
25.3 |
(NH4)2HPO4+NH4H2PO4+Et2NH2Cl |
|
ИСК1 |
7.6 |
5.5 |
65.4 |
|
21.5 |
|
|
DOp |
33.3 |
33.3 |
33.4 |
|
0.0 (NH4)2HPO4+NH4H2PO4+Et2NH2Cl |
||
|
|
|
Температура 45°С |
|
|||
Е13 |
3.44 |
– |
71.30 |
|
25.26 |
|
NH4H2PO4+Et2NH2Cl |
Е23 |
– |
0.60 |
72.33 |
|
27.07 |
|
(NH4)2HPO4+Et2NH2Cl |
Е12 |
30.41 |
34.66 |
– |
|
34.93 |
|
(NH4)2HPO4+NH4H2PO4 |
EPr |
3.4 |
0.6 |
72.0 |
|
24.0 |
(NH4)2HPO4+NH4H2PO4+Et2NH2Cl |
|
ИСК2 |
7.9 |
5.5 |
66.2 |
|
20.4 |
|
|
DOp |
33.3 |
33.3 |
33.4 |
|
0.0 (NH4)2HPO4+NH4H2PO4+Et2NH2Cl |
||
|
Изотерма |
растворимости |
четверной |
системы NH4H2PO4 - |
|||
(NH4)2HPO4 - (C2H5)2NH2Cl - H2O |
при 40°С построена по данным табл. |
||||||
7.29 и изображена на рис. 7. 7-10. |
|
|
|
|
|||
|
На рис. |
7. 7 представлена |
ортогональная проекция изотермы |
||||
растворимости системы NH4H2PO4 - (NH4)2HPO4 - (C2H5)2NH2Cl - H2O при
40ºC на плоскость, параллельную двум непересекающимся ребрам тетраэдра состава, на рис. 7. 9 изображена проекция этой изотермы на солевое основание концентрационной фигуры.
При помощи рис. 7. 7 рассмотрим объемное строение изотермы растворимости четверной водно-солевой системы с явлением расслаивания. На изотерме растворимости имеются: точка нонвариантного тройного эвтонического раствора (Е), насыщенного относительно всех трех солевых компонентов системы; предельная монотектическая нода (LHLB), отображающая равновесие кристаллов гидро- и дигидрофосфата аммония и двух жидких фаз.
В системе также имеются: линия моновариантных равновесий кристаллов гидрофосфата аммония, хлорида диэтиламмония и жидкой фазы (E23E); линия моновариантных равновесий кристаллов дигидрофосфата аммония, хлорида диэтиламмония и жидкой фазы (E13E); линия двояконасыщенных растворов относительно кристаллов гидрофосфата аммония, дигидрофосфата аммония и жидкой фазы, разрываемая предельной монотектической нодой (LHLB) на две части (E12LH и LBE). Линии моновариантных монотектических равновесий кристаллов гидрофосфата аммония и двух жидких фаз (на рис. 7. 8 аналогичная линия LHDLB изображена пунктирной линией), кристаллов
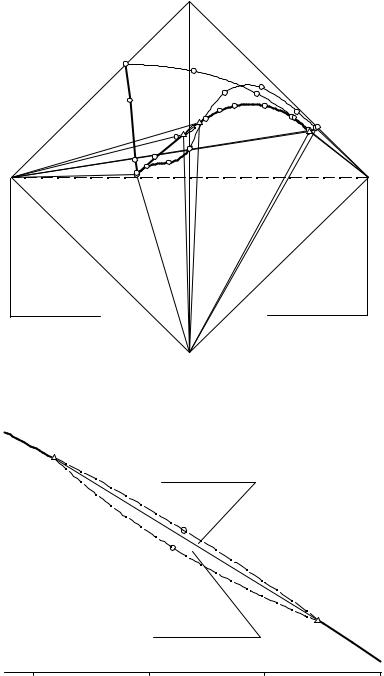
дигидрофосфата аммония и двух жидких фаз (на рис. 7. 8 аналогичная линия LHMLB изображена пунктирной линией) изучить не удалось.
H2O
R1
L LB |
E13 |
|
H |
R3 |
|
E |
||
E |
||
R2 |
23 |
|
|
E12 |
NH4H2PO4 |
(C2H5)2NH2Cl |
(NH4)2HPO4
Рис. 7. 7. Изотерма растворимости системы NH4H2PO4 - (NH4)2HPO4 - (C2H5)2NH2Cl - H2O при 40ºC
|
NH4H2PO4 |
|
|
|
|
|
LH |
|
|
|
|
|
L1+L2+NH4H2PO4 |
|
|
|
|
|
M |
|
|
|
|
|
D |
|
|
|
|
|
(NH4)2HPO4 |
|
|
|
|
|
L1+L2+(NH4)2HPO4 |
LB |
|
|
|
|
|
|
|
|
|
48 |
52 % мас. |
56 |
|
|
60 |
(NH4)2HPO4 |
(C |
H ) NH Cl |
|||
|
|
2 |
5 |
2 |
2 |
Рис. 7. 8. Перспективная проекция системы NH4H2PO4 - (NH4)2HPO4 - (C2H5)2NH2Cl - H2O в области предельного монотектического равновесия при 40ºC
На рис. 7. 7 также отображены: поверхность растворов, насыщенных относительно гидрофосфата аммония (R2E12LHLBЕE23), дигидрофосфата аммония (R1E12LHLBЕE13), хлорида диэтиламмония (R3E23EE13); поверх-
ность монотектического равновесия двух расслаивающихся жидкостей полностью оконтурить не удалось.
Кроме того, на изотерме имеются: объем ненасыщенных растворов
(H2OR2E23R3E13 |
ELBDLHMLBE12R1H2O); объем кристаллизации |
||
гидрофосфата аммония ((NH4)2HPO4R2E23ELBDLHE12R2(NH4)2HPO4); объем |
|||
кристаллизации |
хлорида |
диэтиламмония |
((C2H5)2NH2Cl |
R3E23EE13R3(C2H5)2NH2Cl); объем кристаллизации дигидрофосфата
аммония (NH4H2PO4R1E13ELBMLHE12R1 NH4H2PO4); объем совместной кристаллизации гидрофосфата аммония и хлорида диэтиламмония
((NH4)2HPO4E23E(C2H5)2NH2Cl); объем совместной кристаллизации дигидрофосфата аммония и хлорида диэтиламмония
(NH4H2PO4E13E(C2H5)2NH2Cl NH4H2PO4); объем совместной кристаллизации гидрофосфата аммония и дигидрофосфата аммония
разделен объемом предельного монотектического равновесия на две части
(NH4H2PO4E12LH (NH4)2HPO4 и NH4H2PO4LВE(NH4)2HPO4); объем совместного существования кристаллов гидрофосфата аммония и двух
жидких фаз ((NH4)2HPO4LHDLB (NH4)2HPO4) и объем совместного существования кристаллов дигидрофосфата аммония и двух жидких фаз (NH4H2PO4LHMLB NH4H2PO4) полностью оконтурить не удалось; объем четырехфазного эвтонического равновесия кристаллов всех трех солевых компонентов и эвтонического раствора ((NH4)2HPO4(C2H5)2NH2Cl NH4H2PO4Е); объем четырехфазного монотектического равновесия кристаллов гидрофосфата аммония, дигидрофосфата аммония и двух жидких фаз (NH4H2PO4LВLH(NH4)2HPO4).
На рис. 7. 8 представлена перспективная проекция системы
NH4H2PO4 - (NH4)2HPO4 - (C2H5)2NH2Cl - H2O в области предельного монотектического равновесия при 40ºC в увеличенном масштабе.
На перспективной проекции имеется поле совместной кристаллизации гидрофосфата и дигидрофосфата аммония, располагающийся над предельной монотектической нодой (LHLB), поверхностью монотектического равновесия кристаллов гидрофосфата аммония и двух жидких фаз (LHLBD) и поверхностью монотектического равновесия кристаллов дигидрофосфата аммония и двух жидких фаз
(LHLBM).
Перспективная проекция изотермы растворимости описываемой четверной системы, изображенная на рис. 7. 9, выглядит значительно проще и позволяет планировать эксперимент по изучению системы.
На перспективной проекции имеются: точка (Е), отображающая солевой состав тройного эвтонического раствора, насыщенного относительно всех трех солевых компонентов системы; предельная монотектическая нода (LHLB), отображающая нонвариантное равновесие кристаллов гидрофосфата, дигидрофосфата аммония и двух жидких фаз - нижней и верхней, солевой состав которых отображаются точками LH и LB
