лр5
.docРабота 5
ПОТЕНЦИОМЕТРИЧЕСКИЙ МЕТОД ОПРЕДЕЛЕНИЯ ФОТОИНДУЦИРУЕМЫХ ИЗМЕНЕНИЙ рН В СУСПЕНЗИИ ХЛОРОПЛАСТОВ
Изолированные хлоропласты при освещении способны осуществлятьпроцессы поглощения протонов, сопряженных с фотоиндуцированным током электронов в электрон-транспортной цепи. Процесс поглощения протонов хлоропластами сопровождается изменениями рН в наружном растворе. Кинетика фотоиндуцированных обратимых изменений рН в суспензии хлоропластов детально исследована рядом авторов. В настоящее время, индуцируемое светом поглощение протонов хлоропластами рассматривается в связи с их функциями запасания энергии в процессе фотосинтеза. В соответствии с теорией Митчелла транспорт электронов в хлоропластах индуцирует перенос протонов через сопрягающую мембрану. В результате возникает градиент протонов, который является движущей силой для реакций синтеза АТФ, осуществляемых терминальной АТФ-синтезирующей системой, локализованной в мембране. Механизм «протонного насоса» изучен недостаточно. Однако экспериментально показана зависимость величины возникающего на свету градиента Н+ от интенсивности света скорости тока электронов в цепи, окислительно-восстановительного состояния переносчиков, присутствия ряда кофакторов, состояния и свойств компонентов мембраны. Создание определенной величины градиента необходимо для протекания реакций синтеза АТФ и проявления активности ряда АТФ-аз. Таким образом, амплитуда фотоиндуцируемого изменения рН в суспензии хлоропластов может быть показателем активности ряда сопряженных с током электронов реакций -–образования трансмембранного протонного градиента, реакций синтеза или гидролиза АТФ и др. В последние годы потенциометрический метод регистрации изменений рН в суспензии хлоропластов был разработан для определения активности циклического фотофосфорилирования, нециклического фотофосфорилирования, сопряженного с восстановлением феррицианида калия, активности АТФ-аз, скорости реакции Хилла. Потенциометрический метод определния фотоиндуцируемых изменений рН в суспензии хлоропластов для характеристики процессов циклического фотофосфорилирования впервые был предложен Нишимура, Ито и Чансом в 1962 году. Метод основан на регистрации изменений рН в реакционной смеси в результате сопряженных с фосфорилированием процессов поглощения или выделения ионов Н+. При освещении изолированных хлоропластов в среде, содержащей фосфатакцепторную систему и кофакторы циклического фотофосфорилирования, происходит изменение концентрации ионов Н+ в соответствии с уравнением:
![]()
При фосфорилировании АДФ число кислотных групп уменьшается, в результате чего происходит подщелачивание среды. Исследования показали, что существует определенное стехиометрическое соотношение между поглощением Н+ , током электронов и синтезом АТФ. При добавлении в реакционную смесь разобщающих агентов или ингибиторов фотофосфорилирования амплитуда фотоиндуцируемых изменений рН резко уменьшается или исчезает полностью. Следовательно, скорость фосфорилирования можно оценивать потенциометрически по изменениям рН в суспензии хлоропластов, которые сопровождают процесс фосфорилирования АДФ, Изменение рН может быть измерено с помощью чувствительных рН- метров. Определения проводятся при рН 7,0-8,5. Преимуществом данного метода является высокая чувствительность, значительная быстрота определения (2-3 мин), возможность исследования процесса фотофосфорилирования в динамике. К недостаткам метода следует отнести невозможность одновременного исследования нескольких проб, определение активности фотофосфорилирования разных вариантов проводится последовательно. Это может внести некоторую погрешность при значительном изменении активности процесса во времени. С увеличением буферной емкости точность определения и чувствительность метода снижаются. Необходимо иметь в виду, что в процессе определения меняется рН и значительное отклонение от оптимального рН может исказить результаты.
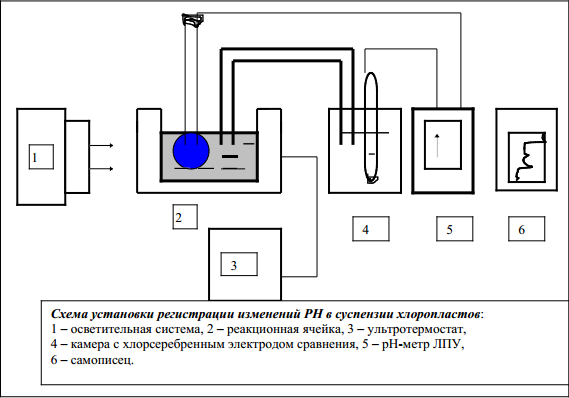
Установка для регистрации фотоиндуцируемых изменений Рн в суспензии хлоропластов
Измерение концентрации ионов водорода проводится потенциометрическим методом. Потенциометрический метод определения активности водородных ионов основан на изменении электродвижущей силы (ЭДС) гальванического элемента, состоящего из двух электродов –индикаторного электрода, потенциал которого зависит от активности водородных ионов исследуемого раствора, и электрода сравнения с устойчивым и известным потенциалом. Электродами сравнения при измерении рН могут служить каломельный и хлорсеребряный электроды. В качестве индикаторного электрода обычно используют стеклянный электрод. Стеклянный электрод представляет трубку, которая заканчивается тонкостенным полым шариком из специального легкоплавкого стекла с высоким содержанием окиси лития или окиси натрия. Внутренняя часть стеклянного электрода заполнена буферным раствором с определенной концентрацией Н+ ионов или раствором HCl (0,1 н), в который погружен хлорсеребряный электрод. Мембрана стеклянного электрода проницаема для ионов водорода и способна к обмену ионов натрия или лития на ионы Н+ из раствора. Вследствие этого на внутренней и наружной поверхностях стеклянного шарика устанавливается ионное3 равновесие, которое определяет потенциал обеих поверхностей шарика. Поскольку состав раствора внутри шарика остается постоянным, потенциал стеклянного электрода является функцией величины рН исследуемого раствора. При погружении стеклянного электрода в раствор между поверхностью стекла и исследуемым раствором возникает разность потенциалов Ех, величина которой определяется активностью ионов водорода в растворе
![]()
где R – универсальная газовая постоянная, равна 8,315 107 эрг/моль;
Т – температура растворов, К;
F – 96500 кулон/г-экв (число Фарадея);
dн – активность ионов водорода в растворе;
рН – рН раствора.
Система, состоящая из двух электродов, растворы которых сообщаются между собой, образует гальванический элемент (см. рис.). В том случае, когда потенциалы электродов различны, в гальванической цепи возникает ток с ЭДС, равной разности электродных потенциалов. Суммарная ЭДС электродной системы линейно зависит от величины рН раствора. Измеряя ЭДС с помощью электронного милливольтметра, определяют величину Рн исследуемого раствора. Для регистрации небольших изменений рН в среде в настоящее время используют установку, представленную на рис. Установка включает осветительную систему 1, реакционную ячейку 2, ультратермостат 3, камеру с хлорсеребряным электродом сравнения 4, рН-метр ЛПУ-01 5 и электронный автоматический потенциометр типа ЭПП-09 или КСП-4 6. Источником света служит проекционная кинолампа с интенсивностью освещения около 50000 лк. Между источником света и ячейкой помещается водный кран. Реакционная ячейка представляет собой круглую цилиндрическую кювету объемом 5-10 мл, с диаметром около 20 мм и глубиной 15-20 мм. Для стабилизации температуры ячейка помещается в термостатированную ванну, соединенную с ультратермостатом. Опыт проводят при температуре 18-20С. Перемешивание суспензии в ячейке осуществляется с помощью магнитной мешалки.
Датчиком ЭДС служит стеклянный электрод, помещенный непосредственно в реакционную кювету. Электродом сравнения может служить хлорсеребряный или каломельный электрод, соединенный с реакционной кюветой агар-агар-KCl-мостиком. Последний представляет капилляр диаметром 0,2 мм, наполненный 3% раствором агар-агара с насыщенным раствором KCl. В период между определениями электроды хранятся в дистиллированной воде. Кювета с электродами экранирована металлической сеткой, чтобы снизить электростатические помехи.4 регистрация фотоиндуцированных изменений рН осуществляется с помощью усилителя ЛПУ-01 и электронного потенциометра ЭПП-09 или КСП-4. ЭДС, возникающие при изменении рН в реакционной смеси при включении и выключении света, передаются на усилитель и затем регистрируются самописцем. На диаграммной ленте самописца при включении и выключении света вычерчивается кривая, характеризующая фотоиндуцированные изменения концентрации ионов Н+ в растворе. Повышение чувствительности усилителя ЛПУ-01 в схеме прибора достигается заменой выходного сопротивления R 72 (50 Ом) на 400 Ом; сопротивление R 71 шунтировано сопротивлением 15 Ом. В результате вся шкала самописца соответствует 0,1-0,2 ед. рН, а цена деления 1 см на диаграммной ленте 0,005 ед. рН.
Методы выделения хлоропластов
Получение функционально активных препаратов изолированных хлоропластов необходимо при проведении большинства исследований, связанных с выяснением механизма фотосинтеза: при определении фосфорилирующей и восстановительной активности хлоропластов, изучении их химического состава, структуры и т.д. В зависимости от цели эксперимента в настоящее время для выделения хлоропластов используют методы дифференциального центрифугирования и центрифугирования в градиенте плотности.
Метод дифференциального центрифугирования и выделения хлоропластов.
Данный метод включает растирание навески листьев со средой выделения, приготовление гомогената и его последующее центрифугирование со скоростями, позволяющими отделить фракцию хлоропластов от других более тяжелых и более легких компонентов клетки.
В качестве среды выделения могут быть взяты водные растворы хлористого натрия, сахарозы с определенной величиной осмотического давления.
При определении фосфорилирующей и восстановительной активности хлоропластов обычно используют водные среды выделения. Они должны быть изотоничны и химически инертны по отношению к компонентам хлоропластов, должны иметь определенную величину рН, что достигается добавлением фосфатного буфера, трис-глицинатного буфера или других буферных систем.
Обычно для выделения хлоропластов используют водные среды выделения следующих составов:
Среда выделения 1. MgCl2 – 1 мМ, NaCl – 5 мМ, КН2РО4 – 1 мМ, АДФ –0,5 мМ, ФМС – 0,02 мМ. Среда выделения 2. сахароза – 0,4 М, NaCl -0.01 M, Трис-НС1 буфер рН-7,8 - 0,025 М.5
Среда выделения 3. сахароза 0,4 М, NaCl – 0.01 M, рН среды устанавливают около 7,8 концетрированной NaOH.
Для сохранения нативных свойств хлоропластов в среду выделения иногда добавляют восстановители (аскорбат), сульфгидрильные соединения (цистеин, глютатион), а также стабилизирующие факторы (альбумин, фикол, полиэтиленгликоль).
Выделение хлоропластов. Навеску свежих листьев (примерно 2 г) растирают в охлажденной ступке в 10 мл среды выделения. Гомогенат фильтруют через два слоя марли, переносят в центрифужную пробирку и центрифугируют при 1000 об/мин в течение 3-х мин. Осадок, содержащий обрывки тканей, неразрушенные клетки отбрасывают, а надосадочную жидкость повторно центрифугируют 10 мин при 3000 об/мин. Затем надосадочную жидкость сливают, а осадок хлоропластов суспендируют стеклянной палочкой в 1 мл среды выделения и переносят в стаканчик на 50мл, добавив туда 30 мл среды выделения.