
- •Глава 9. Аналитические реакции четвертой группы катионов
- •Реакции ионов магния
- •3. Реакция с гидрофосфатом натрия.
- •5. Реакция с 8-оксихинолином.
- •6. Реакция с магнезоном II.
- •Реакции ионов марганца (II)
- •2. Реакция с водным раствором аммиака.
- •3. Реакция с сульфидом аммония.
- •Реакции ионов железа (II)
- •Реакции ионов железа (III)
- •3. Реакция с желтой кровяной солью (гексацианоферратом (II) калия).
- •5. Реакция с сульфосалициловой кислотой.
- •Систематический ход анализа катионов IV аналитической группы
3. Реакция с желтой кровяной солью (гексацианоферратом (II) калия).
Гексацианоферрат (II) калия осаждает ион железа (III) в виде ферроцианида железа:
4FeС13 + 3K4[Fe(CN)6] = Fe4[Fe(CN)6]3 + 12КС1
Образуется осадок берлинской лазури, при малых концентрациях Fe3+ раствор окрашивается в синий цвет.
Условия проведения реакции:
рН ~ 2. В щелочной среде происходит разложение берлинской лазури:
Fe4[Fe(CN)6]3 + 12NaOH = 4Fe(ОН)3 + 3Na4[Fe(CN)6],
а в сильнокислой среде осадок растворяется.
2) Осаждению мешает избыток реактива, ведущий к образованию растворимой формы берлинской лазури, переходящей в коллоидный раствор состава KFe[Fe(CN)6].
3) Мешают окислители, окисляющие K4[Fe(CN)6] до К3[Fe(CN)6], и восстановители, восстанавливающие Fe3+ до Fe2+. Проведению реакции мешает также присутствие фторидов, фосфатов, тартратов, оксалатов, связывающих ионы железа в прочные комлексные соединения.
4) Растворы железа (II), в которых вследствие окисления всегда присутствуют ионы Fe3+, также будут давать осадок с K4[Fe(CN)6], однако он будет не темно-синего, а голубого цвета.
Выполнение реакции: к 2–3 каплям раствора соли железа (III) добавляют 3–4 капли дистиллированной воды, 1–2 капли раствора НСl и 2 капли раствора гексацианоферрата (II) калия. Образуется синий осадок.
4. Реакция с тиоцианатом аммония или калия (одна из наиболее характерных и чувствительных реакций на Fe3+).
Тиоцианат (устаревшее название роданид) аммония образует с ионами железа (III) раствор кроваво-красного цвета:
FeС13 + 3 NH4NCS = Fe(NCS)3 + 3NH4Cl
Приведенное уравнение характеризует реакцию лишь в общем виде, в действительности же в зависимости от избытка тиоцианат-ионов образуются окрашенные комплексные ионы состава [Fe(NCS)n](–n+3). Чувствительность реакции повышается при извлечении тиоцианата железа амиловым спиртом.
Условия проведения реакции:
1) рН ~ 2. 2) Избыток раствора тиоцианата, усиливающий окраску.
3) Проведению реакции мешают большие количества катионов кобальта, меди, висмута и ртути, а также анионы фосфорной, фтороводородной, щавелевой, винной и некоторых других кислот, образующих с Fe3+ устойчивые комплексные соединения, например [FeF6]3–. Кроме этого, мешают проведению реакции нитрит-ионы, которые образуют с NCS– окрашенное в красный цвет соединение NONCS.
Характерной реакцией при обнаружении железа (III) является переход кроваво-красной окраски тиоцианата железа в синий осадок берлинской лазури.
Выполнение реакции: к 4–5 каплям анализируемого раствора прибавляят 2 мл воды, 5–6 капель серной кислоты (1:3) и 0,5 мл концентрированного раствора КNCS. Затем к кроваво-красному раствору добавляют 1мл раствора K4[Fe(CN)6] и наблюдают переход окраски из красной в синюю.
5. Реакция с сульфосалициловой кислотой.
Сульфосалициловая кислота в кислых растворах при рН 2–2,5 образует с ионом железа (III) устойчивый комплекс винно–красного цвета.
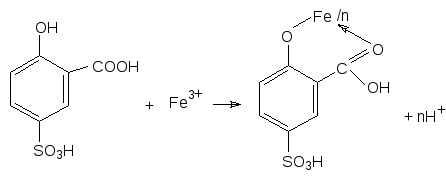
При рН ~ 10 образуется комплекс желтого цвета.
Выполнение реакции: на кусочек фильтровальной бумажки помещают каплю исследуемого раствора, 1 каплю 2 М раствора HCl и 3 капли 10 %-ного раствора сульфосалициловой кислоты. В присутствии железа (III) появляется вишневое окрашивание. Реакции мешает присутствие катиона Sn2+. Из анионов мешают фторид, фосфат, оксалат и некоторые другие.
Реакция с антипирином или диантипирилметаном.
Антипирин или диантипирилметан (раствор в НCl) при взаимодействии с ионами Fe3+ в слабокислой среде образуют соединения, окрашенные в красный цвет.
