
Khimia_Abakumova_08_1-80
.pdf
|
|
|
|
|
|
Активированный |
|
|||||
|
E |
|
|
|
|
|
||||||
|
|
|
|
|
|
|
комплекс |
|
||||
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
Eа |
||||
|
|
|
|
|
|
|
|
|
|
|
||
|
E1 |
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|||||
Исходные |
||||||||||||
|
|
|
|
|
вещества |
|
|
|||||
|
|
|
|
|
|
H |
|
|||||
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
E2 |
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
Продукты |
||||||
|
|
|
|
|
|
|
|
|
|
|
реакции |
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
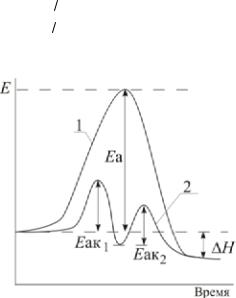
Рис. 1. Энергетическийбарьер реакции
Пример 4. При повышении температуры на 70° скорость реакции возрослав200 раз. Найтитемпературныйкоэффициентскоростиреакции.
Решение. Воспользуемся правилом Вант-Гоффа (4.7):
vt2 |
|
t |
70 |
; γ 7 200 2,13. |
|||
γ |
|
; 200 |
γ |
|
|||
10 |
|||||||
10 |
|||||||
v |
|||||||
t1
Пример5. При150 °Снекотораяреакциязаканчиваетсячерез15 с. Через какое время закончится реакция при 100 °С, если температурный коэффициент скорости реакции равен 2?
Решение. Так каквремяΩ протеканияреакцииобратноеескорости, уравнение (4.7) запишем в виде
Ωt1 |
|
t2 t1 |
Ω100 |
|
150 100 |
|||
γ |
|
; |
2 |
|
, откуда Ω = 480 с. |
|||
10 |
10 |
|||||||
|
||||||||
Ωt2 |
|
|
|
15 |
|
100 |
||
|
|
|
|
|
|
|||
Пример 6. Энергия активации реакции O3 + NO = O2 + NO2 равна 75 кДж/моль. Во сколько раз изменится скорость этой реакции при повышении температуры от 25 до 35 °С?
Решение. Воспользуемся уравнением Аррениуса (4.9):
k |
|
|
ZPe Ea |
R308 |
|
75 103 |
(1 298 1 308) |
35 |
|
e 8,314 |
|||||
|
|
|
|
2,67. |
|||
k25 |
|
ZPe Ea |
R298 |
||||
|
|
|
|
||||
Таким образом, скорость реакции возрастет в 2,67 раза.
4.4. Влияние катализатора на скорость реакции
Катализатором называется вещество, которое изменяет скорость реакции, участвует в реакции, но в конечные вещества не входит. Влияние катализатора на скорость реакции называется катализом. Скорость химической реакции в присутствии катализатора может увеличиваться (положительныйкатализ) илиуменьшаться(отрицательныйкатализ, или ингибирование). В зависимости от того, находится ли катализатор в одной фазе с реагирующими веществами или образует отдельную фазу, различают гомогенный и гетерогенный катализ.
Действие положительных катализаторов сводится к уменьшению энергии активации реакции, при этом общее число активных молекул возрастает, скорость реакции увеличивается.
Механизм действия катализатора может быть самым разнообразным и, как правило, очень сложным. В случае гомогенногокатализа механизмдействиякатализаторасвязываютобычнос образованиемактивных промежуточных соединений. Например, химическая реакция
A + B = AB
в присутствии катализатора протекает в несколько стадий: катализатор взаимодействует с одним из веществ с образованием промежуточного соединения
A + kat = Akat,
затем промежуточное соединение Akat взаимодействует с другим исходным веществом В, образуя конечный продукт реакции и выделяя катализатор в его первоначальном виде:
Akat + B = AB + kat.
Вслучаеположительногокатализа (рис. 2) энергииактивации всех промежуточныхстадийреакции(Еак1 иЕак2) должныбытьнижеэнергии активации без катализатора (Еа).
Пример7. Энергияактивациинекоторойреакциибезкатализатора Еа равна75,4 кДж/моль, аскатализаторомЕак= 53,0 кДж/моль. Восколько раз возрастает скорость реакции в присутствии катализатора, если реакция протекает при 25 °С?
Решение. Обозначим константу скорости в присутствии катализатора kк. Воспользуемся уравнением Аррениуса (4.9):
4 0 |
4 1 |
|
k |
|
|
|
ZP Eак RT |
|
|
|
Ea Eак |
|
(75,4 53)103 |
|
|
|
4.4. При 20 °С скорость некоторой химической реакции равна |
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 ммоль/(л с). При 80 °С скорость увеличивается до 100 ммоль/(л с). |
||||||||||||
|
|
|
|
|
|
|
8,314 298 |
|
|
|
|
||||||||||||||||
|
к |
|
|
|
e RT |
|
|
e |
8443. |
|
|||||||||||||||||
|
|
|
|
|
e |
|
|
|
|
||||||||||||||||||
|
k |
|
|
ZP Eа RT |
|
|
|
|
|
Рассчитать скорость реакции при температуре 50 °С. |
|||||||||||||||||
|
|
|
|
|
|
e |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Ответ: 9,9 ммоль/(л с). |
|
||
Таким образом, скорость реакции возрастет в 8443 раза. |
|
|
|||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4.5. Найти значение энергии активации реакции, если при повы- |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
шении температуры от 100 до 130 °С ее скорость увеличилась в 20 раз. |
|||
|
|
|
|
E |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Ответ: 124,8 кДж/моль. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4.6. Катализаторпонижаетэнергиюактивациинекоторойреакции |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
на 20 кДж/моль. Во сколько разувеличитсяскоростьэтой реакции, если |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
Ea |
|
|
|
|
|
|
|
|
|
|
|
ее проводить при температуре 30 °С? |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Ответ: ~ в 2805 раз. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4.7. Написать выражение закона действия масс для следующих |
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
реакций: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Ea |
а) 2H2 + O2 = 2H2O |
б) CO2 + C = 2CO |
||||
|
|
|
|
|
|
|
|
|
Eaк1 |
|
|
|
|
|
|
|
Н |
|
|||||||||
|
|
|
|
|
|
|
|
|
|
E к |
|
|
|
|
|
|
в) N2 + O2 = 2NO |
г) Fe2O3 + 3H2 = 2Fe + 3H2O |
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
a 2 |
|
|
|
|
|
|
|
|
4.8. Как изменится скорость реакции 2NO + O2 = 2NO2: а) если |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
давлениеувеличитьв3 раза; б) концентрациюоксидаазота(II) уменьшить |
||
|
|
|
|
|
|
Рис. 2. Энергетическаясхема реакции: |
|
в 2 раза? |
|
||||||||||||||||||
|
|
|
|
|
|
|
Ответ: а) увеличится в 27 раз; б) уменьшится в 4 раза. |
||||||||||||||||||||
|
|
|
|
1 – безкатализатора, 2 – с катализатором |
|
4.9. При температуре 20 °С реакция протекает за 1 ч. Температур- |
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ный коэффициент скорости реакции равен 2,5. При какой температуре |
||
|
|
|
|
|
|
|
|
|
|
ЗАДАЧИ |
|
|
|
|
|
|
|
|
реакция закончится за 5 мин? |
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Ответ: ~ 47 °С. |
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
4.1. Как изменится скорость реакции SO2 |
+ 2H2S = 3S + 2H2O: |
4.10. Насколькоградусовнужноповыситьтемпературупроведения |
|||||||||||||||||||||||||
некоторой реакции (ϑ = 3), чтобы скорость ее возросла: а) в 20 раз; б) в |
|||||||||||||||||||||||||||
а) еслиувеличитьконцентрациюоксида серы (IV) в3 раза; б) увеличить |
|||||||||||||||||||||||||||
100 раз? |
|
||||||||||||||||||||||||||
концентрацию сероводорода в 3 |
раза; |
в) увеличить концентрацию |
|
||||||||||||||||||||||||
Ответ: а) ~ на 27 град; б) ~ на 42 град. |
|||||||||||||||||||||||||||
и оксида серы (IV) и сероводорода в 3 раза? |
|
|
|
|
|||||||||||||||||||||||
|
|
|
|
4.11. Энергияактивациинекоторойреакциисоставляет98,12 кДж/моль, |
|||||||||||||||||||||||
Ответ: а) увеличитсяв3 раза; б) увеличитсяв9 раз; в) увеличится |
|||||||||||||||||||||||||||
привведениикатализатораэнергияактивацииснижаетсядо79,81 кДж/моль. |
|||||||||||||||||||||||||||
в 27 раз. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Восколькоразувеличитсяскоростьреакции, протекающейвприсутствии |
||||
4.2. Реакция протекает по уравнению O2 + 2SO2 |
= 2SO3. |
||||||||||||||||||||||||||
катализатора при температуре 100 °С? |
|||||||||||||||||||||||||||
Как с помощью изменения концентраций реагирующих веществ |
|||||||||||||||||||||||||||
Ответ: ~ в 367 раз. |
|
||||||||||||||||||||||||||
увеличить скорость реакции в 9 раз? (Предложить минимум три |
|
||||||||||||||||||||||||||
4.12. Катализатор снижает энергию активации некоторой реакции |
|||||||||||||||||||||||||||
варианта.) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
на 22 кДж/моль. Рассчитать, как изменится скорость этой реакции |
||||
4.3. Температурный коэффициент скорости реакции равен 3,5. |
|||||||||||||||||||||||||||
в присутствии катализатора при температуре 75 °С. |
|||||||||||||||||||||||||||
На сколько градусов нужно увеличить температуру, чтобы скорость |
|||||||||||||||||||||||||||
Ответ: ~ в 2006 раз. |
|
||||||||||||||||||||||||||
реакции возросла: а) в 50 раз; б) в 150 раз? |
|
|
|
|
|
||||||||||||||||||||||
Ответ: а) на 30 °С; б) на 40 °С.
4 2 |
4 3 |
4.13. Как изменится скорость реакции 2NO + Cl2 = 2NOCl, если одновременно концентрацию оксида азота (II) увеличить в 3 раза, а концентрацию хлора уменьшить в 3 раза?
Ответ: увеличится в 3 раза.
4.14. Во сколько раз увеличится скорость реакции:
а) 2Fe + O2 = 2FeO б) 4P + 5O2 = 2P2O5 в) 4Al + 3O2 = 2Al2O3
если их проводить не на воздухе, а в среде чистого кислорода? (Концентрацию кислорода в воздухе принять за 20 % об.)
Ответ: а) в 5 раз; б) в 3125 раз; в) в 125 раз.
4.15.Приувеличениитемпературыот30 до60 °Сскоростьреакции возрослав64 раза. Какизменитсяскоростьэтойреакцииприуменьшении температуры от 30 до 20 °С?
Ответ: уменьшится в 4 раза.
4.16.Температурный коэффициент скорости некоторой реакции
равен 2,2. При температуре 300 °С константа скорости реакции равна 2 10–3. Найти константу скорости при 400 °С.
Ответ: 5,31.
4.17.При уменьшении температуры от 40 до 20 °С реакция замедлилась в 10 раз. Рассчитать энергию активации этой реакции.
Ответ: 87,78 кДж/моль.
4.18.При 20 °С в присутствии катализатора реакция протекает
в10000 раз быстрее, чем без катализатора. Найти энергию активации реакциискатализатором, еслиэнергияактивациибезкатализатораравна
101,8 кДж/моль.
Ответ: 79,36 кДж/моль.
4.19.Написать выражение закона действия масс для реакции 2Fe +
+ 3Cl2 = 2FeCl3. Восколькоразувеличитсяскоростьреакции, еслиобъем реакционного сосуда уменьшить в 2,5 раза?
Ответ: увеличится в 15,625 раз.
4.20.Гомогенная реакцияпротекаетпоуравнению 3A2 + B2 = 2A3B. Концентрацию В2 уменьшили в 15 раз. Как нужно изменить концентрацию А2, чтобы скорость прямой реакции осталась прежней?
Ответ: увеличить в 2,47 раза.
4.21.Температурный коэффициент скорости некоторой реакции равен 2,8. Как изменится скорость реакции: а) при увеличении температуры на 30 °С; б) увеличении температуры на 70 °С; в) уменьшении температуры на 50 °С?
Ответ: а) увеличится ~ в 22 раза; б) увеличится ~ в 1350 раз; в) уменьшится в 172 раза.
4.22.Константа скорости реакции при 0 и 40 °С равна 2 10–3 и 0,1 соответственно. Определитьтемпературныйкоэффициентскоростиэтой реакции.
Ответ: ~ 2,66.
4.23.Как нужно изменить давление, чтобы скорость реакции
2CO + O2 = 2CO2: а) увеличилась в 100 раз; б) уменьшилась в 10 раз? Ответ: а) увеличить в 4,64 раза; б) уменьшить в 2,15 раз.
4.24.Гомогенная реакция протекает по уравнению 4NH3 + 5O2 =
=4NO + 6H2O. Как измениться скорость реакции, если объем реакционного сосуда уменьшить в 2 раза?
Ответ: увеличится в 512 раз.
4.25.При понижении температуры на 60 °С реакция замедлилась в 64 раза. Определить температурный коэффициент скорости этой реакции.
Ответ: 2.
4.26.Прикакойтемпературереакциязакончитсячерез20 мин, если при температуре 20 °С для завершения реакции требуется 3 ч. Температурный коэффициент реакции равен 3.
Ответ: 40°С.
4.27.Энергияактивацииреакцииравна74,44 кДж/моль. Восколько разизменитсяскоростьреакции, еслиувеличитьтемпературупроведения реакции от 0 до 30 °С?
Ответ: ~ в 26 раз.
4.28.При температуре 0 °С реакция протекает со скоростью
2 моль/(л мин), при температуре 50 °С – 80 моль/(л мин). Рассчитать скорость реакции при температуре 30 °С.
Ответ: 18,3 моль/(л мин).
4.29.Рассчитать энергию активации реакции, если константы скорости при 25 и 50 °С соответственно равны 0,4 и 22.
Ответ: 128,3 кДж/моль.
4.30.КакизменитсяскоростьреакцииCO + 3H2 = CH4 + H2O: а) если увеличить давление в 3 раза; б) уменьшить объем системы в 2 раза; в) увеличить концентрацию водорода в 4 раза?
Ответ: а) увеличитсяв81 раз; б) увеличитсяв16 раз; в) увеличится
в64 раза.
4 4 |
4 5 |
Раздел 5. ХИМИЧЕСКОЕ РАВНОВЕСИЕ
5.1. Обратимые реакции. Константа равновесия
Химические реакции, которые протекают только в одном направлении и завершаются полным превращением исходных веществ в конечные, называютсянеобратимыми. Реакцийэтоготипаоченьмало, большинство реакций являются обратимыми. В обратимых реакциях образовавшиеся вещества взаимодействуютмеждусобой, превращаясь висходные, т. е. такие реакции могутпротекать как в прямом, так и вобратном направлении. В уравнениях обратимых реакций вместо знака = используется знак λ.
Рассмотрим гомогенную обратимую реакцию
A B λ C D. |
(5.1) |
Реакция, направленнаяслева направо, называетсяпрямой, апротивоположная – обратной. Согласно закону действия масс скорость прямой реакции определяется выражением
vпр |
kпр CA CB, |
(5.2) |
а скорость обратной реакции – выражением |
|
|
vобр |
kобр CC CD. |
(5.3) |
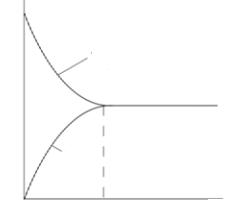
В начальный момент времени Ω скорость прямой реакции максимальна, со временем она уменьшается, так как расходуются исходные вещества Аи В. Напротив, скорость обратной реакции со временем возрастает, так какнакапливаютсявеществаСиD (рис. 3). Черезнекоторое время Ωравн скоростипрямойи обратной реакциибудутравны другдругу.
vпр vобр. |
(5.4) |
Такое состояние называется динамическим химическим равновесием. В состоянии химического равновесия прямая и обратная реакции не прекращаются, однако химический состав системы сохраняется постоянным. Например, за некоторыйпромежуток временив системе (5.1) по прямой реакции образуется х моль вещества С. За этот же промежуток времени в обратной реакции расходуется также х моль вещества С, аналогично и для веществ А, В и D данной системы. Следовательно, всостоянииравновесияконцентрациякаждоговеществаостаетсявовремени постоянной и называется равновесной. Равновесные концентрацииобозначаютсяформуламивеществ, заключеннымивквадратныескобки, например, [A], [B], [C], [D], тогда как неравновесные концентрации обозначают CA, CB, CC, CD.
v
vпр
vпр = vобр
vобр
τравн τ
Рис. 3. Состояние химического равновесия
Подставив в уравнение (5.4) выражения для скорости прямой (5.2) и обратной (5.3) реакций с учетом равновесных концентраций, получим
kпр [A][B] kобр [C][D], |
(5.5) |
откуда
kпр |
[C][D] |
|
||
|
|
|
. |
(5.6) |
kобр |
[A][B] |
|||
4 6 |
4 7 |

Отношение констант скоростей kпр/kобр при данной температуре также является постоянной величиной, называемой константой равновесия Кр.
Kр |
kпр |
. |
(5.7) |
|
kобр |
||||
|
|
|
Тогда окончательно получаем
Kр |
[C][D] |
. |
(5.8) |
|
|||
|
[A][B] |
|
|
Чем больше значение константы равновесия, тем «глубже» протекает прямая реакция до момента установления в системе химического равновесия.
Для реакции общего вида
aA + bB λ cC + dD |
(5.9) |
выражение константы равновесия имеет вид
Kр |
[C]c[D]d |
. |
(5.10) |
|
|||
|
a b |
|
|
|
[A] [B] |
|
|
В случае гетерогенной реакции концентрации твердых веществ в выражение Кр не входят, так как они, как правило, остаются постоянными.
Пример 1. Написать выражение константы равновесия для следующих реакций: а) 2SO2 + O2 λ2SO3; б) 3Fe + 4H2O(г) λ Fe3O4 +
+ 4H2.
Решение. Вещества SO2, O2 и SO3 – газы, следовательно, реакция
2SO2 + O2 λ 2SO3 – гомогенная:
Kр |
[SO3 ]2 |
|
. |
||
[SO2 |
]2[O2 |
] |
|||
|
|
||||
Реакция 3Fe + 4H2O(г) λ Fe3O4 + 4H2 является гетерогенной, концентрации твердых веществ Fe и Fe3O4 в выражение константы равновесия не входят:
K[H2 ]4
р[H2O]4 .
Пример 2. В гомогенной системе 4HCl(г) + O2 λ 2H2O(г) + 2Cl2 равновесие установилось при концентрации Cl2, равной 0,14 моль/л. Исходные концентрации HCl и O2 составляли соответственно 0,48 и 0,39 моль/л. Вычислить константу равновесия.
Решение. Изуравненияреакциивидно, чтонаобразование0,14 моль
Cl2 расходуется 2 0,14 = 0,28 моль HCl и 0,5 0,14 = 0,07 моль O2.
Следовательно, к моментуравновесия осталось(0,48 – 0,28) = 0,20 моль HCl и (0,39 – 0,07) = 0,32 моль O2. Равновеснаяконцентрация H2O равна равновесной концентрации Cl2. Эти расчеты удобно представить в виде таблицы:
Концентрация |
|
4HCl(г) |
O2 λ |
2H2O(г) |
2Cl2 |
|||
Исходные концентра- |
|
0,48 |
|
|
0,39 |
|
0 |
0 |
ции, моль/л |
|
|
|
|
|
|
|
|
Прореагировало |
|
2 0,14 |
|
|
0,5 0,14 |
|
– |
– |
Осталоськ наступле- |
|
0,48 0,28 |
|
0,39 0,07 |
|
0,14 |
0,14 |
|
нию равновесия (рав- |
|
|
|
|
|
|
|
|
новесныеконцентра- |
|
|
|
|
|
|
|
|
ции) |
|
|
|
|
|
|
|
|
Рассчитаем константу равновесия: |
|
|
||||||
[H2O]2[Cl2 ]2 |
0,142 0.142 |
|
|
|
||||
Kр |
|
|
|
|
|
|
0,75. |
|
[HCl]4[O2 ] |
0,204 0,32 |
|
|
|||||
|
|
|
|
|||||
Пример 3. Константа равновесия гомогенной системы H2 + + I2λ 2HI при некоторой температуре равна 36. Определить, какой процент водорода и йода перейдет в HI, если исходные концентрации этих веществ одинаковы и составляют 0,01 моль/л.
Решение. Пусть к моменту равновесия прореагировало х моль H2. Выразим равновесные концентрации веществ через исходные в виде таблицы:
Концентрации |
H2 |
I2 λ |
2HI |
Исходные концентра- |
0,01 |
0,01 |
0 |
ции, моль/л |
|
|
|
Прореагировало |
х |
х |
– |
Осталось к наступлению |
0,01 х |
0,01 х |
2х |
равновесия (равновес- |
|
|
|
ные концентрации) |
|
|
|
4 8 |
4 9 |
Подставим значения равновесных концентраций в выражение константы равновесия:
Kр |
[HI]2 |
|
|
(2x)2 |
36. |
||
[H2 |
][I2 |
] |
(0,01 x) (0,01 x) |
||||
|
|
||||||
Извлекая из обеих частей уравнения корень, получим
2х/(0,01–х) = 6, откуда х = 0,0075.
Таким образом, из 0,01 моль водорода и 0,01 моль йода прореагировало по 0,0075 моль, что составляет 75 %.
Значение константы равновесия зависит только от природы участвующих в реакции веществ и температуры. Если в системе присутствуеткатализатор, то он вравнойстепени изменяетскоростиипрямой, и обратной реакции, ускоряет достижение химического равновесия, но не изменяет значения Кр.
Существует связь между константой равновесия и энергией Гиббса. Чем более отрицательно значение G°, тем сильнее сдвинуто равновесие всторонупродуктов реакции, т. е. тембольше константа равновесия. При температуре Т связь между Кр и G выражается уравнением
G RT lnKp. |
(5.11) |
5.2. Смещение химического равновесия. Принцип Ле Шателье
На состояние химического равновесия оказывают влияние концентрация, температура, а для газообразных веществ– давление. При изменении условий протекания реакции скорости прямой и обратной реакции изменяются неодинаково, химическое равновесие нарушается. В результате преимущественного протекания одной из реакций установится новое равновесие при новых значениях равновесных концентраций веществ. Подобный переход системы из одного состояния равновесия в другое называется смещением или сдвигом химического равновесия. Направление этого смещения определяется принципом Ле Шателье: если на систему, находящуюся в состоянии равновесия, оказать ка- кое-либо внешнее воздействие (изменить температуру, давление, концентрации веществ), то равновесие сместится в таком направлении, что оказанное воздействие будет ослаблено (преимущественно протекать будеттаизпротивоположныхреакций, котораяуменьшаетвоздействие).
Например, если увеличить концентрацию исходных веществ, то протекатьбудетпреимущественнопрямаяреакция, равновесиесместится «вправо» – в сторону образования продуктов реакции. Повышение температурысмещаетравновесиевсторонуэндотермическойреакции, протекание которой сопровождается охлаждением системы. Повышение давления смещает равновесие в сторону уменьшения общего числа молей газообразных веществ, что приводит к понижению давления.
Пример 4. Как надо изменить концентрации, температуру, давление, чтобы сместить равновесие вправо в следующих реакциях:
а) N2 3H2 λ 2NH3, H 92,4 кДж; б) N2 O2 λ 2NO, H 180,6 кДж.
Решение: 1. Так как H < 0, прямая реакция идет с выделением тепла, обратная – с поглощением. Для смещения равновесия в сторону прямой реакции необходимо понизить температуру. Протекание реакции в прямом направлении сопровождается уменьшением давления (из 4 молекул газов образуется 2), поэтому для смещения равновесия вправо следует увеличить давление. Увеличение концентраций исходных веществN2 иH2 иуменьшениеконцентрацииNH3 такжеспособствуетпротеканию прямой реакции.
2. Для смещения равновесия вправо реакции N2 + O2 λ 2NO необходимо повыситьтемпературу, увеличитьконцентрацию N2 и O2, уменьшить концентрацию NO. Изменение давление не вызовет смещения равновесия, так как число моль газов до реакции и после реакции одинаково.
ЗАДАЧИ
5.1. Написать выражение константы равновесия для следующих
систем: |
|
а) CO H2O(г) λ CO2 H2 |
б) 3Fe 4H2O(г) λ Fe3O4 4H2 |
в) 2NO2 λ 2NO O2 |
г) H2 I2 λ 2HI |
5.2. При некоторой температуре равновесие в гомогенной |
|
системе CO H2O(г) λ CO2 |
H2 установилось при следующих |
концентрациях веществ (моль/л): [CO] = 0,02; [H2O] = 0,08; [H2] = 0,01.
Вычислить константу равновесия и исходные концентрации CO и H2O.
Ответ: 0,0625; 0,03 моль/л; 0,09 моль/л.
5.3. Написать выражение константы равновесия для следующих систем:
5 0 |
5 1 |
а) 2NO Cl2 l 2NOCl, 'H 73,6 кДж; б) 3O2 l 2O3, 'H 184,6 кДж.
В каком направлении будет смещаться равновесие: а) при увеличении температуры; б) уменьшении давления?
5.4.При некоторой температуре в системе СО2 + 4Н2 l СН4 +
+2Н2О(г), 'H 165 кДжустановилосьравновесие. Написатьвыражение Кр. Какследуетизменитьтемпературу, давление, концентрациивеществ, чтобы увеличить выход метана?
5.5.Как следует изменить давление, чтобы сместить равновесие в сторону образования продуктов в следующих реакциях:
а) 2СО + О2 l 2СО2 |
б) MgCO3 l MgO + CO2 |
в) 2СО + 2Н2 l СН4 |
+ CO2 |
рдля каждой реакции.
5.6.Исходные концентрации NO и Cl2 были равны и составляли 1 моль/л. Равновесиевсистеме2NO Cl2 l2NOCl установилось, когда прореагировало 10 % NO. Вычислить константу равновесия.
Ответ: 1,3 10 2.
5.7.Написать выражение константы равновесия для следующих систем:Написать выражение К
а) 2SО2 + О2 l 2SО3 |
б) СО + 3Н2 l СН4 + Н2O(г) |
3+ 5O2 l 4NO + 6Н2O(г) г) WO3 + 3Н2 lW + 3Н2O(г)
5.8.При некоторой температуре в системе CaCO3 l CaO CO2, 'H 179 кДж установилось равновесие. Как следует изменить температуру, давление, концентрацию СO2, чтобы сместить равновесие
всторону образования оксида кальция?
5.9.Какследуетизменитьтемпературу, чтобысместитьравновесие вправо в следующих системах:в) 4NH
а) 2НBr l Н2 + Br2, 'H = +72,5 кДж; б) Н2 + S l Н2S, 'H = –169,4 кДж;
в) FeO + CO l Fe + CO2, 'H = –18,2 кДж Написать выражение Кр для каждой реакции.
5.10. Константа равновесия системы H2 + I2 l 2HI при некоторой температуре равна 0,64. Вычислить равновесные концентрации всех веществ, если исходные концентрации H2 и I2 были равны и составляли 1 моль/л.
Ответ: [HI] = 0,572 моль/л; [H2] = [I2] = 0,714 моль/л.
5.11. Написать выражение константы равновесия для следующих систем:
а) COCl2 l CO + Cl2, 'H = +112,5 кДж;
б) 2CO + O2 l CO2, 'H = –566 кДж.
В каком направлении будет смещаться равновесие: а) при уменьшении температуры; б) увеличении давления?
5.12.Вобратимойреакции: A(тв) + 3B(г) l2C(г), 'H < 0 установилось химическое равновесие. Написать выражение Kр и определить, куда сместитсяравновесие: а) еслиуменьшитьконцентрациюC; б) увеличить концентрацию В; в) увеличить температуру; г) увеличить давление.
5.13.Вычислить, сколько процентов N2O4 разлагается по реакции N2O4 l 2NO2, если константа равновесия равна 2,5 10–2, а исходная концентрация N2O4 составляет 1 моль/л.
Ответ: 7,6 %.
5.14.Написать выражение константы равновесия для следующих
систем:
а) N2 + O2 l 2NO б) Fe2O3 + 3H2 l 2Fe + 3H2O(г)
в) C + CO2 l 2CO г) 4HCl + O2 l 2Cl2 + 2H2O(г)
5.15. Определить концентрации всех веществ в состоянии равновесиясистемыCO + H2O lCO2 + H2, еслиисходныеконцентрации СО и Н2 составляли соответственно 0,16 и 0,22 моль/л, а константа равновесия равна 1.
Ответ: [СО] = 0,067 моль/л; [H2О] = 0,127 моль/л; [СО2] = [Н2] = = 0,093 моль/л.
5.16. Написать выражение константы равновесия для следующих гомогенных систем:
а) 2H2O l 2H2 + O2, 'H = +483,7 кДж; б) 2SО2 + О2 l 2SО3, 'H = –196,6 кДж.
В каком направлении будет смещаться равновесие: а) при увеличении температуры; б) увеличении давления?
5.17.При некоторой температуре в гомогенной газовой системе
PCl5 lPCl3 + Cl2,'H = +92,59 кДжустановилосьравновесие. Какследует изменитьтемпературу, давление, концентрациивеществ, чтобысместить равновесие в сторону прямой реакции?
5.18.В состоянии равновесия системы 3H2 + N2 l 2NH3 концентрации веществ составляют (моль/л): [NH3] = 1; [N2] = 0,5; [H2] = 3,5. Вычислить константу равновесия и исходные концентрации азота
иводорода.
Ответ: 4,7 10–2; 1 моль/л; 5 моль/л).
5 2 |
5 3 |
5.19. Написать выражение константы равновесия для следующих гомогенных систем:
а) CO + H2O l H2 + CO2, 'H = –41,2 кДж;
б) СО + 2Н2О l СН3ОН, 'H = +193,3 кДж.
В каком направлении будет смещаться равновесие: а) при уменьшении температуры; б) уменьшении давления?
5.20. Обратимая гомогенная реакция протекает по уравнению 2A + B l 3C + D. Исходные концентрации веществ А и В составляли соответственно3 и2 моль/л. РавновеснаяконцентрацияСравна1,5 моль/л. Вычислить константу равновесия.
Ответ: 0,2875.
5.21. СколькомольHI образуетсявсистемеH2 + I2 l2HI из2 моль I2 и 2 моль H2, если константа равновесия системы равна 4?
Ответ: 2 моль.
5.22. Какследуетизменитьтемпературу, чтобысместитьравновесие влево в следующих системах:
а) C + CO2 l 2CO2, 'H = +172,5 кДж;
б) 2C + 3H2 l C2H6, 'H = –85,6 кДж;
в) CO + H2O(г) l CO2 + H2, 'H = –41,2 кДж.
Написать выражение Кр для каждой реакции.
5.23. При некоторой температуре в системе 2SО2 + О2 – 2SО3, 'H = –196,6 кДжустановилосьравновесие. НаписатьвыражениеКр. Как следует изменить температуру, давление, концентрации веществ, чтобы увеличить выход SО3?
5.24. При некоторой температуре из 1 моль SO3, находящегося взакрытомсосудеемкостью5 л, разлагается0,5 моль: 2SО3 l2SО2 + О2. Вычислить константу равновесия.
Ответ: 5 10–2.
5.25. В гомогенной газовой реакции 3A + 2B l 2C + D, 'H > 0 установилось химическое равновесие. Написать выражение Кр и определить, куда сместится равновесие: а) если увеличить концентрацию А; б) уменьшитьконцентрациюВ; в) увеличитьтемпературу; г) уменьшить давление.
5.26. ИсходныеконцентрацииSO2 иO2 всистеме2SО2 + О2 l2SО3 составляли 5 и 2 моль/л соответственно. К моменту наступления равновесия прореагировало 50 % SO2. Рассчитать равновесную концентрацию SO3 и константу равновесия.
Ответ: 2,5 моль/л; 1,33.
5.27. Как следует изменить давление, чтобы сместить равновесие влево следующих обратимых процессов:
а) CH4 + H2O(г) l CO + 3H2 б) 2NH3 l N2 + 3H2 в) CO2 + C l 2CO
Написать выражение Кр для каждой реакции.
5.28. При некоторой температуре в гомогенной газовой системе 2NO + O2 l2NO2, 'H = –113 кДжустановилосьравновесие. Какследует изменитьтемпературу, давление, концентрациивеществ, чтобыувеличить
выход5.29.NO2Вычислить? константу равновесия и исходные концентрации веществ в системе CO + Cl2 l COCl2, если равновесие установилось при следующих концентрациях веществ (моль/л): [CO] = 0,25; [Cl2] = 0,3; [COCl2] = 0,1.
Ответ: 1,33; 0,35 моль/л; 0,4 моль/л.
5.30.Рассчитать равновесную концентрацию оксида углерода (II)
вреакции COCl2 l CO + Cl2, если исходная концентрация COCl2 равна 0,04 моль/л, а константа равновесия равна 0,01.
Ответ: 0,0156 моль/л.
5 4 |
5 5 |
Раздел 6. ОБЩИЕ СВОЙСТВА РАСТВОРОВ. СПОСОБЫ ВЫРАЖЕНИЯ КОНЦЕНТРАЦИЙ РАСТВОРОВ.
РАСТВОРИМОСТЬ
Растворы – гомогенные (однородные) системы, состоящие из растворителя, растворенного вещества и продуктов взаимодействия между ними.
Растворителем называют вещество, которое в чистом виде находится в том же агрегатном состоянии, что и раствор. В случае одинакового агрегатного состояния веществ, образующих раствор, растворителем называют вещество с наибольшим относительным содержанием. Растворы бывают газообразными, жидкими и твердыми. Например, атмосферный воздух можно рассматривать как газообразный раствор, в котором основной компонент – азот является растворителем, а кислород и остальные компоненты – растворенные вещества. Природная и сточная вода – это жидкие растворы минеральных и органических веществ в воде. Жидкие растворы образуют расплавы металлов. Кристаллизация жидких расплавов может сопровождаться образованием твердых растворов.
От механических смесей растворы отличаются взаимодействием между растворителем и растворенными веществами, в результате которого выделяется или поглощается тепловая энергия.
Процесс взаимодействия растворителяс растворяемым веществом называется сольватацией (от латинского solvere – растворять) или гидратацией, если растворителем является вода. Продукты этого взаимодействия носят название сольватов или гидратов.
Различие между процессом растворения и процессом образования новых химических соединений состоит в том, что состав раствора может меняться в широких пределах и компоненты раствора обнаруживают многие индивидуальные свойства.
Свойства растворов зависят от природы растворителя (вода, ацетон, керосин и др.), природы растворенного вещества (кислота, основание, соль, неэлектролит, газ) и концентрации раствора.
6.1. Способы выражения концентраций растворов
Концентрация – количественная характеристика относительного содержания растворенного вещества и растворителя в растворе.
В химической практике используют пять основных способов выражения концентрации растворов: массовая доля (w), молярная концентрация (СМ), эквивалентная (нормальная) концентрация (Сн), моляльная концентрация (Сm), мольная доля (Ni).
Для представления расчетных формул и выполнения расчетов введем следующие обозначения:
m1, m2, m – соответственно массы растворенного вещества, растворителя и раствора (выраженные в граммах), г;
M1, M2 – соответственно молярные массы растворенного вещества и растворителя, г/моль;
mэ(1) – молярная масса эквивалента (эквивалентная масса) растворенного вещества, г/моль;
Э1 – относительный эквивалент растворенного вещества, безразмерная величина, равная отношению mэ(1) к M1;
Θ1, Θ2 – соответственно количество растворенного вещества и растворителя, моль;
nэ(1) – количество эквивалентов растворенного вещества, моль; V – объем раствора, л (дм3);
Υ – плотность раствора, г/см3 (г/мл).
6.1.1. Массовая доля ( ) или процентная концентрация (С)
Массоваядоляпоказывает, какуючастьмассарастворенноговещества составляет от массы раствора; выражается обычно в % мас.:
C |
m1 |
100 |
m1 |
100 |
(6.1) |
m |
|
||||
|
|
m1 m2 |
|
||
Если принять массу раствора m = 100 г, то процентная концентрация численно равна количеству граммов растворенного вещества, которые содержатся в 100 г раствора. Например, в 100 г раствора с концентрацией5 % мас. содержится5 г растворенного вещества, в 100 г раствора с концентрацией 18 % мас. – 18 г растворенного вещества и т. д.
5 6 |
5 7 |

Пример 1. Определить массовую долю (%) хлорида калия в растворе, содержащем 53 г KCl в 0,5 л раствора, плотность которого
1,063 г/см3.
Решение. Определим массу раствора:
m = VΥ= 0,5 103 см3 1,063 г/см3 = 531,5 г.
По уравнению (6.1) определим массовую долю, %, KCl в растворе:
Cm1 100 53 г 100 % 9,97 % . m 531,5 г
6.1.2.Молярная концентрация раствора (СМ)
Молярнаяконцентрация(молярность), моль/л, показывает, сколько молей растворенного вещества содержится в одном литре раствора:
|
v1 |
|
m1 |
|
m1 |
Υ |
. |
(6.2) |
CМ V |
|
М V |
|
М m |
|
|||
|
|
1 |
1 |
|
|
|
||
Для молярной концентрации обычно используют обозначение М. Например, растворсконцентрацией5 моль/лобозначаюткак5 Мраствор.
Пример 2. Определить молярную концентрацию раствора NaOH, в 0,2 л которого содержится 1,6 г растворенного вещества.
Решение. Определим молярную массу растворенного вещества:
М1 = (23 + 1 + 16) г/моль = 40 г/моль.
Определим количество вещества в заданном объеме:
ν1 |
m1 |
|
1,6 г |
0,04 моль. |
M1 |
|
40 г/моль |
||
|
|
|
Определим молярную концентрацию по уравнению (6.2):
CМ |
ν1 |
|
0,04 моль |
0,2 моль/л. |
V |
|
0,2 л |
6.1.3. Эквивалентная (нормальная) концентрация (Сн)
Эквивалентнаяконцентрация(нормальность, илимолярнаяконцентрация эквивалента) определяет количество эквивалентов растворенного вещества, содержащихся в одном литре раствора, моль/л:
Сн |
nэ 1 m1 |
m1 |
|
m1 |
Υ |
. |
(6.3) |
|||||
|
|
|
|
|
|
|
|
|
||||
V mэ 1 V M1 |
Э1 V M1 Э1 m |
|||||||||||
|
|
|
||||||||||
Изуравнений(6.2) и(6.3) следует, чтоэквивалентнуюконцентрацию раствора (Сн) можно определить, если известна его молярная концентрация (СМ):
Сн |
СМ |
или |
С |
|
С Э . |
(6.4) |
Э1 |
|
|||||
|
|
|
М |
н 1 |
|
|
|
|
|
|
|
Длянормальной(эквивалентной) концентрацииобычноиспользуют обозначение н. Например, раствор с нормальной концентрацией 3 моль/л обозначают как 3 н. раствор.
Пример 3. Определить эквивалентную концентрацию раствора хлорида железа (III), если в 0,3 л раствора содержится 32,44 г FeCl3.
Решение. Относительный эквивалент FeCl3 – Э1 = 1/3. Определим эквивалентную массу хлорида железа (III):
m 1 |
Э |
М |
1 |
1 |
|
56 3 35,5 г/моль 54,1г/моль. |
|
|
|
|
|||||
э |
1 |
|
3 |
|
|||
|
|
|
|
|
|||
Определим количество эквивалентов FeCl3 в заданном объеме:
nэ 1 |
m |
|
32,44 г |
0,6 моль. |
|
mэ 1 |
54,1г/моль |
||||
|
|
||||
Определим эквивалентную концентрацию по уравнению (6.3):
Сн |
nэ 1 |
0,6 моль |
2 моль/л. |
||
V |
|
0,3 л |
|||
|
|
||||
6.1.4. Моляльная концентрация раствора (Сm)
Моляльная концентрация раствора (моляльность) определяет количество растворенного вещества (в молях), содержащихся в 1 кг растворителя (моль/кг растворителя):
Сm |
ν1 |
1000 |
m1 |
1000 |
m1 |
|
1000 |
. (6.5) |
|
|
M1 m m1 |
|
|||||
|
m2 |
M1 m2 |
|
|
||||
Пример 4. Определить объем воды, в котором растворили 4,57 г сахарозы С12H22O11, если моляльная концентрация полученного раствора 0,134 моль/кг. (Плотность воды принять равной 1 г/см3.)
5 8 |
5 9 |
