
Lektsii
.docЛекция № 1. Химический состав организма человека. Обмен веществ и энергии.
План
1. Введение.
2. Элементарный состав организмов.
3. Понятие метаболизма (катаболизм и анаболизм). Виды обмена веществ.
4. Особенности энергетического обмена. Макроэргические вещества. Универсальная роль АТФ в организме.
Биологическая химия – наука о качественном составе, количественном содержании и преобразованиях в жизненных процессах соединений, образующих живую материю. В зависимости от подхода к изучению живой материи биохимию делят на три крупных раздела: статическая биохимия, динамическая биохимия, функциональная биохимия. Статическая биохимия занимается исследованием химического состава организмов. При этом в понятие химического состава включаются как качественный состав (и строение) соединений, так и количественное их содержание в тех или иных биологических объектах. Динамическая биохимия занимается изучением превращений химических соединений и взаимосвязанных с ними превращений энергии в процессе жизнедеятельности органических форм. Функциональная биохимия выясняет связи между строением химических соединений и процессами их видоизменения, с одной стороны, и функцией тканей и органов, включающих в свой состав упомянутые вещества, - с другой.
В организмах, составляющих биомассу Земли, обнаружено свыше 60 элементов. По количественному содержанию в живом веществе элементы делят на три категории: Макроэлементы, концентрация которых превышает 0,001% (кислород, углерод, водород, кальций, калий, азот, фосфор, сера, магний, натрий, хлор и железо), микроэлементы, доля которых составляет от 0,001% до 0,000001% (марганец, цинк, медь, бор, молибден, кобальт и многие другие), и ультраэлементы , содержание которых не превышает 0,000001% (ртуть, золото, уран, радий и др.).Из макроэлементов в наибольшем количестве содержатся в биомассе кислород, углерод, водород, азот и кальций. Из них только кислород и кальций широко распространены в земной коре. Так, например, подмечено, что те элементы, которые легко образуют растворимые и газообразные соединения, составляют основную массу биосферы (C,N,P,S), хотя в земной коре их содержание относительно невелико. Отмечена определенная зависимость между биологической ролью элементов и их местом в периодической системе Д.И. Менделеева. Органический мир построен главным образом из легких элементов. Полагают, что H,O,C,N и P, составляющие вместе более 99 % живого вещества, играют столь выдающуюся роль в явлениях жизни благодаря наличию у перечисленных элементов комплекса особых качеств. Первое из них состоит в способности образовывать кратные связи. Второе качество заключается в том, что атомы упомянутых элементов, отличаясь малыми размерами, образуют относительно плотные молекулы с минимальными межатомными расстояниями. Такие молекулы более устойчивы к действию тех или иных химических реагентов. Третье качество присуще в основном P и S и лишь в небольшой мере N. Оно сводится к возникновению на базе указанных элементов некоторых специфических соединений, при расщеплении которых выделяется повышенное количество энергии, используемой для процессов жизнедеятельности.
Огромную роль в создании условий для жизнедеятельности играет вода. Она составляет примерно 75 % биомассы и образует ту среду, в которой протекают физико – химические процессы, обеспечивающие постоянное возобновление живого вещества, а также участвует в реакциях гидролиза. Вторым по количественному содержанию в биологических объектах, но, несомненно первым и главным по значению классом соединений являются белки. В сухом веществе организмов в среднем содержится 40 – 50 % белка. Остальные 50 % сухого вещества организмов составлены соединениями других классов. Это углеводы, липиды и минеральные вещества, содержание которых в организмах сильно варьирует, причем в растительном мире преобладают углеводы, а животном – липиды. Минеральные вещества составляют в среднем около 10 % от сухого вещества биомассы. Кроме белков, нуклеиновых кислот, углеводов, липидов и минеральных веществ, в составе организмов найдены в незначительных количествах углеводороды, спирты, альдегиды карбоновые кислоты и их производные, аминокислоты, эфиры, амины и разнообразные другие соединения. Многие соединения этой группы обладают мощным физиологическим действием и выполняют роль ускорителей или замедлителей жизненных процессов. Их иногда объединяют под названием биологически активных соединений, хотя химически они очень разнообразны. Это – витамины, гормоны, ростовые вещества, биостимуляторы, коэнзимы, антибиотики, фитонциды и др. сюда же относятся вещества, возникающие в качестве промежуточных продуктов при тех или иных химических реакциях в организме. Эти соединения называют метаболитами. Также выделяют пластические и энергетические вещества. Пластические вещества служат строительным материалом при формировании внутриклеточных структур, клеток, тканей. Это главным образом белки, нуклеиновые кислоты, некоторые виды липидов и высокомолекулярных углеводов. Энергетические вещества выполняют роль поставщиков энергии для процессов жизнедеятельности, распадаясь при этом до углекислого газа и воды. К ним относятся низкомолекулярные и некоторые высокомолекулярные (гликоген, крахмал) углеводы и отдельные группы липидов (в основном жиры).
Обмен веществ и энергии составляет сущность жизнедеятельности любого организма. Биологическая форма движения материи характеризуется существованием саморегулирующихся и самовоспроизводящихся систем, обменивающихся с окружающей средой веществом и энергией. Та часть общего обмена веществ, которая выражается в поглощении, накоплении усвоении организмом веществ окружающей среды и создании, синтезе за их счет структурных единиц своего тела, называется анаболизмом или ассимиляцией. Та часть общего обмена веществ, которая состоит в разрушении веществ, составляющих организм, в распаде элементов живого тела и выведении продуктов этого распада из организма, называется катаболизмом, или диссимиляцией. Обмен веществ осуществляется при условии и в результате постоянного взаимодействия живой и неживой материи, организма и среды. Обмен веществ невозможен без сопутствующего ему обмена энергии. Каждое органическое соединение, входящее в состав живой материи, обладает определенным запасом потенциальной энергии, за счет которой может быть совершена работа. Эту энергию принято называть свободной энергией. Главными материальными носителями свободной энергии в органических веществах являются химические связи между атомами. Свободная энергия, которая выделяется при распаде макроэргических соединений и за счет которой может быть совершена та или иная работа, используется не только для химического синтеза. Она может служить в организме для теплообразования, свечения, накопления электричества и др. При этом химическая энергия преобразуется в тепловую, лучистую, механическую и др. И все эти процессы происходят при обязательном участии АТФ.
Аденозинтрифосфорная кислота (АТФ) — универсальный источник и основной аккумулятор энергии в живых клетках. АТФ содержится во всех клетках растений и животных. Количество АТФ в среднем составляет 0,04% (от сырой массы клетки), наибольшее количество АТФ (0,2–0,5%) содержится в скелетных мышцах. АТФ состоит из остатков: 1) азотистого основания (аденина), 2) моносахарида (рибозы), 3) трех фосфорных кислот. Поскольку АТФ содержит не один, а три остатка фосфорной кислоты, она относится к рибонуклеозидтрифосфатам.
Для большинства видов работ, происходящих в клетках, используется энергия гидролиза АТФ. При этом при отщеплении концевого остатка фосфорной кислоты АТФ переходит в АДФ (аденозиндифосфорную кислоту), при отщеплении второго остатка фосфорной кислоты — в АМФ (аденозинмонофосфорную кислоту). Выход свободной энергии при отщеплении как концевого, так и второго остатков фосфорной кислоты составляет по 30,6 кДж. Отщепление третьей фосфатной группы сопровождается выделением только 13,8 кДж. Связи между концевым и вторым, вторым и первым остатками фосфорной кислоты называются макроэргическими (высокоэнергетическими). Запасы АТФ постоянно пополняются. В клетках всех организмов синтез АТФ происходит в процессе фосфорилирования, т.е. присоединения фосфорной кислоты к АДФ. Фосфорилирование происходит с разной интенсивностью при дыхании (митохондрии), гликолизе (цитоплазма), фотосинтезе (хлоропласты).
АТФ является основным связующим звеном между процессами, сопровождающимися выделением и накоплением энергии, и процессами, протекающими с затратами энергии. Кроме этого, АТФ наряду с другими рибонуклеозидтрифосфатами (ГТФ, ЦТФ, УТФ) является субстратом для синтеза РНК.
Лекция № 2. Белки.
План
-
Аминокислотный состав белков.
-
Пептидная связь.
-
Пространственная организация белковых молекул.
-
Свойства и функции белков.
1. Белки — высокомолекулярные органические соединения, состоящие из остатков α-аминокислот.
В состав белков входят углерод, водород, азот, кислород, сера. Часть белков образует комплексы с другими молекулами, содержащими фосфор, железо, цинк и медь.
Белки обладают большой молекулярной массой: яичный альбумин — 36 000, гемоглобин — 152 000, миозин — 500 000. Для сравнения: молекулярная масса спирта — 46, уксусной кислоты — 60, бензола — 78.
Белки — непериодические полимеры, мономерами которых являются α-аминокислоты. Обычно в качестве мономеров белков называют 20 видов α-аминокислот, хотя в клетках и тканях их обнаружено свыше 170.
В зависимости от того, могут ли аминокислоты синтезироваться в организме человека и других животных, различают: заменимые аминокислоты — могут синтезироваться; незаменимые аминокислоты — не могут синтезироваться. Незаменимые аминокислоты должны поступать в организм вместе с пищей. Растения синтезируют все виды аминокислот.
В зависимости от аминокислотного состава, белки бывают: полноценными — содержат весь набор аминокислот; неполноценными — какие-то аминокислоты в их составе отсутствуют. Если белки состоят только из аминокислот, их называют простыми. Если белки содержат помимо аминокислот еще и неаминокислотный компонент (простетическую группу), их называют сложными. Простетическая группа может быть представлена металлами (металлопротеины), углеводами (гликопротеины), липидами (липопротеины), нуклеиновыми кислотами (нуклеопротеины).
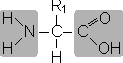
Все аминокислоты содержат: 1) карбоксильную группу (–СООН), 2) аминогруппу (–NH2), 3) радикал или R-группу (остальная часть молекулы). Строение радикала у разных видов аминокислот — различное. В зависимости от количества аминогрупп и карбоксильных групп, входящих в состав аминокислот, различают: нейтральные аминокислоты, имеющие одну карбоксильную группу и одну аминогруппу; основные аминокислоты, имеющие более одной аминогруппы; кислые аминокислоты, имеющие более одной карбоксильной группы.
Аминокислоты являются амфотерными соединениями, так как в растворе они могут выступать как в роли кислот, так и оснований. В водных растворах аминокислоты существуют в разных ионных формах.
2. Строение белковой молекулы объясняет полипептидная теория, согласно которой белки представляют собой гигантские полипептиды, построенные из большого числа аминокислотных остатков (лизоцим – 129, миоглобин кашалота – из 155, трипсиноген – из 234 и т.д.). О том, что белки построены именно таким образом, говоря следующие факты: 1. В нативных белках удается обнаружить небольшие количества свободных –NH2 и – COOH групп. 2. При гидролизе высвобождение свободных групп, разрыв – NH –CO идет в соотношении 1:1 и появляются свободные аминокислоты. 3. Полипептидная теория доказана синтезом белка инсулина в лаборатории.
H2N – CH – COOH H2N – CH – COOH
׀ ׀
CH3 — CH — CH3 CH2
׀
CH3 — CH — CH3
Валин Лейцин
H2N – CH – COOH
׀
CH2
׀
COOH
Аспарагиновая кислота
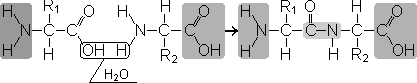
Образование пептидов происходит в результате реакции конденсации аминокислот. При взаимодействии аминогруппы одной аминокислоты с карбоксильной группой другой между ними возникает ковалентная азот-углеродная связь, которую и называют пептидной. В зависимости от количества аминокислотных остатков, входящих в состав пептида, различают дипептиды, трипептиды, тетрапептиды и т.д. Образование пептидной связи может повторяться многократно. Это приводит к образованию полипептидов. На одном конце пептида находится свободная аминогруппа (его называют N-концом), а на другом — свободная карбоксильная группа (его называют С-концом).
3. Пространственная организация белковых молекул. Выполнение белками определенных специфических функций зависит от пространственной конфигурации их молекул, кроме того, клетке энергетически невыгодно держать белки в развернутой форме, в виде цепочки, поэтому полипептидные цепи подвергаются укладке, приобретая определенную трехмерную структуру, или конформацию. Выделяют 4 уровня пространственной организации белков.
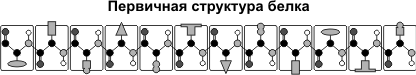
Первичная структура белка — последовательность расположения аминокислотных остатков в полипептидной цепи, составляющей молекулу белка. Связь между аминокислотами — пептидная.
Если молекула белка состоит всего из 10 аминокислотных остатков, то число теоретически возможных вариантов белковых молекул, отличающихся порядком чередования аминокислот, — 1020. Имея 20 аминокислот, можно составить из них еще большее количество разнообразных комбинаций. В организме человека обнаружено порядка десяти тысяч различных белков, которые отличаются как друг от друга, так и от белков других организмов.
Белки-полимеры состоят из полипептидов, а последние в свою очередь из аминокислот. Число аминокислот в молекуле низкомолекулярных белков составляет более ста, в крупных белковых молекулах может содержаться их несколько десятков тысяч. Порядок расположения аминокислот пока выяснен только у немногих белков, например: в ферменте рибонуклеазе, в белке вируса табачной мозаики. Всего в организмах имеется около 20 различных аминокислот. Но из них может возникать неисчислимо большое количество разнообразнейших белков. Поясним это на примере. В некоторых алфавитах имеется около 20 букв (в итальянском 21 буква). Но из этого количества букв составлены десятки тысяч разных слов, а из слов сложено неисчерпаемое множество рассказов, стихов, статей и пр. Отсюда понятна специфичность белков всех видов живых существ и даже разных их органов.
Именно первичная структура белковой молекулы определяет свойства молекул белка и ее пространственную конфигурацию. Замена всего лишь одной аминокислоты на другую в полипептидной цепочке приводит к изменению свойств и функций белка. Например, замена в β-субъединице гемоглобина шестой глутаминовой аминокислоты на валин приводит к тому, что молекула гемоглобина в целом не может выполнять свою основную функцию — транспорт кислорода; в таких случаях у человека развивается заболевание — серповидноклеточная анемия.
Вторичная структура — упорядоченное свертывание полипептидной цепи в спираль (имеет вид растянутой пружины). Витки спирали укрепляются водородными связями, возникающими между карбоксильными группами и аминогруппами. Практически все СО- и NН-группы принимают участие в образовании водородных связей. Они слабее пептидных, но, повторяясь многократно, придают данной конфигурации устойчивость и жесткость. На уровне вторичной структуры существуют белки: фиброин (шелк, паутина), кератин (волосы, ногти), коллаген (сухожилия).



Третичная структура — укладка полипептидных цепей в глобулы, возникающая в результате возникновения химических связей (водородных, ионных, дисульфидных) и установления гидрофобных взаимодействий между радикалами аминокислотных остатков. Основную роль в образовании третичной структуры играют гидрофильно-гидрофобные взаимодействия. В водных растворах гидрофобные радикалы стремятся спрятаться от воды, группируясь внутри глобулы, в то время как гидрофильные радикалы в результате гидратации (взаимодействия с диполями воды) стремятся оказаться на поверхности молекулы. У некоторых белков третичная структура стабилизируется дисульфидными ковалентными связями, возникающими между атомами серы двух остатков цистеина. На уровне третичной структуры существуют ферменты, антитела, некоторые гормоны.
Четвертичная структура характерна для сложных белков, молекулы которых образованы двумя и более глобулами. Субъединицы удерживаются в молекуле благодаря ионным, гидрофобным и электростатическим взаимодействиям. Иногда при образовании четвертичной структуры между субъединицами возникают дисульфидные связи. Наиболее изученным белком, имеющим четвертичную структуру, является гемоглобин. Он образован двумя α-субъединицами (141 аминокислотный остаток) и двумя β-субъединицами (146 аминокислотных остатков). С каждой субъединицей связана молекула гема, содержащая железо.
Если по каким-либо причинам пространственная конформация белков отклоняется от нормальной, белок не может выполнять свои функции. Например, причиной «коровьего бешенства» (губкообразной энцефалопатии) является аномальная конформация прионов — поверхностных белков нервных клеток.
4. Свойства и функции белков. Аминокислотный состав, структура белковой молекулы определяют его свойства. Белки сочетают в себе основные и кислотные свойства, определяемые радикалами аминокислот: чем больше кислых аминокислот в белке, тем ярче выражены его кислотные свойства. Способность отдавать и присоединять Н+ определяют буферные свойства белков; один из самых мощных буферов — гемоглобин в эритроцитах, поддерживающий рН крови на постоянном уровне. Есть белки растворимые (фибриноген), есть нерастворимые, выполняющие механические функции (фиброин, кератин, коллаген). Есть белки активные в химическом отношении (ферменты), есть химически неактивные, устойчивые к воздействию различных условий внешней среды и крайне неустойчивые.
Внешние факторы (нагревание, ультрафиолетовое излучение, тяжелые металлы и их соли, изменения рН, радиация, обезвоживание) могут вызывать нарушение структурной организации молекулы белка. Процесс утраты трехмерной конформации, присущей данной молекуле белка, называют денатурацией. Причиной денатурации является разрыв связей, стабилизирующих определенную структуру белка. Первоначально рвутся наиболее слабые связи, а при ужесточении условий и более сильные. Поэтому сначала утрачивается четвертичная, затем третичная и вторичная структуры. Изменение пространственной конфигурации приводит к изменению свойств белка и, как следствие, делает невозможным выполнение белком свойственных ему биологических функций. Если денатурация не сопровождается разрушением первичной структуры, то она может быть обратимой, в этом случае происходит самовосстановление свойственной белку конформации. Такой денатурации подвергаются, например, рецепторные белки мембраны. Процесс восстановления структуры белка после денатурации называется ренатурацией. Если восстановление пространственной конфигурации белка невозможно, то денатурация называется необратимой.
|
Функция |
Примеры и пояснения |
|
Строительная |
Белки участвуют в образовании клеточных и внеклеточных структур: входят в состав клеточных мембран (липопротеины, гликопротеины), волос (кератин), сухожилий (коллаген) и т.д. |
|
Транспортная |
Белок крови гемоглобин присоединяет кислород и транспортирует его от легких ко всем тканям и органам, а от них в легкие переносит углекислый газ; в состав клеточных мембран входят особые белки, которые обеспечивают активный и строго избирательный перенос некоторых веществ и ионов из клетки во внешнюю среду и обратно. |
|
Регуляторная |
Гормоны белковой природы принимают участие в регуляции процессов обмена веществ. Например, гормон инсулин регулирует уровень глюкозы в крови, способствует синтезу гликогена, увеличивает образование жиров из углеводов. |
|
Защитная |
В ответ на проникновение в организм чужеродных белков или микроорганизмов (антигенов) образуются особые белки — антитела, способные связывать и обезвреживать их. Фибрин, образующийся из фибриногена, способствует остановке кровотечений. |
|
Двигательная |
Сократительные белки актин и миозин обеспечивают сокращение мышц у многоклеточных животных. |
|
Сигнальная |
В поверхностную мембрану клетки встроены молекулы белков, способных изменять свою третичную структуру в ответ на действие факторов внешней среды, таким образом осуществляя прием сигналов из внешней среды и передачу команд в клетку. |
|
Запасающая |
В организме животных белки, как правило, не запасаются, исключение: альбумин яиц, казеин молока. Но благодаря белкам в организме могут откладываться про запас некоторые вещества, например, при распаде гемоглобина железо не выводится из организма, а сохраняется, образуя комплекс с белком ферритином. |
|
Энергетическая |
При распаде 1 г белка до конечных продуктов выделяется 17,6 кДж. Сначала белки распадаются до аминокислот, а затем до конечных продуктов — воды, углекислого газа и аммиака. Однако в качестве источника энергии белки используются только тогда, когда другие источники (углеводы и жиры) израсходованы. |
|
Каталитическая |
Одна из важнейших функций белков. Обеспечивается белками — ферментами, которые ускоряют биохимические реакции, происходящие в клетках. Например, рибулезобифосфаткарбоксилаза катализирует фиксацию СО2 при фотосинтезе. |
Лекция № 3. Углеводы.
План.
-
Общая характеристика класса углеводов.
-
Классификация углеводов.
-
Свойства и функции углеводов.
К классу углеводов относят органические соединения, содержащие альдегидную или кетонную группу и несколько спиртовых гидроксилов. Их элементарный состав выражается общей формулой CmH2nOn. К углеводам относятся соединения, обладающие разнообразными и часто совершенно различными свойствами. Основная функция углеводов – обеспечение энергий всех процессов в организме. Часто резкое ограничение углеводов в пище ведет к значительным нарушениям обмена веществ. Особенно страдает при этом белковый обмен. Белки при дефиците углеводов используются не по назначению: они становятся источниками энергии и участниками некоторых важных химических реакций. Это приводит к повышенному образованию азотистых веществ и, как следствие, к повышенной нагрузке на почки, нарушениям солевого обмена и другим, вредным для здоровья, последствиям. При достаточном поступлении углеводов с пищей белки используются, главным образом, для пластического обмена, а не для производства энергии. Таким образом, углеводы необходимы для рационального использования белков. Они также способны стимулировать окисление промежуточных продуктов обмена жирных кислот. Углеводы также являются составной частью молекул некоторых аминокислот, участвуют в построении ферментов, образовании нуклеиновых кислот, являются предшественниками образования жиров, иммуноглобулинов, играющих важную роль в системе иммунитета, и гликопротеидов – комплексов углеводов и белков, которые являются важнейшими компонентами клеточных оболочек. При дефиците углеводов в пище организм для синтеза энергии использует не только белки, но и жиры. При усиленном распаде жиров могут возникнуть нарушения обменных процессов, связанных с ускоренным образованием кетонов (ацетон), и накоплением их в организме.
Классификация углеводов. В зависимости от состава, строения и свойств, в частности от отношения к гидролизу, углеводы делятся на две группы: простые и сложные. Простые углеводы не подвергаются гидролизу. Сложные углеводы при гидролизе распадаются с образованием простых углеводов. В виду того, что простые углеводы не гидролизуются, их называют моносахаридами. Все простые углеводы – кристаллические тела, хорошо растворимые в воде и имеющие, как правило, сладкий вкус, общая формула CnH2nOn. В зависимости от числа углеродных атомов в молекуле моносахаридов различают тетрозы (C4), пентозы (C5), гексозы (C6) и т.д. В природе чаще встречаются гексозы C6H12O6 и пентозы C5H10O5. Из гексоз наибольшее значение имеет глюкоза (виноградный сахар) и фруктоза (фруктовый сахар). Глюкоза - представитель альдоз, фруктоза – кетоз. Глюкоза и фруктоза – изомеры, имеющие одну и ту же мол. формулу, но различное строение. В состав глюкозы входит альдегидная группа, а фруктозы – кетонная. Однако моносахариды существуют не только в виде открытых цепных форм, но и в виде циклов. Эти две формы (цепная и циклическая) являются таутомерными и способны самопроизвольно переходить одна в другую в водных растворах. От формы, в которой находится моноза, зависят многие ее химические превращения. Так, глюкоза в открытой (цепной) форме вступает во все реакции, характерные для альдегидов (окисления и восстановления, замещения карбонильного кислорода, поликонденсации и т.д.). В циклической (полуацетальной) форме, т.е. когда свободная альдегидная группа отсутствует, для глюкозы характерны только реакции спиртов (взаимодействие с металлами, образования простых и сложных эфиров и т.д.). Особо важное значение имеют многие фосфорные эфиры моносахаридов, например глюкозо-1-фосфат, глюкозо-6-фосфат, фруктозо-1,6-дифосфат, рибулозо -5-фосфат и другие. Эти соединения принимают самое активное участие в биохимических процессах, протекающих в живых объектах. Фосфорилирование (т.е. введение в молекулу моносахарида остатка фосфорной кислоты) – это первый, подготовительный этап как к распсду простых углеводов, так и к биосинтезу из них более сложных углеводов.
