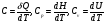ТЕПЛОЁМКОСТЬ
При поступлении теплоты температура системы повышается. В случае бесконечно малого изменения температуры справедлива пропорциональность
dT=δQ , или dT=constδQ
Это соотношение удобнее написать в виде: δQ=СdT или

Величина С называется истинной теплоемкостью системы.
Теплоемкость — это отношение количество теплоты, подведенная к системе, к тому изменению температуры, которая при этом происходит.
Кроме
истинной, различают ещё и среднюю
теплоемкость:

Теплоемкость
|
Истинная, [Дж/К] |
Мольная , [Дж/моль*К] 1 моль вещества |
Удельная, [Дж/кг*К] 1 кг вещества |
|
Экстенсивная величина |
Интенсивные величины |
|
|
|
|
|
Если теплоёмкость отнести к единице массы (молю) вещества, то она становиться независимой от массы всей системы и приобретает свойства интенсивного параметра. Если теплоёмкость относиться к единице массы вещества, она называется удельной, а к 1 моль- мольной теплоёмкостью с размерностью Дж/(моль*к)
Мы будем рассматривать только мольные теплоёмкости, т.к. для них все закономерности значительно проще, чем для удельной теплоёмкости.
Теплоёмкость зависит от условий, в которых осуществляется переход теплоты к системе. Если система заключена в постоянный объём, то повышение температуры на dT произойдёт под действием теплоты, равный CvdT , где Cv - теплоёмкость при постоянном объёме. В случаи постоянства давления при расширении системы для повышения температуры на dT потребуется теплоты CpdT, где Cp - теплоёмкость при постоянном давлении.
С
учётом условий перехода теплоты, когда
одна или несколько переменных
поддерживаются постоянными, а другие
изменятся, теплоёмкость можно выразить
при помощи частных производных:
 .
Так как δQv
= dU,
.
Так как δQv
= dU,
δQp =dH, можно записать:
 (1)
(1)
Cv – изохорное теплоёмкость газов, Cp – изобарное теплоёмкость газов.
Различия между изохорной и изобарной теплоёмкостями обусловлены различием внутренней энергии и энтальпии. Изменения энтальпии и внутренней энергии отличаются на величину работы, совершаемой системой.
δW=∆nRT, ∆H—∆U=∆nRT
Поэтому теплоёмкости при постоянном объёме Cv и постоянном давлении Cp также отличаются на величину работы: Cp - Cv = δW
На основании выражений (1) можно записать:
dU = CvdT
dH = CpdT
Подставив эти равенства в уравнение ∆H - ∆U=∆nRT
и учитывая, что ∆n = 1, найдём связь мольных теплоёмкостей газов:
Cp – Cv = R или Cp = Cv + R
Как видно, они различаются на величину газовой постоянной.
Из условия Cp = Cv + R следует, что Cp˃Cv, т.е в изобарном процессе, когда P=const, для повышения температуры системы требуется большее количество теплоты, чем в изохорном процессе.
Мольная теплоёмкость газов имеет значения порядка R, поэтому различие между Cp и Cv весьма существенно. Так, для диоксида углерода СО2 при 250С Ср = 37, 14;а Сv =28,83 Дж/(моль*К)
Разность Ср – Сv представляет собой работу изобарного расширения одного моля идеального газа при повышении температура на один градус. Жидкости и твёрдости тела характеризуются незначительным увеличением объёма при нагревании. Поэтому для конденсированных тел можно считать, что Ср ≈ Сv.
Уравнение кирхгофа. Зависимость тепловых эффектов от температуры.
Рассмотренные ранее расчеты тепловых эффектов на основе закона Гесса по теплоте образования и сгорания ограничены стандартными условиями. Для практических целей необходимо рассчитать тепловые эффекты для конкретных условий, отличных от стандартных.
Перейти от известных тепловых эффектов при стандартных условиях, т.е. при температуре 250С(298,15К) и давлении 1 атм. (1,013*105Па), к расчету тепловых эффектов при любой интересующей нас температуре можно, используя закон Кирхгофа. Процессы в промышленных условиях характеризуются значительным варьированием температуры, диапазон которой определяется не только условиями технологи, но и сезоном.Этот диапазон может достигать сотни градусов - естественно, что тепловые эффекты будут существенно различными и зависеть от температуры.
Рассмотрим закон Кирхгофа в дифференциальной форме. Для этого запишем изменения энтальпии в изобарном и внутренней энергии в изохорном процессах.
∆H = H2—H1; ∆U = U2—U1.
Продифференцируем эти уравнения по температуре и получим:


Уравнения Кирхгофа:

 и
и
 — температурные коэффициенты теплового
эффекта изобарного и изохорного процессов
соответственно;
— температурные коэффициенты теплового
эффекта изобарного и изохорного процессов
соответственно;
 и
и
 —
изменение
теплоемкости системы в результате
изобарного и изохорного процессов
соответственно.
—
изменение
теплоемкости системы в результате
изобарного и изохорного процессов
соответственно.
На основание уравнения Кирхгофа формулируется закон Кирхгофа в дифференциальной форме: температурный коэффициент теплового эффекта процесса равен изменению теплоемкости системы, происходящему в результате этого процесса.
Таким образом, закон Кирхгофа в дифференциальной форме позволяет определить лишь изменение теплового эффекта с изменением температуры, а не величину самого теплового эффекта.
Проанализируем уравнение Кирхгоф
Для реакции: aA + bB = dD+ rR при изобарном процессе (р=const) по закону Кирхгофа изменение теплоемкости в системе будет иметь вид:

Аналогичное выражение можно получить для изохорного процесса:

Так как закон Кирхгофа позволяет определить изменения теплового эффекта процесса с изменением температуры, строим график:

-
Рассмотрим первый случай, когда ∆Ср(∆Сv)˃0, т.к. ∆Ср=∑Скон.—∑Снач., отсюда вытекает, что сумма теплоемкостей продуктов реакций больше суммы теплоемкостей исходных веществ: ∑Скон.˃∑Снач. В этом случае получаем кривую 1 на графике, которая означает, что при увеличении температуры изменение теплового эффекта процесса также увеличивается (Т↑ и ∆H↑);
-
Второй случай, когда ∆Ср(∆Сv)˂0. Аналогично первому закону имеем ∑Скон.˂∑Снач. (сумма теплоемкостей конечных продуктов меньше суммы теплоемкостей начальных веществ). Тогда на графике получаем кривую, которая означает, что при увеличении температуры изменение теплового эффекта процесса уменьшается (Т↑→∆H↓)
-
И третий случай, когда изменение теплоемкостей системы равна нулю ∆Ср(∆Сv)=0. Тогда сумма теплоемкостей конечных продуктов реакций равна сумме теплоемкостей исходных веществ ∑Скон.=∑Снач. В этом случае тепловой эффект реакции не является функцией от температуры (∆H ≠ f(T)) и на графике получаем прямую.
РАСЧЕТ ТЕПЛОВЫХ ЭФФЕКТОВ ПРИ ЗАДАННОЙ
ТЕМПЕРАТУРЕ. ИНТЕГРИРОВАНИИ УРАВНЕНИЯ КИРХГОФА
Чтобы найти значение теплового эффекта в зависимости от температуры, неоюходимо проинтегрировать уравнения

От Т до Т0 (где Т — требуемая температура, Т0 — стандартная температура), от ∆H до ∆H0 или от ∆U до ∆U0 (где ∆H и ∆U — энтальпия и внутренняя энергия в условиях, отличающихся от стандартных). Интегрирование проводится для двух случаев:
|
Интегрирование |
|
|
Приближенное, т.е. изменение теплоемкости не зависит от температуры |
Точное, т.е. изменение теплоемкости зависит от температуры |
|
∆Ср≠f(T) ∆Cv≠f(T) ∆Ср=const, ∆Cv=const |
∆Ср=f(T) ∆Cv=f(T) ∆Ср≠ const, ∆Cv≠ const |