
- •А.Л.Галкин, в.К.Османов химия
- •Isbn 978-5-502-00158-8 © нгту им. Р.Е. Алексеева, 2013
- •Введение
- •Классификация неорганических веществ
- •Аллотропия
- •1.4 Соли
- •Комплексные соли
- •Генетическая связь между различными классами соединений
- •Основание Кислота Примеры
- •Основные понятия и законы химии
- •Закон сохранения массы
- •Закон постоянства состава
- •Закон эквивалентов
- •Закон авогадро
- •Уравнение состояния идеального газа
- •3. Строение атома
- •3.1. Квантовые числа
- •3.2. Принципы заполнения атомных орбиталей
- •3.3. Полная электронная формула атома
- •3.4. Периодический закон элементов д. И. Менделеева
- •Физический смысл химической периодичности
- •4. Химическая связь и строение молекул
- •4.1. Физические основы образования молекул
- •4.2. Метод валентных связей (метод вс)
- •Значения длины и энергии связи у галогеноводородных кислот
- •Взаимосвязь кратности, длины и энергии связи с - с, с - о и n - n
- •Одна s-орбиталь и одна p-орбиталь превращаются в две одинаковые «гибридные» орбитали, угол между осями которых равен 180°:
- •4.3. Метод молекулярных орбиталей
- •Энергия, длина и порядок связи в молекулах элементов I периода
- •4.4. Металлическая связь
- •4.5. Межмолекулярные взаимодействия
- •5. Энергетика и направление химических процесов
- •5.1. Термодинамическая система и ее состояния
- •5.2. Изменение свойств термодинамической системы
- •5.3. Энергия, работа, теплота
- •5.4. Обратимые и необратимые процессы
- •5.5. Первый закон термодинамики
- •5.6. Направление химических реакций
- •Второй закон термодинамики
- •Постулат планка (третий закон термодинамики)
- •6. Скорость химических реакций и и химическое равновесие
- •6.1. Влияние концентрации реагентов на скорость реакции
- •6.2. Влияние температуры на скорость реакции
- •6.3. Влияние катализатора на скорость реакции
- •А) без катализатора и б) в присутствии катализатора
- •6.4. Скорость гетерогенных химических реакций
- •6.5. Химическое равновесие
- •6.5.1. Влияние внешних факторов на состояние равновесия
- •7. Растворы
- •7.1. Вода
- •Вода в природе
- •7.2. Образование растворов
- •7.3. Способы выражения концентраций растворов
- •7.4. Растворы электролитов
- •7.4.2. Равновесные процессы в растворах электролитов
- •Цвета кислотно-основных индикаторов в зависимости от рН раствора
- •8. Окислительно – восстановительные реакции
- •8.1. Степень окисления
- •8.2. Типичные окислители и восстановители
- •8.3. Классификация окислительно-восстановительных реакций
- •8.4. Составление уравнений окислительно-восстановительных реакций
- •9. Основы электрохимических процессов
- •9.1. Измерение стандартных электродных потенциалов
- •9.2. Направление окислительно-восстановительных реакций
- •9.3. Влияние внешних факторов на величину электродного потенциала
- •9.4. Законы фарадея
- •9.5. Элементы технической электрохимии
- •10. Коррозионные процессы
- •10.1. Электрохимическая коррозия
- •10.2. Кинетика коррозионных процессов
- •10.3.Методы защиты металлов от коррозии
- •11. Номенклатура и классификация органических соединений
- •11.1. Номенклатура органических соединений
- •11. 2. Классификация органических соединений по номенклатуре июпак
- •12. Высокомолекулярные соединения
- •12.1. Классификация высокомолекулярных соединений
- •12.1.1. Классификация высокомолекулярных соединений по структуре макромолекул
- •12.1.2. Классификация полимеров по поведению при нагревании
- •12.2. Сополимеры
- •12.3. Синтез высокомолекулярных соединений
- •12.4. Свойства полимеров
- •12.5. Важнейшие полимерные материалы
- •Примеры решения задач
- •1.Основные понятия и законы химии
- •Строение атома
- •Химическая связь и строение молекул
- •Задача 4.
- •Молекула bf3 . Электронная формула атома бора 5b - 2s22p1. При образовании трех -связей атом бора переходит в возбужденное состояние
- •Решение. Последовательность действий для предсказания геометрии молекул на основании теории локализованных электронных пар следующая:
- •1.Подсчитывают число валентных электронов молекулы или иона и записывают электронную валентную структуру (льюисову структуру);
- •2.По валентной структуре определяют число -связывающих и несвязывающих электронных пар, т.Е. Тип молекулы aBnEm (n – число - связей, m – число несвязывающих электронных пар);
- •Энергетика и направление химических процессов
- •4 Моль н2 – - 150,8 кДж
- •Скорость химических реакций и химическое равновесие Задача 1
- •Растворы Примеры решения задач
- •Окислительно-восстановительные реакции примеры решения типовых задач
- •Основы электрохимических процессов
- •Коррозионные процессы
- •Галкин Андрей Львович Османов Владимир Кимович
- •603950, Нижний Новгород, ул.Минина, 24.
12.1.2. Классификация полимеров по поведению при нагревании
В зависимости от поведения при нагревании полимеры делятся на термопластичные и термореактивные.
К термопластичным полимерам относятся полимеры линейной или разветвленной структуры, свойства которых изменяются обратимо при многократном нагревании и охлаждении. Такие полимеры могут подвергаться многократной термической переработке.
К термореактивным полимерам относятся некоторые линейные и разветвленные полимеры, которые при нагревании образуют дополнительные поперечные связи и превращаются в пространственные сетчатые структуры, теряя способность плавится или растворяться. Такие полимеры могут перерабатываться только один раз.
12.2. Сополимеры
Макромолекулы полимеров могут быть построены из остатков молекул различных мономеров, а не только остатков одного мономера. Полимеры такого строения называют сополимерами.
Сополимеры делятся на регулярные, нерегулярные, блок-сополимеры и привитые сополимеры.
Нерегулярные сополимеры характеризуются нерегулярным расположением элементарных звеньев (А и В).
— А—В—В—А—В—В—В—А—В-------
Для регулярных сополимеров характерно регулярное расположение элементарных звеньев.
— А—В—А—В—А—В—А—В — •••
Блок-сополимеры содержат в линейной цепи чередующиеся блоки, состоящие из большого числа одинаковых элементарных звеньев (А и В)
—А-А-А-А—В-В-В-В-В—А-А-А-А-А—В-В-В-В-------
блок А блок В блок А блок В
Привитые сополимеры - сополимеры разветвленного строения, в которых основная цепь состоит из остатков одного мономера, а ответвления - из звеньев другого мономера.
B—B—B — . . . ответвление
|
— А—А—А—А—А—А—А—А—А — • • • основная цепь
|
B—B—B —• • • ответвление
136
Свойства различных видов сополимеров зависят от соотношения, природы и характера чередования мономерных остатков в макромолекуле, от длины и числа разветвлений и т. д.
12.3. Синтез высокомолекулярных соединений
Синтез того или иного полимера состоит из двух этапов: получения мономера и превращения его в полимер. Мономеры представляют собой низкомолекулярные вещества, молекулы которых, взаимодействуя между собой, образуют макромолекулы. Для успешного протекания реакции молекула мономера должна содержать кратные связи, неустойчивый цикл или реакционноспособные функциональные группы (не менее двух).
Наиболее важными видами сырья для производства мономеров являются нефть, попутные и природные газы, продукты сухой перегонки каменного угля.
Для синтеза высокомолекулярных соединений из мономеров применяются два метода - полимеризация и поликонденсация. Ниже приводятся характерные особенности этих процессов.
Полимеризация
Процесс полимеризации состоит в последовательном многократном присоединении молекул мономеров друг к другу. В связи с этим в эту реакцию вступают только ненасыщенные соединения или вещества с неустойчивым циклом. Процесс полимеризации протекает без образования существенных количеств побочных продуктов, а полимер и мономер имеют один и тот же элементарный состав. В условиях, применяющихся при ведении процесса, реакция полимеризации обычно практически необратима.
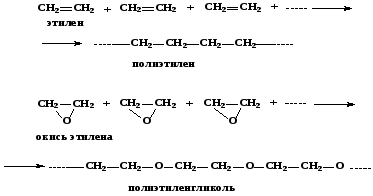
137
Поликонденсация
Молекула каждого мономера, вступающего в процесс поликонденсации, должна содержать не менее двух функциональных групп, способных реагировать с функциональными группами таких же или других мономеров. Процесс поликонденсации сопровождается образованием (отщеплением) низкомолекулярных побочных продуктов (воды, аммиака,хлористого водорода и др.). В связи с этим, элементарный состав полимера иной, чем у исходного мономера (мономеров). Серьезным недостатком является тот факт, что процесс поликонденсации имеет обратимый равновесный характер.
Поликонденсацию разделяют на гомополиконденсацию и гете-рополиконденсацию. В гомополиконденсации участвуют однородные молекулы; в гетерополиконденсации - разнородные молекулы.
Примером гомополиконденсации может служить конденсация аминокислот друг с другом, приводящая к образованию полиамидов (полипептидов), наиболее известными из которых являются белки.
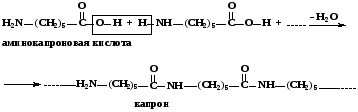
В качестве примера гетерополиконденсации можно привести конденсацию адипиновой кислоты с гексаметилендиамином, лежащую в основе синтеза волокна «нейлона».
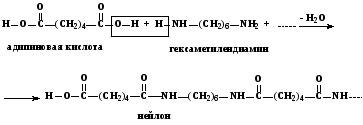
138
При поликонденсации соединений, содержащих две функциональные группы, обычно образуются линейные полимеры. В случае поликонденсации соединений, содержащих более двух функциональных групп, образуются полимеры с разветвленной и пространственной структурой.
В принципе, многие полимеры могут быть синтезированы при помощи как полимеризации, так и поликонденсации. Однако, как показывает практика, в одних случаях целесообразнее применять одну из этих реакций, а в других - другую.
