
- •А.Л.Галкин, в.К.Османов химия
- •Isbn 978-5-502-00158-8 © нгту им. Р.Е. Алексеева, 2013
- •Введение
- •Классификация неорганических веществ
- •Аллотропия
- •1.4 Соли
- •Комплексные соли
- •Генетическая связь между различными классами соединений
- •Основание Кислота Примеры
- •Основные понятия и законы химии
- •Закон сохранения массы
- •Закон постоянства состава
- •Закон эквивалентов
- •Закон авогадро
- •Уравнение состояния идеального газа
- •3. Строение атома
- •3.1. Квантовые числа
- •3.2. Принципы заполнения атомных орбиталей
- •3.3. Полная электронная формула атома
- •3.4. Периодический закон элементов д. И. Менделеева
- •Физический смысл химической периодичности
- •4. Химическая связь и строение молекул
- •4.1. Физические основы образования молекул
- •4.2. Метод валентных связей (метод вс)
- •Значения длины и энергии связи у галогеноводородных кислот
- •Взаимосвязь кратности, длины и энергии связи с - с, с - о и n - n
- •Одна s-орбиталь и одна p-орбиталь превращаются в две одинаковые «гибридные» орбитали, угол между осями которых равен 180°:
- •4.3. Метод молекулярных орбиталей
- •Энергия, длина и порядок связи в молекулах элементов I периода
- •4.4. Металлическая связь
- •4.5. Межмолекулярные взаимодействия
- •5. Энергетика и направление химических процесов
- •5.1. Термодинамическая система и ее состояния
- •5.2. Изменение свойств термодинамической системы
- •5.3. Энергия, работа, теплота
- •5.4. Обратимые и необратимые процессы
- •5.5. Первый закон термодинамики
- •5.6. Направление химических реакций
- •Второй закон термодинамики
- •Постулат планка (третий закон термодинамики)
- •6. Скорость химических реакций и и химическое равновесие
- •6.1. Влияние концентрации реагентов на скорость реакции
- •6.2. Влияние температуры на скорость реакции
- •6.3. Влияние катализатора на скорость реакции
- •А) без катализатора и б) в присутствии катализатора
- •6.4. Скорость гетерогенных химических реакций
- •6.5. Химическое равновесие
- •6.5.1. Влияние внешних факторов на состояние равновесия
- •7. Растворы
- •7.1. Вода
- •Вода в природе
- •7.2. Образование растворов
- •7.3. Способы выражения концентраций растворов
- •7.4. Растворы электролитов
- •7.4.2. Равновесные процессы в растворах электролитов
- •Цвета кислотно-основных индикаторов в зависимости от рН раствора
- •8. Окислительно – восстановительные реакции
- •8.1. Степень окисления
- •8.2. Типичные окислители и восстановители
- •8.3. Классификация окислительно-восстановительных реакций
- •8.4. Составление уравнений окислительно-восстановительных реакций
- •9. Основы электрохимических процессов
- •9.1. Измерение стандартных электродных потенциалов
- •9.2. Направление окислительно-восстановительных реакций
- •9.3. Влияние внешних факторов на величину электродного потенциала
- •9.4. Законы фарадея
- •9.5. Элементы технической электрохимии
- •10. Коррозионные процессы
- •10.1. Электрохимическая коррозия
- •10.2. Кинетика коррозионных процессов
- •10.3.Методы защиты металлов от коррозии
- •11. Номенклатура и классификация органических соединений
- •11.1. Номенклатура органических соединений
- •11. 2. Классификация органических соединений по номенклатуре июпак
- •12. Высокомолекулярные соединения
- •12.1. Классификация высокомолекулярных соединений
- •12.1.1. Классификация высокомолекулярных соединений по структуре макромолекул
- •12.1.2. Классификация полимеров по поведению при нагревании
- •12.2. Сополимеры
- •12.3. Синтез высокомолекулярных соединений
- •12.4. Свойства полимеров
- •12.5. Важнейшие полимерные материалы
- •Примеры решения задач
- •1.Основные понятия и законы химии
- •Строение атома
- •Химическая связь и строение молекул
- •Задача 4.
- •Молекула bf3 . Электронная формула атома бора 5b - 2s22p1. При образовании трех -связей атом бора переходит в возбужденное состояние
- •Решение. Последовательность действий для предсказания геометрии молекул на основании теории локализованных электронных пар следующая:
- •1.Подсчитывают число валентных электронов молекулы или иона и записывают электронную валентную структуру (льюисову структуру);
- •2.По валентной структуре определяют число -связывающих и несвязывающих электронных пар, т.Е. Тип молекулы aBnEm (n – число - связей, m – число несвязывающих электронных пар);
- •Энергетика и направление химических процессов
- •4 Моль н2 – - 150,8 кДж
- •Скорость химических реакций и химическое равновесие Задача 1
- •Растворы Примеры решения задач
- •Окислительно-восстановительные реакции примеры решения типовых задач
- •Основы электрохимических процессов
- •Коррозионные процессы
- •Галкин Андрей Львович Османов Владимир Кимович
- •603950, Нижний Новгород, ул.Минина, 24.
9.3. Влияние внешних факторов на величину электродного потенциала
Очевидно, что величина межфазного скачка потенциала должна зависеть от очень большого числа факторов. В первую очередь это химическая природа электродного материала, температура, концентрация и природа потенциалопределяющих частиц в растворе.
Данная взаимосвязь была установлена и носит название уравнения Нернста
Е
= Е0
+
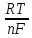 ln
ln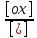 . (9.3)
. (9.3)
В
этом уравнении Е
– электродный потенциал (В); Е0-
стандартный электродный потенциал (В);
R
= 8,31
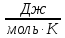 универсальная газовая постоянная;
Т-температура
(К); n
– число электронов в полуреакции; F
– число
Фарадея; [ox]
– концентрация
универсальная газовая постоянная;
Т-температура
(К); n
– число электронов в полуреакции; F
– число
Фарадея; [ox]
– концентрация
99
окисленной формы потенциалопределяющих частиц (моль/л); [red] – концентрация восстановленной формы потенциалопределяющих частиц (моль/л).
Например, для полуреакции окисления
Mn2++4H2O
- 5 =MnO4-
+ 8H+,
(9.4)
=MnO4-
+ 8H+,
(9.4)
в которой слева – восстановленная форма потенциалопределяющих частиц, а справа – окисленная форма, уравнение Нернста для стандартной температуры будет иметь следующий вид:
E
= +1,507
+
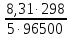 ln
ln
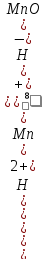 .
.
Введем
несколько упрощений. При стандартной
температуре 298К и переходе к десятичным
логарифмам получим
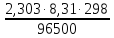 =0,059В. Концентрация молекул воды в водных
растворах может считаться величиной
постоянной и в уравнение не включаться.
В результате для стандартной температуры
уравнение принимает следующий вид:
=0,059В. Концентрация молекул воды в водных
растворах может считаться величиной
постоянной и в уравнение не включаться.
В результате для стандартной температуры
уравнение принимает следующий вид:
Е
= Е0
+
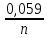 lg
lg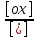 , (9.5)
, (9.5)
E
= +1,507
+
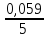 lg
lg
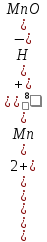 .
.
Подлогарифмическое
выражение является константой равновесия
(К) для реакции (9.4) Кс
=
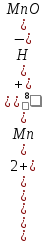 ,
поэтому уравнение (9.5) может быть
представлено в следующем виде:
,
поэтому уравнение (9.5) может быть
представлено в следующем виде:
Е
= Е0
+
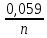 lg
К.
(9.6)
lg
К.
(9.6)
Если
электродная система состоит из
металлического электрода, опущенного
в раствор, содержащий одноименные ионы
Me0
-
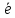 =Me+n,
то уравнение Нернста при стандартной
температуре приобретает следующий вид,
учитывая, что [Me0]
– величина постоянная:
=Me+n,
то уравнение Нернста при стандартной
температуре приобретает следующий вид,
учитывая, что [Me0]
– величина постоянная:
Е
= Е0
+
 lg
[Me+n].
(9.7)
lg
[Me+n].
(9.7)
Взаимосвязь между константой равновесия и величиной ЭДС может быть получена из ур.2.9 и ур.9.6.
G = - RT ln K и ΔG = -nFΔЕ.
Приравнивая правые части, получим
RT ln Kp = nFΔЕ,
откуда
ln
K
=
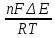 .
.
Для стандартной температуры и десятичных логарифмов
lgK
=
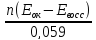 . (9.8)
. (9.8)
100
9.4. Законы фарадея
Использование электрохимичеких систем в технике возможно в двух вариантах.
Преобразование внутренней энергии самопроизвольных окислительно-восстановительных реакций в энергию постоянного тока. Это преобразование осуществляется в устройствах, называемых «химические источники тока».
Получение веществ за счет проведения несамопроизвольных ОВР под действием постоянного электрического тока. Эти процессы получили название «электролиз».
В обоих случаях существует взаимосвязь между массой реагирующих или образующихся на электродах веществ и количеством протекшего электричества. Эта взаимосвязь была установлена и носит название законов Фарадея.
1-й закон Фарадея: масса вещества, прореагировавшего или образовавшегося на электроде, пропорциональна количеству прошедшего через электролит электричества.
M ~ Q,
где m (г) – масса вещества; Q (Кл) – количество электричества.
Для перехода к уравнению вводится коэффициент пропорциональности q
M = qQ. (9.9)
Количество электричества Q определяется как произведение силы тока I (А) на время t (c).
m = q I t. (9.10)
2-й закон Фарадея: Теоретическая масса вещества, прореагировавшего или образовавшегося на электроде, при прохождении через него 1-го фарадея (F) электричества называется электрохимическим эквивалентом q.
q
=
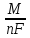 (9.11)
(9.11)
где М (г/моль)- молярная масса вещества; n – число электронов в полуреакции; F(Кл/моль)- число Фарадея.
Объединяя аналитические выражения 1-го и 2-го законов получим
m
=
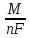 I
t
Bт
.
(9.12)
I
t
Bт
.
(9.12)
В этом уравнении величина Вт называется «выход по току» и показывает долю тока, пошедшего на данную реакцию, если она протекала на электроде не одна. Определяется экспериментально, как отношение практически полученной массы вещества к ее теоретическому значению
Вт
=
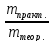 ∙100%
. (9.13)
∙100%
. (9.13)
Если необходимо рассчитать объем образовавшегося в электродной реакции газа, то ур.9.12 может быть преобразовано
V
=
 I
t
Вт,
(9.14)
I
t
Вт,
(9.14)
где Vm (л/моль) – молярный объем – 22,4 л/моль.
101
