
Скорость реакции
.docФедеральное агентство по образованию
Нижегородский государственный университет
им. Н.И.Лобачевского
Химический факультет
Кафедра неорганической химии
Скорость химических реакций и химическое равновесие
Отчёт о лабораторной работе
Преподаватель:
Р.М.Шапошников
Студенты группы 211 (II):
Т. Г. Огурцов,
О. А. Шилягина
Нижний Новгород, 2008
Задания лабораторной работы:
-
Влияние концентрации реагирующих веществ, температуры и катализатора на скорость химической реакции.
Влияние концентрации реагирующих веществ, температуры и катализатора на скорость химической реакции
Цель работы: оценить влияние концентрации реагирующих веществ, температуры и катализатора на скорость химической реакции.
Оборудование и реактивы: пробирки, пипетки, резиновая груша, стеклянные стаканы, термометр, лакмусовая бумага, бюретка, уравнительный цилиндр, двурогая пробирка, дистиллированная вода, 0,1Н раствор тиосульфата натрия (Na2S2O3), 0,1Н раствор серной кислоты (H2SO4).
Теоретическая часть:
Скорость химической реакции зависит от природы веществ, от концентрации реагирующих веществ, от температуры и от катализатора. Зависимость скорости химической реакции от температуры выражается правилом Вант – Гоффа: «При увеличении температуры на каждые десять градусов, скорость химической реакции изменяется в соответствии с температурным коэффициентом». Правило Вант-Гоффа является приближенным и применимо лишь для ориентировочной оценки влияния температуры на скорость реакции. Более точным является уравнение Аррениуса:
k = A∙e –Ea/RT, где
A - постоянная, зависящая от природы реагирующих веществ;
R - универсальная газовая постоянная;
Ea - энергия активации, т.е. энергия, которой должны обладать сталкивающиеся молекулы, чтобы столкновение привело к химическому превращению.
В упрощенном виде механизм действия катализатора можно представить следующим образом. Изменение энергии активации реакции происходит за счет образования катализатором К с одним из реагентов А промежуточного соединения АК:
A + K = AK
AK + B = AB + K
Суммарная реакция: A + B = AB
Практическая часть:
-
В 4 чистые пробирки налили различное количество воды, затем в эти же пробирки налили различное количество 0,1Н раствора тиосульфата натрия (Na2S2O3);
-
В 4 другие пробирки налили по 6 мл. 0,1Н раствора серной кислоты (H2SO4);
-
П
 риливали
по очереди серную кислоту в пробирки
с тиосульфатом натрия и водой. При этом
засекали по секундомеру, через сколько
времени раствор помутнеет, т.е. через
какой промежуток времени сера выпадет
в осадок. То
есть
произойдёт
реакция:
Na2S2O3
+ H2SO4
S + SO2
+ Na2SO4
+ H2O
риливали
по очереди серную кислоту в пробирки
с тиосульфатом натрия и водой. При этом
засекали по секундомеру, через сколько
времени раствор помутнеет, т.е. через
какой промежуток времени сера выпадет
в осадок. То
есть
произойдёт
реакция:
Na2S2O3
+ H2SO4
S + SO2
+ Na2SO4
+ H2O -
Результаты занесли в таблицу:
Таблица №1
|
№ пробирки |
Объём вещества, мл. |
Концентрация, моль/л. |
t, сек. |
1/ t, cек-1 |
|||
|
Na2S2O3 |
Н2О |
H2SO4 |
Na2S2O3 |
H2SO4 |
|||
|
1 |
6 |
0 |
6 |
0,05 |
0,05 |
39 |
0,026 |
|
2 |
4 |
2 |
6 |
0,033 |
0,05 |
52 |
0,019 |
|
3 |
3 |
3 |
6 |
0,025 |
0,05 |
72 |
0,014 |
|
4 |
2 |
4 |
6 |
0,016 |
0,05 |
117 |
0,008 |
Выражение
закона действующих масс в общем виде
выглядит так:
![]()
Найдём
скорость химической реакции
![]()
![]() ,
значит закон действующих масс для этой
реакции будет выглядеть следующим
образом:
,
значит закон действующих масс для этой
реакции будет выглядеть следующим
образом:
![]()
-
Построим график зависимости скорости реакции от концентрации тиосульфата натрия в координатах С(моль/литр) - 1/t (с-1) (рис.1)
1/t,
с-1
рис.1
C,
моль/литр
Вывод: По графику зависимости скорости реакции от концентрации тиосульфата натрия (рис.1) видно, что скорость химической реакции увеличивается при повышении концентрации реагирующих веществ, согласно закону действующих масс (в нашем случае при повышении концентрации тиосульфата натрия, так как концентрация серной кислоты всегда оставалась неизменной).
-
В две чистые пробирки налили по 1,5 мл. 0,1Н растворов тиосульфата натрия и серной кислоты соответственно;
-
Смешивали содержимое этих пробирок и по секундомеру засекали время через сколько раствор помутнеет;
-
Такую операцию проводили ещё 2 раза, но при температуре на 10 и 20ºС выше, чем в первом опыте. Температуру растворов измеряли термометром;
-
Результаты измерений занесём в таблицу:
Таблица 2
|
№ опыта |
T, K |
1/T |
t, cek |
1/t |
ln(1/t) |
γ |
|
1 |
298 |
0.00335 |
70 |
0.01428 |
-4.248 |
2.16 |
|
2 |
308 |
0.00324 |
32 |
0.0313 |
-3.464 |
2.16 |
|
3 |
318 |
0.00314 |
15 |
0.0666 |
-2.708 |
2.16 |
П
1/t,
с-1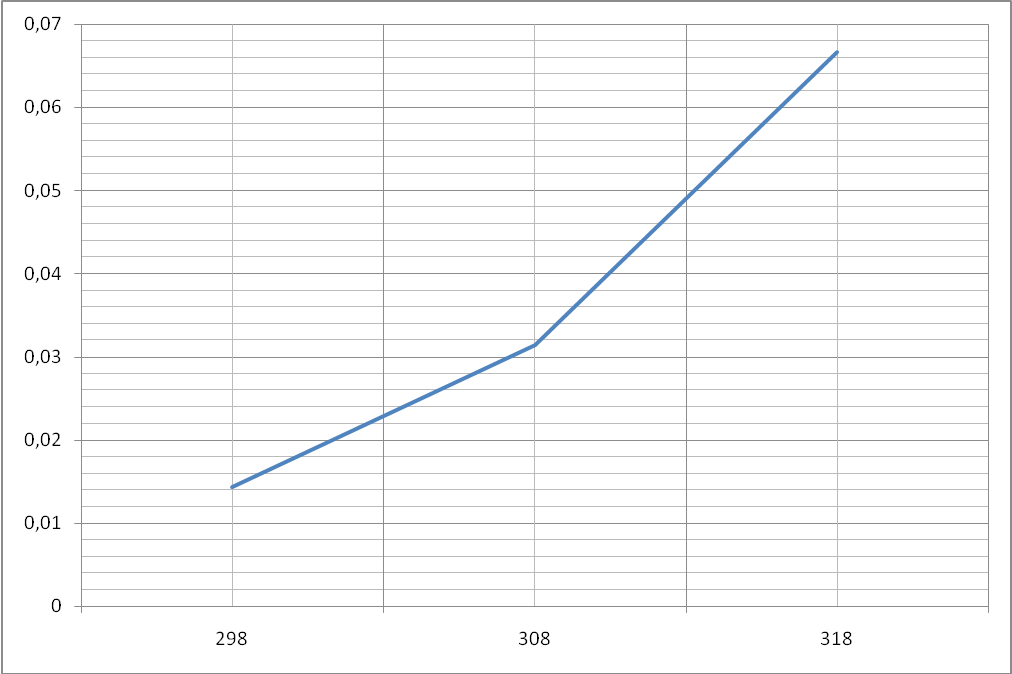 остроим
график зависимости скорости реакции
от температуры в координатах 1/t
(с-1)
– Т(К) (рис.2)
остроим
график зависимости скорости реакции
от температуры в координатах 1/t
(с-1)
– Т(К) (рис.2)
рис.2
Т,
К
Вывод: По графику зависимости скорости реакции от температуры (рис. 2) видно, что скорость химической реакции возрастает при повышении температуры.
Температурный коэффициент Вант - Гоффа Ω рассчитаем методом наименьших квадратов: для этого сделаем таблицу:
Таблица3
|
i |
Ti |
t,i |
xi=Ti |
yi=lg(1/ t,i) |
xi2 |
xiyi |
|
1 |
298 |
70 |
298 |
-1,845 |
88804 |
-549,81 |
|
2 |
308 |
32 |
308 |
-1,505 |
94864 |
-463,54 |
|
3 |
318 |
15 |
318 |
-1,176 |
101124 |
-376,968 |
|
Сумма |
924 |
-4,526 |
284792 |
-1387,318 |
||
![]() -
уравнение Вант - Гоффа
-
уравнение Вант - Гоффа
![]()

![]()
lgΩ = 10∙b
lgΩ = 10∙0.03345 = 0.3345
Ω = 100.3345= 2.16
Энергию активации EA рассчитаем по уравнению Аррениуса методом наименьших квадратов: для этого составим таблицу:
Таблица 4
|
i |
Ti |
ti |
xi=1/Ti |
yi=ln(1/ti) |
xi2 |
xiyi |
|
1 |
298 |
70 |
0,00335 |
-4,248 |
0,0000112 |
-0,0143 |
|
2 |
308 |
32 |
0,00325 |
-3,466 |
0,0000105 |
-0,01126 |
|
3 |
318 |
15 |
0,00314 |
-2,708 |
0,0000099 |
-0,0085 |
|
Сумма |
0,00985 |
-10,582 |
0,00003256 |
-0,03476 |
||
![]() -
Уравнение Аррениуса
-
Уравнение Аррениуса
EA= -b∙R

![]() (К)
(К)
E A=
7199.391∙8.31= 59826,94 (Дж/моль)
A=
7199.391∙8.31= 59826,94 (Дж/моль)
Зависимость скорости реакции от катализатора:
-
С
рис.3
обрали установку из двурогой пробирки, бюретки и уравнительного цилиндра, как показано на рисунке 3; -
Заполнили бюретку водой так, чтобы при выравнивании менисков воды в бюретке и цилиндре уровень воды в бюретке был на нулевом делении;
-
Перед каждым измерением проверяли прибор на герметичность;
-
В одно из колен пробирки налили 1 мл 3% раствора пероксида водорода, а в другое колено 1 мл. бихромата калия (K2Cr2O7) (тёмно – оранжевый цвет);
-
Затем прилили бихромат калия к перекиси водорода и взбалтывали, при этом выделялся кислород. Пробирка нагревалась, значит реакция экзотермическая;
-
Такой опыт провели ещё два раза, только с бихроматом калия, разбавленным щёлочью, и смесью бихромата калия + разбавленный бихромат калия щёлочью;
-
Результаты занесли в таблицу:
Таблица 5
|
№ опыта |
V(H2O2), мл. |
|
pH (K2Cr2O7) |
V(K2Cr2O7), мл. |
t, сек. |
Уровень воды в бюретке |
|
1 |
1 |
3 |
5 |
1 |
0 |
6,4 |
|
10 |
7 |
|||||
|
20 |
9 |
|||||
|
30 |
12,5 |
|||||
|
40 |
14,6 |
|||||
|
50 |
17 |
|||||
|
60 |
19 |
|||||
|
70 |
20,6 |
|||||
|
80 |
21,9 |
|||||
|
90 |
23 |
|||||
|
100 |
23,8 |
|||||
|
110 |
24,6 |
|||||
|
120 |
25,2 |
|||||
|
130 |
25,6 |
|||||
|
140 |
26 |
|||||
|
150 |
26,4 |
|||||
|
160 |
26,6 |
|||||
|
170 |
27 |
|||||
|
180 |
27,4 |
|||||
|
Объём выделившегося кислорода: 27,4-6,4 = 21 мл. |
||||||
|
2 |
1 |
3 |
6 |
1 |
0 |
6,0 |
|
30 |
8,8 |
|||||
|
60 |
16,4 |
|||||
|
90 |
20,7 |
|||||
|
120 |
24 |
|||||
|
150 |
26 |
|||||
|
180 |
26,5 |
|||||
|
210 |
27,9 |
|||||
|
Объём выделившегося кислорода: 27,9-6,0 = 21,9 мл. |
||||||
|
3 |
1 |
3 |
9 |
1 |
0 |
6,0 |
|
30 |
6,5 |
|||||
|
60 |
7,2 |
|||||
|
90 |
7,4 |
|||||
|
120 |
7,6 |
|||||
|
150 |
8,0 |
|||||
|
180 |
8,2 |
|||||
|
210 |
8,4 |
|||||
|
240 |
8,6 |
|||||
|
270 |
8,7 |
|||||
|
300 |
8,8 |
|||||
|
Объём выделившегося кислорода: 8,8-6,0 = 2,8 мл. |
||||||
Построим график зависимости выделившегося кислорода от времени:
а
V(O2),
мл.
б
t,c
рис.4
V(O2),
мл.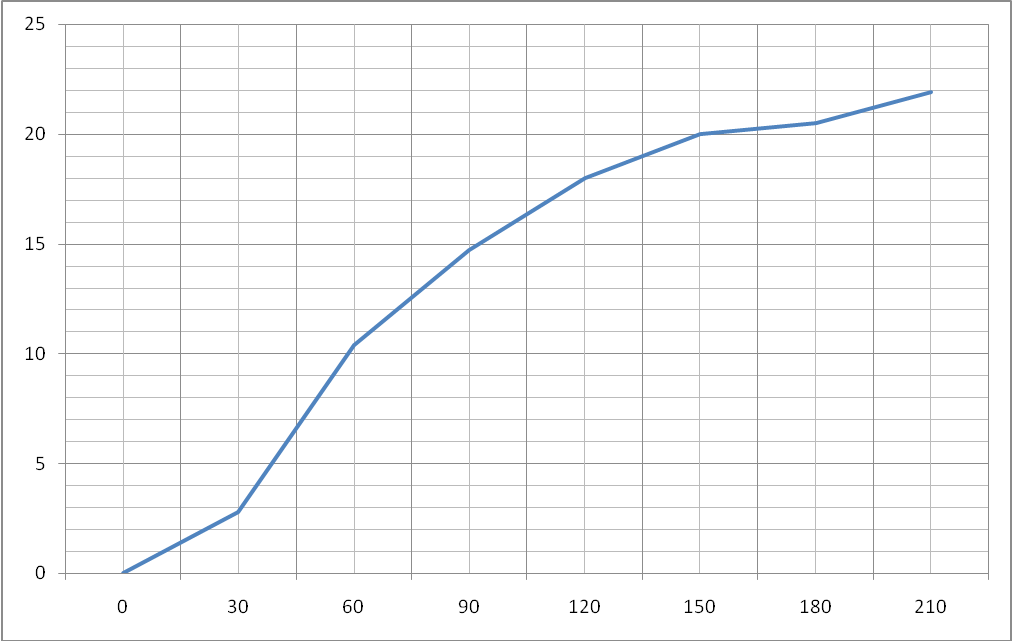
рис.5
t,c
в
V(O2),
мл.
г
рис.6
t,c
V(O2),
мл.
рис.7
рН
Вывод:
С корость
химической реакции зависит от концентрации
реагирующих веществ. Для нашей реакции
взаимодействия тиосульфата натрия и
серной кислоты: Na2S2O3
+ H2SO4
S
+ SO2
+ Na2SO4
+ H2O
закон действующих масс запишется
следующим образом:
корость
химической реакции зависит от концентрации
реагирующих веществ. Для нашей реакции
взаимодействия тиосульфата натрия и
серной кислоты: Na2S2O3
+ H2SO4
S
+ SO2
+ Na2SO4
+ H2O
закон действующих масс запишется
следующим образом:
![]() .
Было выяснено, что при увеличении
концентрации тиосульфата натрия при
постоянной концентрации серной кислоты
скорость реакции увеличивалась.
.
Было выяснено, что при увеличении
концентрации тиосульфата натрия при
постоянной концентрации серной кислоты
скорость реакции увеличивалась.
П ри
увеличении температуры скорость реакции
также увеличивалась. Температурный
коэффициент Вант – Гоффа для нашей
реакции Na2S2O3
+ H2SO4
S
+ SO2
+ Na2SO4
+ H2O
составил 2,16. А энергия активации этой
реакции составила 59826,94 (Дж/моль), что
говорит о том, что реакция пойдёт не
сразу, и для её прохождения потребуется
определённое время. И действительно,
помутнение раствора происходило лишь
через определённое время.
ри
увеличении температуры скорость реакции
также увеличивалась. Температурный
коэффициент Вант – Гоффа для нашей
реакции Na2S2O3
+ H2SO4
S
+ SO2
+ Na2SO4
+ H2O
составил 2,16. А энергия активации этой
реакции составила 59826,94 (Дж/моль), что
говорит о том, что реакция пойдёт не
сразу, и для её прохождения потребуется
определённое время. И действительно,
помутнение раствора происходило лишь
через определённое время.
На скорость реакции также влияет катализатор. В реакции разложения пероксида водорода катализатором был выбран бихромат калия. Чем больше бихромата калия находилось в реакционной смеси, тем больше выделялось кислорода. При увеличении значения рН наблюдалась общая тенденция к уменьшению объёма выделяющегося газа.
