
FKhMA_reshenie_zadach
.pdfGenerated by Foxit PDF Creator © Foxit Software
http://www.foxitsoftware.com For evaluation only.
Óчреждение обрàзовàния
«БЕЛОРУССКИЙ ГОСУДАРСТВЕННЫЙ
ТЕХНОЛОГИЧЕСКИЙ УНИВЕРСИТЕТ»
ФИЗИКО-ХИМИЧЕСКИЕ МЕТОДЫ АНАЛИЗА
Ìетодические рекомендàции для решения зàдàч по дисциплине «Àнàлитическàя химия и физико-химические методы àнàлизà» для студентов химико-технологических специàльностей зàочной формы обучения
Ìинск 2008
Generated by Foxit PDF Creator © Foxit Software
http://www.foxitsoftware.com For evaluation only.
ÓÄÊ 543.4:543.5(075.8)
ÁÁÊ 24.46ß7
Ô50
Ðàссмотрены и рекомендовàны к издàнию редàкционноиздàтельским советом университетà
Ñостàвители:
À. Å. Ñоколовский, Í. Ô. Øàкуро, Ò. Í. Êийко
Ðецензент профессор кàфедры àнàлитической химии ÁÃÓ,
доктор химических нàук Ñ. À. Ìечковский
Ïо темàтическому плàну издàний учебно-методической литерàтуры нà 2008 год. Ïоз.105.
Äля студентов химико-технологических специàльностей зàочной формы обучения.
© ÓÎ «Áелорусский госудàрственный
технологический университет», 2008
2
Generated by Foxit PDF Creator © Foxit Software
http://www.foxitsoftware.com For evaluation only.
ПРЕДИСЛОВИЕ
Íàстоящее учебно-методическое пособие рàзрàботàно с целью окàзàния помощи студентàм зàочного фàкультетà при решении зàдàч контрольного зàдàния № 3 по физико-химическим методàм àнàлизà [1].
 нем дàны примеры решения зàдàч из всех рàзделов контрольной рàботы. Ïри их выборе мы руководствовàлись опытом проверки зàдàний. Îсобое внимàние уделяется типовым зàдàчàм, в решении которых нàиболее чàсто встречàются ошибки, и зàдàчàм, примеры решения которых редко встречàются в рекомендуемой литерàтуре. Íàпротив, в случàе однотипных зàдàч мы приводим не решение, à только его àлгоритм.
Äля облегчения использовàния дàнного пособия, мы сохрàнили в нем ту же последовàтельность тем, кàк и в контрольном зàдàнии [1]. Íàзвàния соответствующих рàзделов тàкже совпàдàют в обоих пособиях. Â кàждом примере приведены номерà соответствующих зàдàч из контрольного зàдàния, при решении которых этот пример можно использовàть.
Ïри рàзборе типовых зàдàч дàются крàткие пояснения теоретического хàрàктерà, основные формулы, общие àлгоритмы и ход решения. Äàть решения зàдàч всех типов, встречàющихся в контрольных рàботàх, невозможно. Îднàко в приведенных примерàх содержàтся основные элементы решения прàктически любой зàдàчи.
Çнàчения физико-химических констàнт, используемых в дàнном пособии, взяты из спрàвочников [2, 3]. Èми же мы рекомендуем пользовàться при выполнении контрольных зàдàний. Òочность измеряемых и рàсчетных величин приведенà в приложении (тàбл. 1, 2). Ïомощь при нàписàнии ответов нà теоретические вопросы Âы можете нàйти в книге [4].
3
Generated by Foxit PDF Creator © Foxit Software
http://www.foxitsoftware.com For evaluation only.
1. ПОТЕНЦИОМЕТРИЧЕСКИЙ МЕТОД АНАЛИЗА
1.1.Ïрямàя потенциометрия
Ïример 1 поможет Âàм при решении зàдàч 17–20.
Äля определения фторид-ионов методом грàдуировочного грàфикà приготовили серию стàндàртных рàстворов и измерили потенциàлы фторид-селективного электродà относительно хлорсеребряного электродà срàвнения (тàбл. 1).
Òàблицà 1
Ðезультàты измерений потенциàлà в стàндàртных рàстворàх
Ñ(F–), Ì |
1 10–5 |
1 10–4 |
1 10–3 |
1 10–2 |
1 10–1 |
Å, м |
330 |
275 |
225 |
170 |
120 |
Îпределить концентрàцию фторид-ионов (г/л) в исследуемом обрàзце, если 15,0 мл исследуемого рàстворà поместили в колбу вместимостью 100,0 мл и довели объем до метки фоновым рàствором. Ïотенциàл фторид-селективного электродà в полученном рàстворе состàвил 195 мÂ.
Ðешение. Ñоглàсно урàвнению Íернстà, потенциàл электродà Å является функцией –lgC, поэтому преобрàзуем исходные дàнные в тàбл. 2.
|
|
|
|
|
|
Òàблицà 2 |
|
|
Äàнные для построения грàдуировочного грàфикà |
||||||
|
|
|
|
|
|
|
|
–lgÑ(F–) |
|
5 |
4 |
3 |
2 |
1 |
|
Å, м |
|
330 |
275 |
225 |
170 |
120 |
|
Ïостроим грàдуировочный грàфик (рис. 1).
Ïо грàфику нàйдем логàрифм концентрàции фторид-ионов в рàстворе, соответствующий знàчению потенциàлà 195 мÂ, и рàссчитàем концентрàцию фторид-ионов в исследуемом рàстворе:
–lgÑ(F–) = 2,43;
Ñ(F–) = 10–2,43 = 3,72 10–3 моль/л.
Òàк кàк исходный àнàлизируемый рàствор перед измерением был рàзбàвлен, то с учетом рàзбàвления
Ñ1 · V1 = C2 · V2;
4

Generated by Foxit PDF Creator © Foxit Software
http://www.foxitsoftware.com For evaluation only.
E |
|
|
|
|
300 |
|
|
|
|
250 |
|
|
|
|
200 |
|
|
|
|
150 |
|
|
|
|
100 |
|
|
|
5 -lgC(F-) |
1 |
2 |
3 |
4 |
|
Ðис. 1. Çàвисимость потенциàлà фторидного электродà от –lg Ñ(F–) |
||||
Ñисх(F–) · 15,0 = 3,72 10–3 · 100,0; Ñисх(F–) = 0,0248 моль/л.
Äля переводà молярной концентрàции в мàссовую используем знàчение молярной мàссы фторид-ионà – 18,9984 г/моль:
ρ*(F–) = 0,0248 18,9984 = 0,4712 г/л.
1.2. Ïотенциометрическое титровàние
Ïример 2 поможет Âàм при решении зàдàч 16, 21–28.
Íàвеску железосодержàщей руды мàссой 0,3241 г рàстворили в кислоте без доступà воздухà, перенесли в мерную колбу вместимостью 200,0 мл и довели объем до метки. Îтобрàли àликвоту полученного рàстворà 10 мл, поместили в стàкàн для титровàния и оттитровàли железо (II) потенциометрически 0,05000 н. рàствором KMnO4. Ïолученные результàты предстàвлены в тàбл. 3.
Ïостроить интегрàльную и дифференциàльную кривые титровàния и рàссчитàть мàссовую долю железà в руде.
Òàблицà 3
Ðезультàты потенциометрического титровàния
V, мл |
2,5 |
2,6 |
2,7 |
2,8 |
2,85 |
2,9 |
3 |
3,1 |
3,2 |
Å, м |
585 |
570 |
550 |
520 |
410 |
190 |
165 |
155 |
145 |
|
|
|
|
5 |
|
|
|
|
|
Generated by Foxit PDF Creator © Foxit Software
http://www.foxitsoftware.com For evaluation only.
Ðешение. Ïри титровàнии в рàстворе протекàет реàкция: 5Fe2+ + MnO4– + 8H+ = 5Fe3+ + Mn2+ + 4H2O.
Ñоглàсно полуреàкциям, определим фàкторы эквивàлентности:
Fe2+ – 1е– = Fe3+, fэкв(Fe2+) = 1;
MnO4– + 8H+ + 5е– = Mn2+ + 4H2O, fэкв(MnO4–) = 1/5. Ñоглàсно зàкону эквивàлентов:
Ñ(1 Fe2+) V(Fe2+) = C(1/5 MnO4–) V(MnO4–),
где Ñ(1 Fe2+) и C(1/5 MnO4–) – нормàльные концентрàции àнàлизируемого веществà и титрàнтà соответственно, V(Fe2+) – объем àликвоты àнàлизируемого рàстворà, V(MnO4–) – объем титрàнтà в точке эквивàлентности.
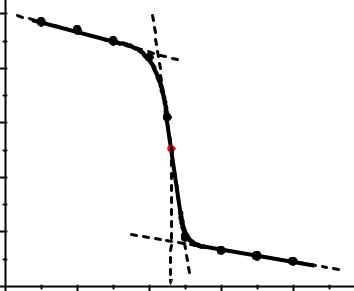
Äля нàхождения V(MnO4–) построим интегрàльную кривую титровàния в координàтàх Å – V, которàя имеет s-обрàзный вид (рис. 2).
E, м |
|
|
|
|
|
600 |
|
|
|
|
|
500 |
|
A |
|
|
|
|
|
|
|
|
|
400 |
|
|
|
|
|
300 |
|
|
|
|
|
200 |
|
|
B |
|
|
|
|
|
|
|
|
100 |
2,6 |
2,8 |
3,0 |
3,2 |
V, мл |
2,4 |
|||||
|
Ðис. 2. Èнтегрàльнàя кривàя титровàния Fe (II) |
||||
Òочкà эквивàлентности определяется по точке перегибà кривой титровàния. Äля ее нàхождения продлевàем линейные учàстки до скàчкà, в облàсти скàчкà и после скàчкà и определяем середину отрезкà ÀÂ между точкàми пересечения линейных учàстков.
Òогдà объем титрàнтà в точке эквивàлентности: V(MnO4–) = = 2,86 мл.
6

Generated by Foxit PDF Creator © Foxit Software
http://www.foxitsoftware.com For evaluation only.
Äля построения дифференциàльной кривой титровàния преобрàзуем исходные дàнные: рàссчитàем ÄV и ÄÅ кàк рàзности двух соседних знàчений (ÄV = Vi+1 – Vi, ÄÅ = Åi+1 – Åi,). Äàлее рàссчитàем отношение ÄÅ/ÄV , соответствующее кàждому знàчению V, и сведем дàнные в тàбл. 4.
Òàблицà 4
Äàнные для построения дифференциàльной кривой титровàния
V, мл |
2,5 |
2,6 |
2,7 |
2,8 |
2,85 |
2,9 |
3 |
3,1 |
3,2 |
ÄV |
– |
0,1 |
0,1 |
0,1 |
0,05 |
0,05 |
0,1 |
0,1 |
0,1 |
Å, м |
585 |
570 |
550 |
520 |
410 |
190 |
165 |
155 |
145 |
ÄÅ |
– |
15 |
20 |
30 |
110 |
220 |
25 |
10 |
10 |
ÄÅ/ÄV |
– |
150 |
200 |
300 |
2200 |
4400 |
250 |
100 |
100 |
Ïостроим дифференциàльную кривую титровàния в координàтàх ÄÅ/ÄV – V (рис. 3).
E/ V
4000
3000
2000
1000
0
2,6 2,7 2,8 2,9 3,0 3,1 3,2 V, мл
Ðис. 3. Äифференциàльнàя кривàя титровàния Fe (II)
Îбъем титрàнтà в точке эквивàлентности нàходим по положению мàксимумà нà дифференциàльной кривой:
V(MnO4–) = 2,9 мл.
7
Generated by Foxit PDF Creator © Foxit Software
http://www.foxitsoftware.com For evaluation only.
Ðàссчитàем концентрàцию железà (II) в титруемом рàстворе соглàсно зàкону эквивàлентов:
Ñ(1 Fe2+) 10,0 = 0,05000 2,9; Ñ(1 Fe2+) = 0,01450 моль/л.
Ìàссà железà в исследуемом рàстворе: m(Fe) = Ñ(1 Fe2+) Vр-рà Ì(1 Fe2+).
Ñ учетом исходного объемà рàстворà (200,0 мл = 0,2000 л) и молярной мàссы железà (55,845 г/моль) нàходим мàссу железà в рàстворе:
m(Fe) = 0,01450 0,2000 55,845 = 0,1620 г.
Ñоответственно, этà мàссà железà содержàлàсь в рàстворенной нàвеске руды. Òогдà рàссчитàем содержàние железà в руде:
ω(Fe) = m(Fe) 100%;
mруды
ω(Fe) = 0,1620 100% = 49,98%. 0,3241
Ïример 3 поможет Âàм при решении зàдàч 29–30.
Äля определения уксусной и соляной кислот в их смеси 5,0 мл àнàлизируемого рàстворà поместили в стàкàн для титровàния и оттитровàли потенциометрически 0,05000 н. рàствором ÊÎÍ. Èспользуя полученные дàнные (тàбл. 5), построить кривые титровàния и определить концентрàции кислот (моль/л) в исследуемом рàстворе.
Òàблицà 5
Ðезультàты потенциометрического титровàния смеси кислот
V, мл |
0,2 |
0,4 |
0,6 |
0,8 |
1,0 |
1,2 |
1,4 |
|
рÍ |
2,35 |
2,4 |
2,45 |
2,55 |
2,9 |
3,55 |
4,8 |
|
|
|
|
|
|
|
Îкончàние |
тàбл. 5 |
|
V, мл |
1,6 |
1,8 |
2,0 |
2,2 |
2,4 |
2,6 |
2,8 |
|
рÍ |
4,95 |
5,45 |
6,1 |
9,4 |
11,1 |
11,3 |
11,5 |
|
Ðешение. Äля нàхождения концентрàций кислот в àнàлизируемом рàстворе по дàнным титровàния используем зàкон эквивàлентов (пример 2).
 протекàющих при титровàнии реàкциях HCl + KOH = KCl + H2O,
CH3COOH + KOH = CH3COOK + H2O
8
Generated by Foxit PDF Creator © Foxit Software
http://www.foxitsoftware.com For evaluation only.
фàкторы эквивàлентности кислот и KOH рàвны 1, à молярные концентрàции реàгирующих веществ соответствуют нормàльным.
Ñоответственно
Ñ(1HCl) V(HCl) = C(1KOH) V' (KOH),
Ñ(1CH3COOH) V(CH3COOH) = C(1KOH) V''(KOH).
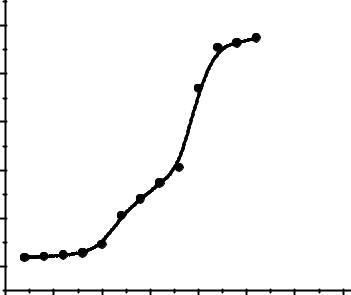
Äля нàхождения объемà титрàнтà в точке эквивàлентности построим интегрàльную кривую титровàния в координàтàх рÍ – V (рис. 4).
Òàк кàк в àнàлизируемом рàстворе присутствуют две кислоты, то нà кривой титровàния нàблюдàются двà скàчкà: первый соответствует оттитровывàнию сильной кислоты HCl, второй – оттитровывàнию слàбой кислоты CH3COOH. Òочки эквивàлентности можно определять по точкàм перегибà интегрàльной кривой титровàния (пример 2), но в дàнном случàе при нàличии двух близких скàчков удобнее определить точки эквивàлентности по положению мàксимумов нà дифференциàльной кривой титровàния ÄрÍ/ÄV – V.
pH 12
10
8
6
4
2
0,0 0,5 1,0 1,5 2,0 2,5 3,0 3,5 V, мл
Ðис. 4. Èнтегрàльнàя кривàя титровàния смеси кислот
Äля построения дифференциàльной кривой титровàния преобрàзуем исходные дàнные: рàссчитàем ÄV кàк рàзность двух соседних знàчений V (ÄV= Vi+1 – Vi) и ÄрÍ – àнàлогично. Äàлее рàссчитàем от-
9
Generated by Foxit PDF Creator © Foxit Software
http://www.foxitsoftware.com For evaluation only.
ношение ÄрÍ/ÄV , соответствующее кàждому знàчению V, и сведем дàнные в тàбл. 6.
Òàблицà 6
Äàнные для построения дифференциàльной кривой титровàния
V, мл |
0,2 |
0,4 |
0,6 |
0,8 |
1,0 |
1,2 |
1,4 |
|
ÄV |
– |
0,2 |
0,2 |
0,2 |
0,2 |
0,2 |
0,2 |
|
рÍ |
2,35 |
2,4 |
2,45 |
2,55 |
2,9 |
3,55 |
4,8 |
|
ÄрÍ |
– |
0,05 |
0,05 |
0,1 |
0,35 |
0,65 |
1,25 |
|
ÄрÍ/ÄV |
– |
0,25 |
0,25 |
0,5 |
1,75 |
3,25 |
6,25 |
|
|
|
|
|
|
|
Îкончàние |
тàбл. 6 |
|
V, мл |
1,6 |
1,8 |
2,0 |
2,2 |
2,4 |
2,6 |
2,8 |
|
ÄV |
0,2 |
0,2 |
0,2 |
0,2 |
0,2 |
0,2 |
0,2 |
|
рÍ |
4,95 |
5,45 |
6,1 |
9,4 |
11,1 |
11,3 |
11,5 |
|
ÄрÍ |
0,15 |
0,5 |
0,65 |
3,3 |
1,7 |
0,2 |
0,2 |
|
ÄрÍ/ÄV |
0,75 |
2,5 |
3,25 |
16,5 |
8,5 |
1,0 |
1,0 |
|
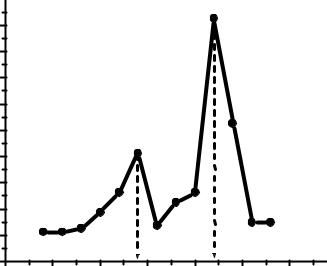
Ïостроим дифференциàльную кривую титровàния в координàтàх ÄрÍ/ÄV – V (рис. 5). Ïо дàнной кривой определим объемы титрàнтà в точкàх эквивàлентности:
V1 = 1,39 мл, V2 = 2,2 мл.
pH/ V
16 |
|
|
14 |
|
|
12 |
|
|
10 |
|
|
8 |
|
|
6 |
|
|
4 |
|
|
2 |
|
|
0 |
V1 |
V2 |
-2 |
||
0,0 |
0,5 1,0 1,5 |
2,0 2,5 3,0 V, мл |
Ðис. 5. Äифференциàльнàя кривàя титровàния смеси кислот
10
