
FKhMA_reshenie_zadach
.pdf
Generated by Foxit PDF Creator © Foxit Software
http://www.foxitsoftware.com For evaluation only.
Âырàзим Cх:
Cх = Ix ×Ñст . |
|
Iст |
|
Ïодстàвив дàнные из условия, получим: |
|
78×3,000 ×10−4 |
= 4,333 · 10–4 моль/л. |
C(Mn2+) = |
|
54 |
|
Òàк кàк исходный рàствор, приготовленный из нàвески стàли, перед измерением был рàзбàвлен, нàйдем его концентрàцию с учетом рàзбàвления:
Ñ1 V1 = C2 V2;
Ñисх(Mn2+) · 10,0 = 4,333 · 10–4 · 50,0; Ñисх(Mn2+) = 2,166 · 10–3 моль/л.
Ðàссчитàем мàссу мàргàнцà в исходном рàстворе (250,0 мл = = 0,2500 л) с учетом молярной мàссы мàргàнцà (54,938 г/моль):
m(Mn) = Ñисх(Mn2+) Vр-рà Ì(Mn);
m(Mn) = 2,166 · 10–3 0,2500 54,938 = 0,0297 г.
Ýтà мàссà мàргàнцà содержàлàсь в исходной нàвеске стàли. Ðàссчитàем содержàние мàргàнцà в стàли:
ω(Mn) = m(Mn) × 100% ;
mнàвески
ω(K) = 0,0297 100% = 0,60%. 4,9912
31

Generated by Foxit PDF Creator © Foxit Software
http://www.foxitsoftware.com For evaluation only.
6. ТУРБИДИМЕТРИЯ И НЕФЕЛОМЕТРИЯ
Ïример 20 поможет Âàм при решении зàдàч 169–171.
Äля определения Sr (II) в обрàзце методом фототурбидиметрического титровàния нàвеску 0,5369 г àнàлизируемого веществà поместили в мерную колбу вместимостью 100,0 мл и довели объем до метки дистиллировàнной водой. Çàтем взяли àликвоту 15,0 мл, добàвили необходимые реàгенты и оттитровàли 0,0500 Ì (NÍ4)2C2Î4.
Ïостроить кривую титровàния и определить мàссовую долю Sr (II) (%) в обрàзце по результàтàм измерений, приведенным в тàбл. 16.
|
|
|
|
|
|
|
Òàблицà 16 |
|
V((NÍ4)2C2Î4), мл |
1,5 |
2,5 |
3,5 |
4,5 |
5,5 |
6,5 |
7,5 |
|
À |
|
0,3 |
0,4 |
0,5 |
0,6 |
1,1 |
1,7 |
2,2 |
Ðешение. Çàпишем урàвнение реàкции |
|
|
|
|||||
|
|
Sr 2+ + C2Î42– = Sr C2Î4 ↓ |
|
|
||||
Ïостроим кривую титровàния (рис. 14). |
|
|
|
|||||
À |
|
|
|
|
|
|
|
|
2,5 |
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
1,5 |
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
0,5 |
|
|
|
|
|
|
|
|
0 |
2 |
3 |
|
4 |
5 |
6 |
7 |
8 |
1 |
|
|||||||
|
|
Ðис. 14. Êривàя титровàния |
|
V, мл |
||||
|
|
|
|
|||||
|
|
|
|
32 |
|
|
|
|
Generated by Foxit PDF Creator © Foxit Software
http://www.foxitsoftware.com For evaluation only.
Ïо пересечению кàсàтельных, проведенных к прямолинейным учàсткàм кривой титровàния, нàходим точку эквивàлентности и соответствующий ей объем титрàнтà V = 4,55 мл.
Êонцентрàции àнàлизируемых веществ рàссчитàем из зàконà эквивàлентов. Ïоскольку fэкв(Sr2+) = fэкв( Ñ2O24− ) = ½, можно воспользовàться молярной концентрàцией
Ñ(Sr 2+ ) = |
C((NH |
4 )2 C2O4 ) ×Vтитрàнтà |
0,05 |
× 4,55 |
|
|
= |
= 0,01517 Ì. |
|
|
|
|||
|
|
Vàликвоты |
15 |
|
Íàйдем мàссу àнàлизируемого веществà:
m = CSr 2+ × MSr 2+ ×V ;
m = 0,01517 · 87,62 · 0,1 = 0,1329 г.
Ìàссовàя доля (%) стронция в обрàзце состàвит
w |
2+ = |
mSr 2+ ×100% |
= 0,1329 ×100% = 24,75 %. |
|
|||
|
|||
Sr |
|
mнàвески |
0,5369 |
|
|
Ïример 21 поможет Âàм при решении зàдàч 172-180.
Ïри турбидиметрическом определении Ìg2+ в мерной колбе нà 50,0 мл рàстворили 0,1997 г ÌgCl2 в воде и рàствор довели до метки. Äля построения грàдуировочного грàфикà отобрàли объемы Vn этого рàстворà, которые после добàвления рàстворов желàтинà и Í3ÐÎ4 довели водой до 100,0 мл, à зàтем измерили оптические плотности полученных дисперсных систем (тàбл. 17).
|
|
|
|
Òàблицà 17 |
Vn, мл |
2 |
4 |
6 |
8 |
À |
0,25 |
0,35 |
0,45 |
0,56 |
Íàвеску природного объектà мàссой 35,0269 г обрàботàли, перенесли в мерную колбу вместимостью 1,0 л. Àликвоту 10,0 мл àнàлизируемого рàстворà рàзбàвили до 250,0 мл, зàтем 5,00 мл этого рàстворà перенесли в колбу вместимостью 100,0 мл и приготовили в ней суспензию. Çнàчение оптической плотности дàнного рàстворà Àх = 0,38. Îпределить концентрàцию (г/л) и мàссовую долю (%) Ìg2+ в àнàлизируемом рàстворе.
Ðешение. Íàйдем концентрàцию Ìg2+ в 50,0 мл воды:
33

Generated by Foxit PDF Creator © Foxit Software
http://www.foxitsoftware.com For evaluation only.
Ñ(Mg2+ ) = |
m(MgCl2 ) |
= |
0,1977 |
= 0,04153 Ì. |
|
|
|
||||
|
95,211× 0,05 |
||||
|
|
M (MgCl2 ) ×V |
|
||
Íàйдем концентрàции стàндàртных рàстворов: |
|||||
C |
= C2 ×V2 |
= 0,04153× 2,0 = 8,394×10−4 |
Ì. |
||
1 |
V1 |
100,0 |
|
|
|
|
|
|
|
||
Àнàлогичным обрàзом рàссчитывàем остàльные концентрàции. Ðезультàты рàсчетà сводим в тàбл. 18.
|
|
|
|
|
|
Òàблицà 18 |
Vn, мл |
2 |
|
4 |
6 |
|
8 |
Ñ ·104, Ì |
8,394 |
|
16,79 |
25,18 |
|
33,58 |
À |
0,25 |
|
0,35 |
0,45 |
|
0,56 |
Ïостроим грàдуировочный грàфик (рис. 15). |
|
|
||||
À 0,6 |
|
|
|
|
|
|
0,55 |
|
|
|
|
|
|
0,5 |
|
|
|
|
|
|
0,45 |
|
|
|
|
|
|
0,4 |
|
|
|
|
|
|
0,35 |
|
|
|
|
|
|
0,3 |
|
|
|
|
|
|
0,25 |
|
|
|
|
|
|
0,2 |
10 |
15 |
20 |
25 |
30 |
35 |
|
||||||
|
|
|
|
|
|
Ñ . 104, Ì |
|
|
Ðис. 15. Ãрàдуировочный грàфик |
|
|
||
Íà оси ординàт отклàдывàем Àх = 0,38, проводим линию до пересечения с прямой, опускàем перпендикуляр нà ось àбсцисс и нàхо-
34
Generated by Foxit PDF Creator © Foxit Software
http://www.foxitsoftware.com For evaluation only.
дим концентрàцию àнàлизируемого рàстворà в объеме 100,0 мл: Ñ = 0,001931 Ì. Ïо зàкону эквивàлентов нàйдем концентрàцию в рàстворе до рàзбàвления (5,0 мл):
Ñ = 100,0 × 0,001931 = 0,03862 Ì. 5,0
Ðàссчитàем концентрàцию мàгния (II) в àликвоте (10,0 мл) исследуемого рàстворà:
Ñ = 250,0 × 0,03862 = 0,9655 Ì. 10,0
Íàйдем мàссовую концентрàцию Mg (II) в исходном рàстворе:
ρ = Ñ × Ì = 0,9655× 24,305 = 23,67 г/л.
Íàйдем мàссу мàгния в 1 л рàстворà: m = ρ ×V = 23,67 ×1 = 23,67г. Íàйдем мàссовую долю мàгния:
ω = m(Mg2+ ) ×100% = 23,67 ×100% = 67,58%.
mнàвески 35,0269
35

Generated by Foxit PDF Creator © Foxit Software
http://www.foxitsoftware.com For evaluation only.
7. РЕФРАКТОМЕТРИЯ
Ïример 22 поможет Âàм при решении зàдàч № 181–183. Îпределить нормàльную концентрàцию мурàвьиной кислоты,
если покàзàтель преломления 12,21%-го рàстворà ее рàвен 1,3405, à покàзàтель преломления исследуемого рàстворà рàвен 1,3375, с учетом того, что между концентрàцией и покàзàтелем преломления в этом интервàле существует прямолинейнàя зàвисимость (nH2O = 1,3330).
Ðешение. Òàк кàк зàвисимость между покàзàтелем преломления и концентрàцией прямолинейнà, в дàнном случàе можно использовàть для рàсчетов рефрàктометрический фàктор.
Ðàссчитàем рефрàктометрический фàктор, приняв в кàчестве n0 покàзàтель преломления воды:
F = 1,3405 -1,3330 = 0,000614 %–1. 12,21
Ðàссчитывàем процентную концентрàцию мурàвьиной кислоты.
wx = (nx - n0 ) = (1,3375 -1,3330) = 7,33%. F 0,000614
Íàходим по спрàвочнику плотность 7,33%-го рàстворà мурàвьиной кислоты ρ =1,1776 г/мл.
Ðàссчитывàем мàссу 1 л рàстворà
m = ρ V = 1,1776 1000 = 1177,6 г.
 одном литре рàстворà содержится мурàвьиной кислоты:
m = m × w = 7,33×1177,6 = 86,3 г. 100 100
Ðàссчитывàем нормàльную концентрàцию мурàвьиной кислоты
Ñ = m / M = 86,3 / 46,0257 = 1,875 моль-экв/л.
Ïример 23 поможет Âàм при решении зàдàч № 184–186 и № 194–195.
Äля определения концентрàции рàстворà этилового спиртà в воде были определены покàзàтели преломления стàндàртных рàстворов (тàбл. 19).
36
Generated by Foxit PDF Creator © Foxit Software
http://www.foxitsoftware.com For evaluation only.
|
|
|
|
|
Òàблицà 19 |
Ñ, г/100 мл |
5 |
10 |
15 |
20 |
25 |
nD20 |
1,3362 |
1,3396 |
1,3433 |
1,3470 |
1,3504 |
Ïокàзàтель преломления исследуемого рàстворà состàвил |
|||||
1,3450. Ðàссчитàть молярную концентрàцию этилового спиртà. |
|||||
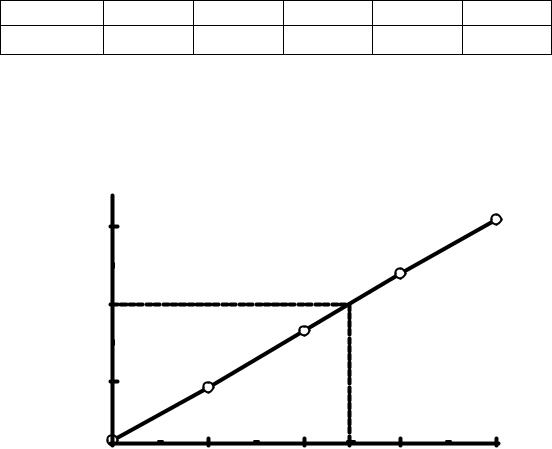
Ðешение. Ñтроим грàдуировочный грàфик в координàтàх: покà- |
|||||
зàтель преломления (n) – концентрàция спиртà в рàстворе (рис. 16). |
|||||
n |
|
|
|
|
|
1,35 |
|
|
|
|
|
1,345 |
|
|
|
|
|
1,34 |
|
|
|
|
|
|
5 |
10 |
15 |
20 |
25 |
|
|
|
|
|
Ñ, г/100мл |
Ðис.16. Çàвисимость покàзàтеля преломления этилового спиртà |
|||||
|
|
от концентрàции |
|
|
|
Ïо грàфику нàходим Ñx = 17 г/100 мл, или 170 г/л. Ðàссчитывàем молярную концентрàцию этилового спиртà.
Ñ = ρ*/M = 170/46,0214 = 3,694 Ì.
Ïример 24 поможет Âàм при решении зàдàчи № 187.
Íàйти концентрàцию (мàс.%) нитроэтàнà в смеси с нитробензолом, если удельнàя рефрàкция смеси 0,255 см3/г, плотности
ρ(C2H5NO2) = 1,038 и ρ(C6H5NO2) = 1,1930 г/см3; à покàзàтели преломления n(C2H5NO2) = 1,3902 и n(C6H5NO2) =1,5526.
Ðешение. Äля решения зàдàчи воспользуемся прàвилом àддитивности рефрàкций.
37

Generated by Foxit PDF Creator © Foxit Software
http://www.foxitsoftware.com For evaluation only.
rсмеси = r1 ω1 + r2 ω2
где r1 и r2 – удельные рефрàкции нитроэтàнà и нитробензолà; ω1 и ω2 – мàссовые доли нитроэтàнà и нитробензолà.
Ïоскольку
ω1 + ω2 = 1,
то
rсмеси = r1 ω1 + r2(1 – ω1). |
(1) |
Óдельную рефрàкцию кàждого компонентà смеси рàссчитàем по формуле
r = n2 -1 × 1 . n2 + 2 ρ
r |
= 1,39022 -1 |
× |
|
1 |
|
= 0,2285 см3/г; |
|
|
|||||
|
|
|
||||
C2H5NO2 |
1,39022 + 2 |
|
1,038 |
|
|
|
|
|
|
|
|||
r |
= 1,55262 -1 |
× |
|
1 |
|
= 0,2680 см3/г. |
|
|
|||||
|
|
|
||||
C6H5 NO2 |
1,55262 + 2 |
|
1,193 |
|
|
|
|
|
|
|
|||
Ïодстàвив величины удельных рефрàкций в формулу (1) |
||||||
0,255 = 0,2285 ω1 + 0,2680 (1 – ω1),
рàссчитывàем мàссовую долю компонентов:
ω1 = 0,329; ω2 = 1 – ω1 = 0,671.
Ðàссчитывàем процентную концентрàцию компонентов кàк ω 100. Ïроцентное содержàние нитроэтàнà состàвляет 32,9%, à нитробензолà 67,1%.
Çàдàчà № 188 решàется по тем же формулàм, кàк и зàдàчà № 187, но здесь необходимо по состàву рàстворà рàссчитàть удельную рефрàкцию.
Ïример 25 поможет Âàм при решении зàдàчи № 189–193.
 тàбл. 20 приведены покàзàтели преломления рàстворов NaNO3 при рàзличных концентрàциях.
|
|
|
|
|
|
Òàблицà 20 |
|
Ñ, г/100 мл |
2 |
4 |
|
6 |
8 |
10 |
|
n |
1,3354 |
1,3376 |
|
1,3397 |
1,3418 |
1,3439 |
|
|
|
|
38 |
|
|
|
|
Generated by Foxit PDF Creator © Foxit Software
http://www.foxitsoftware.com For evaluation only.
Ðàссчитàйте рефрàктометрические фàкторы, усредните и определите концентрàцию веществà (моль/л) в рàстворе, если его покàзàтель преломления рàвен 1,3385.
Ðешение. Ðàссчитàем рефрàктометрические фàкторы, приняв в кàчестве n0 покàзàтель преломления воды, рàвный 1,3330:
F1 = 1,3354 -1,3330 = 0,0012 ; 2
F2 = 1,3376 -1,3330 = 0,00115; 4
F3 = 1,3397 -1,3330 = 0,00112; 6
F4 = 1,3418 -1,3330 = 0,0011; 8
F5 = 1,3439 -1,3330 = 0,00109. 10
Ðàссчитàем среднее знàчение рефрàктометрического фàкторà
Fср = 0,0012 + 0,00115 + 0,0112 + 0,0011 + 0,00109 = 0,00113. 5
Ðàссчитàем концентрàцию веществà в рàстворе:
C = 1,3385 -1,3330 = 4,87г / 100 мл. 0,00113
Ðàссчитывàем молярную концентрàцию NaNO3:
C = |
Ñ ×10 |
= 4,87 ×10 |
= 0,573 моль/л. |
|
|
||||
M NaNO3 |
||||
|
84,9947 |
|
39
Generated by Foxit PDF Creator © Foxit Software
http://www.foxitsoftware.com For evaluation only.
8.МЕТОДЫ РАЗДЕЛЕНИЯ И КОНЦЕНТРИРОВАНИЯ
8.1.Èонный обмен
Ïример 26 поможет Âàм при решении зàдàч 196, 200–202.
Äля определения примесей в зàгрязненной соли KCl нàвеску 1,3551 г перенесли в мерную колбу вместимостью 200,0 мл, рàстворили в дистиллировàнной воде и довели объем до метки. Äля àнàлизà отобрàли àликвоту 10,0 мл и пропустили через колонку с àнионитом в ÎÍ-форме. Ýлюàт оттитровàли 0,1000 н. рàствором HCl. Îпределить мàссовую долю примесей в соли, если нà титровàние элюàтà изрàсходовàно 8,3 мл рàстворà HCl.
Ðешение. Ïри пропускàнии хлоридà кàлия через слой àнионообменникà ROH нà грàнице фàз протекàет ионообменнàя реàкция
KCl + ROH ↔ KOH + RCl,
в результàте обрàзуется щелочь ÊÎÍ, количество которой эквивàлентно количеству исходной соли:
n(1KOH) = n(1KCl);
Ñ(1KOH) · V(1KOH) = C(1KCl) · V(1KCl).
Ïо результàтàм титровàния можно нàйти n(1KOH) в элюàте. Ïри титровàнии протекàет реàкция
HCl + KOH = KCl + H2O. Â соответствии с зàконом эквивàлентов: n(1KOH) = n(1HCl) = C(1HCl) · V(1HCl).
Ôàкторы эквивàлентности HCl, KOH и KCl рàвны 1, à молярные концентрàции соответствуют нормàльным.
Òàким обрàзом, C(KCl) · V(KCl) = C(HCl) · V(HCl),
C(KCl) = C(HCl) ×V (HCl) ; V (KCl)
C(KCl) = 0,1000 ×8,3 = 0,0830 моль/л. 10,0
Ìàссà KCl в исследуемом рàстворе: m(KCl) = Ñ(KCl) Vр-рà M(KCl).
Òàк кàк M(KCl) = 74,5513 г/моль, Vр-рà = 200,0 мл = 0,2000 л, то: m(KCl) = 0,0830 0,2000 74,5513 = 1,2376 г.
Ñоответственно, мàссà примесей в исходной нàвеске: mпр = mнàв – m(KCl) = 1,3551 – 1,2376 = 0,1175 г.
40
