
- •1.Химическая технология, химическое производство, химико-технологический процесс. Основные технологические компоненты: сырье, целевой и побочный продукты, отходы.
- •Основными источниками водоснабжения промышленности предприятии служат грунтовые и поверхностные воды. К поверхностным водам относятся: реки, озера, искусственные водохранилища и каналы.
- •5.Энергетические ресурсы и энергоемкость химического производства. Пути эффективного использования энергетических ресурсов. Энерготехнологические схемы использования теплоты химических реакций.
- •9. Термодинамика и возможность химических превращений.
- •14.Аппаратурное оформление обратимых экзотермических реакций. Обоснование уст-ройства реакторов.
- •17.Гомогенные и гетерогенные химические процессы. Особенности гетерогенного химического процесса. Определение лимитирующей стадии.
- •18.Модели гетерогенных процессов в системах г (ж) - т: сжимающаяся сфера (горение беззольного угля); сжимающееся (невзаимодействующее) ядро (окисление колчедана).
- •19.Влияние условий (параметров) гетерогенного процесса «сжимающаяся сфера» на область протекания и скорость превращения. Интенсификация процесса.
- •20.Аппаратурное оформление процессов в системе г — т как фактор интенсификации процессов.
- •21. Процессы в системе жидкость твердое (ж-т)
- •22. Гетерогенный процесс г-ж. Режимы и пути интенсификации процесса
- •24. Промышленный катализ. Сущность каталитического действия. Виды катализа
- •29. Время контакта. Интенсивность катализатора. Выбор оптимальных условий для каталитических процессов. Интенсификация процесса.
- •31. Материальный баланс элементарного объема реактора в дифференциальной форме. Материальный баланс реакторов для стационарного и нестационарного режимов их работы.
- •32. Характеристические уравнения для моделей реакторов рис – п, рив и рис – н и их использование для расчета объемов реакторов.
- •33.Адиабатический, изотермический и политропический тепловые режимы для моделей реакторов рис - п, рив и рис – н
- •34.Каскады реакторов. Неидеальные режимы в реакторах. Динамическая характеристика реакторов.
- •35.Сравнение реакторов различного типа по интенсивности. Промышленные химические реакторы.
- •27.Требования к размерам зерен и пористости катализатора в зависимости от области протекания гетерогенно-каталитического процесса.
- •25. Технологические характеристики твердых катализаторов: активность, температура зажигания, селективность, структура, состав. Требования, предъявляемые к катализаторам.
- •26. Гетерогенно-каталитические процессы. Стадии и области протекания процессов. Макрокинетика гетерогенно-каталитических процессов.
- •28.Макрокинетика гетерогенно-каталитических процессов. Типы адсорбции. Скорость превращения на поверхности катализатора.
14.Аппаратурное оформление обратимых экзотермических реакций. Обоснование уст-ройства реакторов.
1-фильтр;2-Pl-сетки;
Трубчатый контактный аппарат
Аппарат для органического синтеза
инжектор;2-Регенератор;3-отпарив аппар;4-сепаратор;5-контактный аппарат со свежим напором
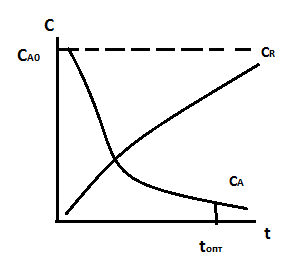
15.НЕОБРАТИМЫЕ ЭКЗО - И ЭНДОТЕРМИЧЕСКИЕ РЕАКЦИИ: А —> R ± Q. ВЛИЯНИЕ ТЕМПЕРАТУРЫ НА СТЕПЕНЬ ПРЕВРАЩЕНИЯ И СКОРОСТЬ РЕАКЦИИ. ГРАФИЧЕСКИЕ ЗАВИСИМОСТИ. ВЛИЯНИЕ КОН-ЦЕНТРАЦИИ И ДАВЛЕНИЯ.
Температура
является важнейшим фактором
производительности процессов. Если в
основе процессов лежат обратимые или
необратимые эндотермические реакции,
то производительность процессов
возрастает с ростом температуры во
всем мыслимом ее диапазоне. Температура
оказывает сильное влияние на скорость
хим реакций. A→R±Q(необр/эндо(экзо))
при С=const A→R+Q.Зависимость
скорости этой реакции от темпер выраж
формулой:r=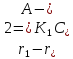
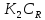 ;
;
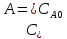 (1-
(1-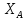 );
);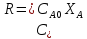 ;K=
;K=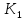 /
/ ;r=
;r=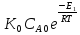 [1-
[1-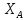 (1+
(1+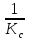 )],если
)],если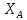 =сonst,
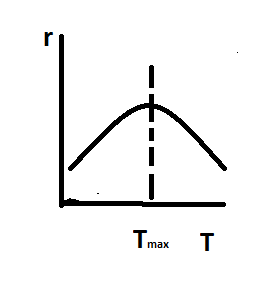
то с увелич темпер ∑rреакции
с одной строны должна возрастать,а с
другой уменьшаться. В некоторых случаях
возрастание темпер отражается на
степени превращения: 1)увеличение
потерь целевого продукта A
=сonst,
то с увелич темпер ∑rреакции
с одной строны должна возрастать,а с
другой уменьшаться. В некоторых случаях
возрастание темпер отражается на
степени превращения: 1)увеличение
потерь целевого продукта A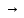 R±Q;2)снижение
прочности и хим стойкости материала
A
R±Q;2)снижение
прочности и хим стойкости материала
A R+Q;
3)
уменьшение степени превращения в
экзотермреакц.A↔R-Q; 1) 2)
3) -при малых
значениях X(
R+Q;
3)
уменьшение степени превращения в
экзотермреакц.A↔R-Q; 1) 2)
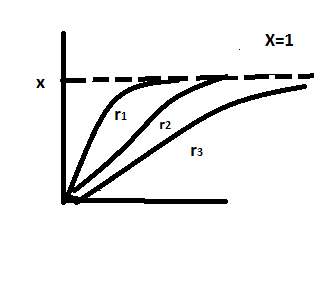
3) -при малых
значениях X(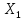 )характер
кривых совпадает; -при увелич темпер
величина Х резко возрастает; - при
возрастании Х влияние термодинамич
факторов начинает увеличив,а степень
зависит от типа реакции.Концентрацияоказыв
влияние на реакции всех типов
)характер
кривых совпадает; -при увелич темпер
величина Х резко возрастает; - при
возрастании Х влияние термодинамич
факторов начинает увеличив,а степень
зависит от типа реакции.Концентрацияоказыв
влияние на реакции всех типов 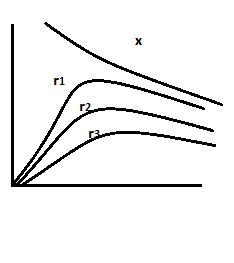
 для
необрат реакций
для
необрат реакций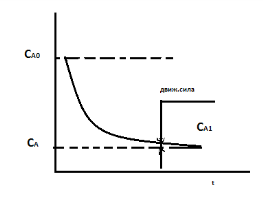 для простых обратим реакцДавление
оказывает
большое влияние на скорость
химреакц,особенно в тех случаях когда
они наход в газовой фазе или Ж+Г. Скорость
реакций выражr=-
для простых обратим реакцДавление
оказывает
большое влияние на скорость
химреакц,особенно в тех случаях когда
они наход в газовой фазе или Ж+Г. Скорость
реакций выражr=-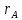 =K
=K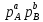 =k
=k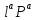 +
+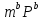 =
=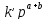 =
= ;
;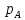 и
и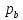 -
парциальные давления А и В. Р- общее
давление.
-
парциальные давления А и В. Р- общее
давление.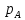 =lp;
=lp;
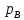 =mP
=mP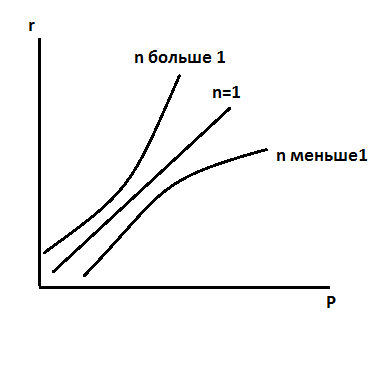
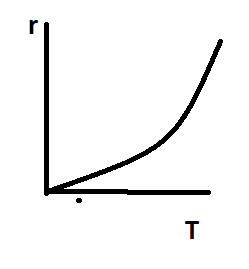
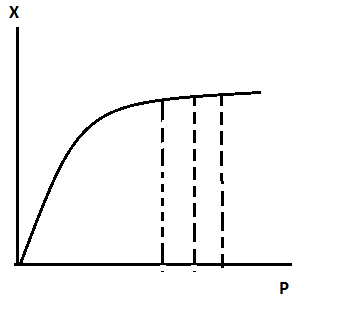
В
некоторых случаях увелич давления дает
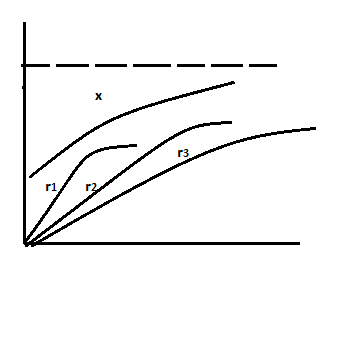
возможность вести реакц при Т превыш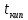 при Р=атмосф
при Р=атмосф
17.Гомогенные и гетерогенные химические процессы. Особенности гетерогенного химического процесса. Определение лимитирующей стадии.
Гомогенные процессы, т.е. процессы, протекающие в однородной среде (жидкие или газообразные смеси, не имеющие поверхностей раздела, отделяющих части системы друг от друга), сравнительно редко встречаются в промышленности. Чисто гомогенную систему получить трудно, так как любое вещество содержит примеси. Для многих промышленных процессов воздух считается гомогенной средой, а для процесса окисления аммиака тот же воздух из-за наличия в нем пыли, влаги считается гетерогенной средой. Исходное сырье всегда имеет примеси. Поэтому лишь условно можно принять за гомогенные те производственные процессы, которые протекают в газовой или жидкой фазе. В гомогенных системах реакции проходят быстрее, чем в гетерогенных.
Гетерогенные химические процессы основаны на реакциях между реагентами, находящимися в разных фазах. Химические реакции являются одной из стадий гетерогенного процесса и протекают после перемещения реагентов к поверхности раздела фаз, а в ряде случаев и через межфазную поверхность. Большинство промышленных химико-технологических процессов относится к гетерогенным. Огромное разнообразие гетерогенных процессов затрудняет их классификацию. В соответствии с принятой классификацией некаталитические гетерогенные процессы делят по фазовому состоянию реагентов на процессы в системах Г-Ж, Ж-Т, Г-Т и т.д. Механизм гетерогенных процессов сложнее гомогенных, так как взаимодействию реагентов, находящихся в разных фазах, предшествует их доставка к поверхности раздела фаз и массообмен между фазами. Поэтому скорость гетерогенных некаталитических процессов, как правило, меньше скорости гомогенных процессов. Многие гетерогенные процессы не связаны с химическими реакциями и основаны только на физико-химических явлениях. К таким процессам можно отнести испарение без изменения состава, конденсацию, перегонку, растворение, экстракцию и т.п. Химические гетерогенные процессы включают в качестве этапа химические реакции, которые идут в одной из фаз после перемещения туда реагентов или на поверхности раздела фаз.
Лимитирующую
стадию процесса обычно
определяют опытным путем.
Так, например, если суммарная скорость
процесса возрастает с повышением
температуры в соответствии с законом
Аррениуса (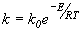 )
и температурный коэффициент
)
и температурный коэффициент ![]()
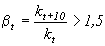 ,
то определяющей стадией является
реакция и процесс идет в кинетической
области. Если же суммарная скорость
процесса возрастает с увеличением
скоростей потоков реагирующих фаз или
с развитием межфазной поверхности, то
определяющей стадией служит массообмен
между фазами. В этом случае процесс
идет в диффузионной области.
,
то определяющей стадией является
реакция и процесс идет в кинетической
области. Если же суммарная скорость
процесса возрастает с увеличением
скоростей потоков реагирующих фаз или
с развитием межфазной поверхности, то
определяющей стадией служит массообмен
между фазами. В этом случае процесс
идет в диффузионной области.
Если интенсивности отдельных этапов соизмеримы, то говорят, что процесс идет в переходной области.
