
Глава 2. Строение, свойства и функции белков
Белки – высокомолекулярные биополимеры, построенные из остатков аминокислот. Молекулярная масса белков колеблется в пределах от 6000 до 2 000 000 Да. Этим удивительным по разнообразию полимерам присущи одни из наиболее важных и разносторонних клеточных функций. К биологическим функциям белков относятся: каталитическая (ферментативная) и регуляторная (способность регулировать скорость химических реакций в клетке и уровень метаболизма в целом организме), транспортная (транспорт веществ в организме и перенос их через биомембраны), структурная (в составе хромосом, цитоскелета, соединительных, мышечных, опорных тканей), рецепторная (взаимодействие рецепторных молекул с внеклеточными компонентами и инициирование специфического клеточного ответа). Кроме этого, белки выполняют защитные, запасные, токсические, сократительные и другие функции.
Кроме простых белков, в состав которых входят только аминокислоты, существуют сложные белки, которые помимо аминокислот могут содержать ионы металлов (металлопротеины), молекулы пигментов (хромопротеины), образовывать комплексы с другими молекулами (липо-, нуклео-, гликопротеины), а также ковалентно связывать неорганический фосфат (фосфопротеины).
Мономерными единицами белков являются двадцать -аминокислот. Все белки всех видов живых существ содержат одинаковый набор из двадцати аминокислот. Помимо них известно еще более 150 других аминокислот, которые встречаются в различных клетках и тканях в свободном или связанном состоянии, но никогда не обнаруживаются в составе белков. Большая их часть – это производные-аминокислот, содержащихся в белках, а также β-, γ- и δ-аминокислоты.
Химические и физико-химические свойства белков определяются качественным и количественным составом входящих в них аминокислот.
-Аминокислоты – это алифатические, ароматические или гетероциклические соединения, содержащие, по меньшей мере, одну аминогруппу и одну карбоксильную группу, общей формулой:

Аминокислоты различаются по строению, размерам и физико-химическим свойствам радикалов, присоединенных к -углеродному атому. Функциональные группы аминокислот определяют особенности свойств разных-аминокислот.
Аминокислоты растворимы в воде и в водных растворах, с различным значением рН существуют в форме биполярного иона (цвиттериона).
В зависимости от рН среды аминокислоты ведут себя либо как кислоты, либо как основания: в кислых растворах карбоксильная группа находится в неионизированной форме, а аминогруппа ионизирована; в щелочных растворах – наоборот. Кроме этих двух групп, в состав некоторых аминокислот входят и другие функциональные группы, способные к ионизации, например еще одна NH2- или СООН-группа, ОН-, SH-группы и др.
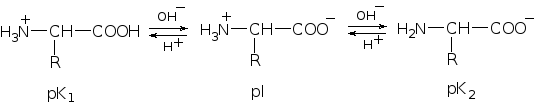
В табл. 2.1 приведены значения рK (рK = −lgK, где K – константа диссоциации) двух стадий диссоциации, которые достаточно сильно различаются. При значениях рK1 в растворе в эквимолярных концентрациях находится два вида ионов – NH3+СНRCOO− и NH3+СНRCOOН. При значениях рK2 в эквимолярных концентрациях присутствуют ионы NH3+СНRCOO и NH2СНRCOO−. Среднее арифметическое значений рK1 и рK2 называется изоэлектрической точкой (pI). Это значение рН, при котором положительные и отрицательные заряды аминокислоты полностью скомпенсированы и суммарный заряд молекулы равен нулю.
Аминокислоты различаются по их растворимости в воде. Это связано с их цвиттерионным характером, а также со способностью радикалов взаимодействовать с водой (гидратироваться). К гидрофильным относятся радикалы, содержащие катионные, анионные и полярные незаряженные функциональные группы. К гидрофобным – радикалы, содержащие алкильные или арильные группы.
Таблица 2.1
