
Примеры расчета кривых титрования
.doc
Пример расчета кривой титрования сильной кислоты сильным основанием.
Титруемое вещество - 0,2 н. HCl
Титрант - 0,2 н. NaOH
При титровании протекает реакция:
HCl + NaOH = NaCl + H2O
Соответственно, факторы эквивалентности обоих веществ равны 1, а молярные концентрации равны нормальным.
Предположим, что для титрования взяли 100,00 мл (V0) раствора HCl.
По закону эквивалентов рассчитаем объем раствора NaOH (Vт.э.), необходимый для оттитровывания HCl (для достижения т. э):
100,00 · 0,2 = Vт.э. · 0,2; Vт.э. = 100,00 мл.
В исходной точке рН раствора определяется сильной кислотой основанием HCl:
pH = – lg С0(HCl) = – lg0,2 = 0,70.
До точки эквивалентности рН раствора будет определяться концентрацией неоттитрованной сильной кислоты:
pH = – lg Сост(HCl)
При прибавлении 50% раствора NaOH (V(NaOH) = 0,5 · 100,00 = 50,00 мл.):
Сост(HCl)
=
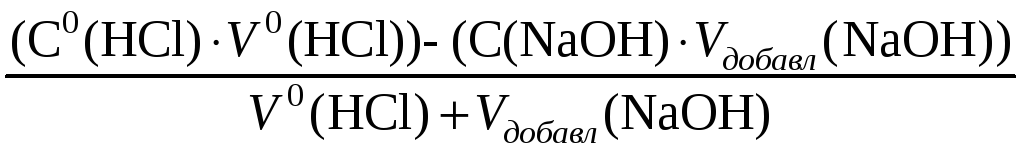 =
=
=
![]() =
6,66 · 10–2
моль/л.
=
6,66 · 10–2
моль/л.
pH = – lg Сост(HCl) = – lg(6,66 · 10–2) = 1,18.
При прибавлении 90% раствора NaOH (V(NaOH) = 0,9 · 100,00 = 90,00 мл.):
Сост(HCl)
=
![]() =
1,05 · 10–2
моль/л.
=
1,05 · 10–2
моль/л.
pH = – lg(1,05 · 10–2) = 1,99.
При прибавлении 99% раствора NaOH (V(NaOH) = 0,99 · 100,00 = 99,00 мл.):
Сост(HCl)
=
![]() =
1,005 · 10–3
моль/л.
=
1,005 · 10–3
моль/л.
pH = – lg(1,005 · 10–3) = 3,00.
При прибавлении 99,9% раствора NaOH (V(NaOH) = 0,999 · 100,00 = 99,90 мл.) – начало скачка титрования:
Сост(HCl)
=
![]() =
1,001 · 10–4
моль/л.
=
1,001 · 10–4
моль/л.
pH = – lg(1,001 · 10–4) = 4,00.
В точке эквивалентности рН раствора определяется автопротолизом воды,
рН
=
![]() рКW
= 7.
рКW
= 7.
После точки эквивалентности рН определяется избытком NaOH:
pH = 14 + lg Сизб(NaOH)
При прибавлении 100,1% раствора NaOH (V(NaOH) = 1,001 · 100,00 = 100,10 мл.):
Сизб(NaOH)
=
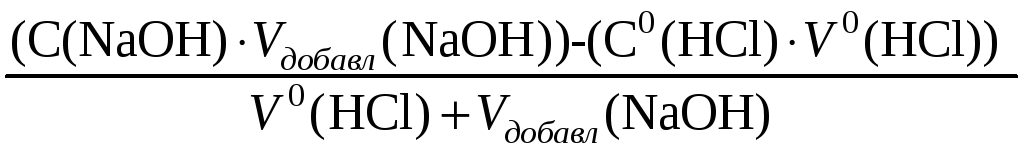 =
=
=
![]() =
9,995 · 10–5
моль/л.
=
9,995 · 10–5
моль/л.
pH = 14 + lg Сизб(NaOH) = 14 + lg(9,995 · 10–5) = 10,00
При прибавлении 101% раствора NaOH (V(NaOH) = 1,01 · 100,00 = 101,00 мл.):
Сизб(NaOH)
=
![]() =
9,95 · 10–4
моль/л.
=
9,95 · 10–4
моль/л.
pH = 14 + lg(9,95 · 10–4) = 11,00
При прибавлении 110% раствора NaOH (V(NaOH) = 1, 1 · 100,00 = 110,00 мл.):
Сизб(NaOH)
=
![]() =
9,52 · 10–3
моль/л.
=
9,52 · 10–3
моль/л.
pH = 14 + lg(9,52 · 10–3) = 11,98
Результаты вычислений сведем в таблицу и построим кривую титрования
-
Объем титранта, мл
рН
0
0,70
50,00
1,18
90,00
1,99
99,00
3,00
99,90
4,00
100,00
7,00
100,10
10,00
101,00
11,00
110,00
11,98
Скачок титрования определяется резким изменением рН от 4,00 до 10,00. Так как интервал перехода окраски индикатора должен укладываться на скачок титрования, то в данном случае можно использовать метиловый красный (интервал перехода 4,2–6,2; рТ=5,0), фенолфталеин (интервал перехода 8,2–10,0; рТ=9,0).
Пример расчета кривой титрования слабой кислоты сильным основанием.
Титруемое вещество - 0,1 н. CH3COOH
Титрант - 0,1 н. NaОН
При титровании протекает реакция:
CH3COOH + NaОН = CH3COONa + H2O
Соответственно, факторы эквивалентности обоих веществ равны 1, а молярные концентрации равны нормальным.
Предположим, что для титрования взяли 100,00 мл (V0) раствора CH3COOH.
По закону эквивалентов рассчитаем объем раствора NaОН (Vт.э.), необходимый для оттитровывания CH3COOH (для достижения т. э):
100,00 · 0,1 = Vт.э. · 0,1; Vт.э. = 100,00 мл.
В исходной точке рН раствора определяется слабой кислотой CH3COOH:
![]()
![]() =
2,88.
=
2,88.
До точки эквивалентности в растворе существует буферная смесь, состоящая из неоттитрованной уксусной кислоты и образовавшегося ацетата натрия. Расчет рН в этой области проводим по формуле:
рН
= рK(CH3COOH)
– lg![]()
При прибавлении 50% раствора NaОН (V(NaОН) = 0,5 · 100,00 = 50,00 мл.):
Сост(CH3COOH)
=
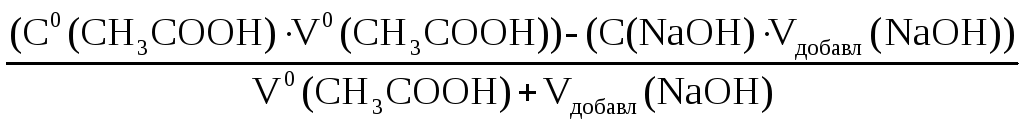 =
=
=
![]() =
3,333 · 10–2
моль/л.
=
3,333 · 10–2
моль/л.
С(CH3COONa)
=
![]() =
=
=
![]() =
3,333 · 10–2
моль/л.
=
3,333 · 10–2
моль/л.
рН
= 4,76
– lg![]() = 4,76.
= 4,76.
При прибавлении 90% раствора NaОН (V(NaОН) = 0,9 · 100,00 = 90,00 мл.):
Сост(CH3COOH)
=
![]() =
5,263 · 10–3
моль/л.
=
5,263 · 10–3
моль/л.
С(CH3COONa)
=
![]() =
4,737 · 10–2
моль/л.
=
4,737 · 10–2
моль/л.
рН
= 4,76
– lg![]() = 4,76 + 0,95 =
5,71.
= 4,76 + 0,95 =
5,71.
При прибавлении 99% раствора NaОН (V(NaОН) = 0,99 · 100,00 = 99,00 мл.):
Сост(CH3COOH)
=
![]() =
5,025 · 10–4
моль/л.
=
5,025 · 10–4
моль/л.
С(CH3COONa)
=
![]() =
4,975 · 10–2
моль/л.
=
4,975 · 10–2
моль/л.
рН
= 4,76
– lg![]() = 4,76 + 2,00 =
6,76.
= 4,76 + 2,00 =
6,76.
При прибавлении 99,9% раствора NaОН (V(NaОН) = 0,999 · 100,00 = 99,90 мл.):
Сост(CH3COOH)
=
![]() =
5,00 · 10–5
моль/л.
=
5,00 · 10–5
моль/л.
С(CH3COONa)
=
![]() =
4,997 · 10–2
моль/л.
=
4,997 · 10–2
моль/л.
рН
= 4,76
– lg![]() = 4,76 + 3,00 =
7,76.
= 4,76 + 3,00 =
7,76.
В точке эквивалентности рН раствора определяется гидролизом соли слабой кислоты:
![]()
С(CH3COONa)
=
![]() =
0,05 моль/л.
=
0,05 моль/л.
![]() =
8,73.
=
8,73.
После точки эквивалентности рН определяется избытком NaOH:
pH = 14 + lg Сизб(NaOH)
При прибавлении 100,1% раствора NaOH (V(NaOH) = 1,001 · 100,00 = 100,10 мл.):
Сизб(NaOH)
=
 =
=
=
![]() =
5,00
· 10–5
моль/л.
=
5,00
· 10–5
моль/л.
pH = 14 + lg (5,00 · 10–5)= 14 – 4,30 = 9,70.
При прибавлении 101% раствора NaOH (V(NaOH) = 1,01 · 100,00 = 101,00 мл.):
Сизб(NaOH)
=
![]() =
4,98 · 10–4
моль/л.
=
4,98 · 10–4
моль/л.
pH = 14 + lg (4,98 · 10–4)= 14 – 3,30 = 10,70.
При прибавлении 110% раствора NaOH (V(NaOH) = 1, 1 · 100,00 = 110,00 мл.):
Сизб(NaOH)
=
![]() =
4,76 · 10–3
моль/л.
=
4,76 · 10–3
моль/л.
pH = 14 + lg (4,76 · 10–3)= 14 – 2,32 = 11,68.
Результаты вычислений сведем в таблицу и построим кривую титрования
-
Объем титранта, мл
рН
0
2,88
50,00
4,76
90,00
5,71
99,00
6,76
99,90
7,76
100,00
8,73
100,10
9,70
101,00
10,70
110,00
11,68
Скачок титрования определяется резким изменением рН от 7,76 до 9,70. Так как интервал перехода окраски индикатора должен укладываться на скачок титрования, то в данном случае можно использовать тимоловый синий (интервал перехода 8,0–9,6), фенолфталеин (интервал перехода 8,2–10,0).
