
- •1. Равновесие в системе осадок – раствор
- •1.1. Расчет пр по растворимости
- •1.2. Расчет растворимости осадков в воде
- •1.3. Задачи на применение условия выпадения осадка
- •1.4. Расчет растворимости осадков в присутствии одноименных ионов
- •1.5. Расчет растворимости осадка в присутствии разноименных ионов (солевой эффект)
- •2. Кислотно-основное равновесие
- •2.1. Расчет рН раствора по известным равновесным
- •3. Окислительно-восстановительное равновесие
- •3.1. Расчет констант равновесия окислительно-восстановительных реакций
- •3.2. Расчет окислительно-восстановительного потенциала
- •4. Реакции комплексообразования
- •4.1. Расчет равновесных концентраций ионов
- •Контрольная работа № 2
- •5. Гравиметрический метод анализа
- •5.1. Расчет результатов гравиметрического анализа
- •0,0623 Г Ag содержится в 125 мл раствора;
- •5.2. Расчет количества осадителя
- •Рассчитаем массу 4 %-ного раствора Na2hpo4:
- •5.3. Расчет потерь осадка при промывании
- •6. Титриметрические методы анализа
- •6.1. Способы выражения концентраций
- •6.2. Определение фактора эквивалентности
- •6.3. Способы титрования
- •7. Расчеты результатов титриметрического анализа
- •7.1. Кислотно-основное титрование
- •7.2. Окислительно-восстановительное титрование
- •7.3. Комплексонометрическое титрование
- •8. Построение кривых титрования
- •8.1. Титрование сильных кислот и оснований
- •8.2. Титрование слабой кислоты сильным основанием
- •8.3. Окислительно-восстановительное титрование
- •Литература
- •220050. Минск, Свердлова, 13а. Лицензия лв № 276 от 15.04.03.
8. Построение кривых титрования
Кривые титрования помогают выбрать индикатор, оценить погрешность титрования, наглядно проследить за ходом титрования. В процессе кислотно-основного титрования изменяется рН раствора, поэтому кривые титрования строят в координатах рН – V или рН – f, где V – объем прибавляемого титранта (мл), f – степень оттитрованности (%).
Кривые окислительно-восстановительного титрования строят в координатах – потенциал системы (Е) от объема (V) прибавленного реагента.
При построении кривой титрования необходимо провести расчеты величины рН или Е для четырех этапов титрования:
до начала титрования (исключается в случае окислительно-восстановительного титрования);
до точки эквивалентности;
в точке эквивалентности;
после точки эквивалентности.
В расчетах с использованием закона эквивалентов применяется молярная концентрация эквивалента, которую необходимо перевести в молярную концентрацию перед подстановкой в формулы для расчета рН или Е. Формулы приведены в разделах 2 и 3.
8.1. Титрование сильных кислот и оснований
Пример 20 поможет Вам при решении задач № 142,144–146.
Пример 20. Построить кривую титрования NaOH [С(NaOH) = = 0,15 моль/л] раствором HCl c концентрацией 0,30 моль/л и подобрать индикаторы.
Решение. NaOH – сильное основание, а HCl – сильная кислота, поэтому в данном случае рассмотрим титрование сильного основания сильной кислотой.
Предположим, что для титрования взяли 100,00 мл (V0) раствора NaOH [С0 = С(NaOH) = 0,15 моль/л]. По закону эквивалентов рассчитаем объем раствора HCl (Vх), необходимый для оттитровывания NaOH (для достижения т. э):
100,00 · 0,15 = Vх · 0,30; Vх = 50,00 мл.
Для простоты расчета допустим, что объем раствора при титровании не изменяется.
1. Сильные кислоты и основания в водном растворе диссоциированы нацело, поэтому концентрацию Н+ или рН рассчитывают, исходя из концентрации NaOH по уравнению (3).
pH = 14 – pOH = 14+lg 0,15 = 13,18.
2. Значения рН раствора до точки эквивалентности будут определяться концентрацией неоттитрованного основания. При прибавлении 25,00 мл (50%) раствора HCl на титрование затрачено n(HCl) = = 25,00 · 10–3 · 0,30 = 7,50 · 10–3 моль. Неоттитрованное количество NaOH определяется вычитанием эквивалентного количества от исходного:
100,00 · 10–3 · 0,15 – 7,50 · 10–3 = 7,50 · 10–3 моль.
Отсюда С(NaOH) = 7,50 ∙ 10–3/100,00 ∙ 10–3 = 7,50 ∙ 10–2 моль/л, а
рН = 14 + lg 7,50 ∙ 10–2 = 12,88.
Объединяя поэтапный расчет и учитывая, что молярные концентрации эквивалентов в данном случае равны молярным концентрациям, получим в общем виде:
![]()
где Ст и С0 – исходные концентрации растворов титранта и титруемого вещества соответственно; V0 – исходный объем титруемого вещества; Vт – добавленный объем титранта.
Таким же образом рассчитываем рН при прибавлении 45,00 мл раствора HCl (45,00 : 50,00 · 100 = 90%):
![]()
Если добавлено 49,50 мл раствора HCl (49,50 : 50,00 · 100 = = 99%), то
![]()
После прибавления 49,95 мл раствора HCl (49,95 : 50,00 · 100 = = 99,9%):
![]()
3. В точке эквивалентности рН раствора определяется автопротолизом воды, рН = 1/2 рКW = 7.
За точкой эквивалентности рН определяется избытком НCl. При добавлении 50,05 мл раствора HCl (50,05 : 50,00 · 100 = 100,1 %):
![]()
а так как в точке эквивалентности количество моль титруемого вещества равно количеству моль титранта, то есть С0 ∙ V0= 100,00 · 0,15 = = 50,00 ∙ 0,30, то:
![]()
При добавлении 50,50 мл раствора HCl (50,50 : 50,00 · 100 = = 101 %):
![]()
При добавлении 55,00 мл раствора HCl (55,00 : 50,00 · 100 = = 110 %):
![]()
Результаты вычислений сведем в табл. 1, а по данным таблицы построим кривую титрования (рис. 1).
Таблица 1
|
Объем титранта VT, мл |
рН-определяющий компонент |
Формула для расчета рН |
рН |
|
0 |
NaOH |
14+lg С0(NaOH) |
13,18 |
|
25,00 |
NaOH |
|
12,88 |
|
45,00 |
NaOH |
-″- |
12,18 |
|
49,50 |
NaOH |
-″- |
11,18 |
|
49,95 |
NaOH |
-″- |
10,18 |
|
50,00 |
H2O |
рН = 1/2 рКW |
7,00 |
|
50,05 |
HCl |
|
3,82 |
|
50,50 |
HCl |
-″- |
2,82 |
|
55,00 |
HCl |
-″- |
1,82 |
Скачок титрования определяется резким изменением рН от 10,18 до 3,82 при недотитровывании или перетитровывании на 0,1% соответственно. Правило выбора индикаторов предусматривает, что интервал перехода окраски индикатора должен укладываться в скачок титрования. Используя справочные данные по интервалу перехода окраски индикаторов, предлагаем следующие наиболее часто применяемые индикаторы: метиловый оранжевый (интервал перехода 3,1–4,4; рТ=4,0), метиловый красный (интервал перехода 4,2–6,2; рТ=5,0), бромтимоловый синий (интервал перехода 6,0–7,6; рТ=7,0), фенолфталеин (интервал перехода 8,2–10,0; рТ=9,0).
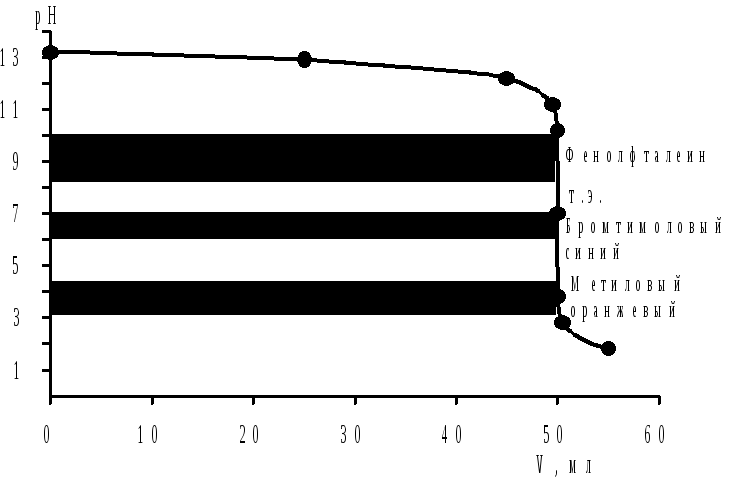
Рис. 1. Кривая титрования 0,15 моль/л раствора гидроксида натрия 0,30 моль/л раствором соляной кислоты
