
POVERKhNOSTNOE_NATYaZhENIE
.pdfФЕДЕРАЛЬНОЕ АГЕНТСТВО ПО ОБРАЗОВАНИЮ
Государственное образовательное учреждение высшего профессионального образования
УХТИНСКИЙ ГОСУДАРСТВЕННЫЙ ТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ
ПОВЕРХНОСТНОЕ НАТЯЖЕНИЕ. ПОВЕРХНОСТНО-АКТИВНЫЕ ВЕЩЕСТВА. АДСОРБЦИЯ
Методические указания к самостоятельной работе и лабораторному практикуму
по дисциплине «Коллоидная химия»
Ухта 2007
2
УДК 546(075) Ц 57
Цивилев, Р.П. Поверхностное натяжение. Поверхностно-активные вещества. Адсорбция [Текст]: метод. указания к самостоятельной работе и лабораторному практикуму по дисциплине «Коллоидная химия»/Р.П. Цивилев.
– Ухта: УГТУ, 2007. – 17 с.
Методические указания предназначены для самостоятельной работы студентов и выполнения лабораторной работы по дисциплине «Коллоидная химия».
Методические указания содержат теоретическую и экспериментальную части, контрольные вопросы и приложение. В теоретической части изложена краткая теория изучаемой темы. В экспериментальной части описана методика проведения исследований.
Содержание указаний соответствует рабочей учебной программе.
Методические указания рассмотрены и одобрены кафедрой химии от 16 апреля 2007 г., пр. № 8 и предложены для издания Советом специальности РЭНГМ от 18 апреля 2007 г., пр. № 7.
Рецензент Крупенский В.И., д.х.н., профессор.
Редактор Рудиченко Н.В.
В методических указаниях учтены предложения и замечания рецензента и редактора.
План 2007г., позиция 75.
Подписано в печать 10 мая 2007 г. Компьютерный набор.
Объем 17 с. Тираж 50 экз. Заказ № 210.
© Ухтинский государственный технический университет, 2007 169300, г. Ухта, ул. Первомайская,13.
Отдел оперативной полиграфии УГТУ. 169300, г. Ухта, ул. Октябрьская, 13.
3
1.ТЕОРЕТИЧЕСКАЯ ЧАСТЬ
1.1.Поверхностная энергия и поверхностное натяжение
Молекулы, находящиеся на границе раздела двух несмешивающихся фаз (жидкость − газ, жидкость − жидкость, жидкость − твердое тело, газ − твердое тело) имеют избыточную потенциальную энергии, которая называется
поверхностной энергией (ЕS).
Причина возникновения поверхностной энергии заключается в том, что состояние находящихся в поверхностном слое молекул иное по сравнению с молекулами, находящимися в объеме тела.
Молекулы в объеме тела равномерно окружены такими же молекулами, и поэтому их силовые поля полностью скомпенсированы. В отличие от них молекулы поверхностного слоя взаимодействуют как с молекулами одной фазы, так и с молекулами другой фазы, в результате чего равнодействующая молекулярных сил в поверхностном слое не равна нулю и направлена внутрь той фазы, с которой взаимодействие больше.
При постоянных температуре и давлении поверхностная энергия ЕS пропорциональна площади поверхности раздела фаз (S):
ЕS = σ×S |
(1) |
Величина σ называется коэффициентом поверхностного натяжения или просто поверхностным натяжением. Из уравнения (1) следует, что для индивидуального вещества поверхностное натяжение есть поверхностная энергия, приходящаяся на единицу площади поверхности (удельная поверхностная энергия):
σ = Еs / S |
(2) |
В системе интернациональной поверхностное натяжение измеряется в Дж/м2.
Так как согласно второму закону термодинамики запас свободной энергии любой системы самопроизвольно стремится к уменьшению, то для создания новой поверхности требуется совершение некоторой работы А, пропорциональной величине площади поверхности раздела фаз S.
Поэтому в общем случае поверхностное натяжение по физическому смыслу можно рассматривать как работу (А) образования единицы площади поверхности:
σ = A/S |
(3) |
Вдоль поверхности жидкости действует сила, стремящаяся сократить эту поверхность до минимума. Она направлена по касательной е поверхности, перпендикулярно линии, ограничивающей эту поверхность. Это сила поверхностного натяжения. Поэтому поверхностное натяжение можно
4
рассматривать как силу поверхностного натяжения (F), приходящуюся на единицу длины (l) периметра:
σ = F / l |
(4) |
Тогда поверхностное натяжение в СИ будет измеряться в Н/м2.
1.2. Факторы, от которых зависит поверхностное натяжение
Прежде всего, поверхностное натяжение зависит от природы жидкости и природы граничащего с ней тела: чем больше разность полярностей
жидкости и граничащего с ней тела, тем больше поверхностное натяжение.
Например, поверхностное натяжение жидкостей на границе с воздухом
при 25°С равно: гексана С6Н14 σ = 17,9×10-3 Дж/м2 или 17.9 мДж/м2; анилина
С6Н5NH2 σ = 43,2 мДж/ м2; воды σ = 71,95 мДж/ м2; ртути σ = 473,5 мДж/м2.
Отсюда следует, что поверхностное натяжение меньше у неполярных жидкостей (гексан), имеющих слабые межмолекулярные связи, и больше у полярных жидкостей (анилин, вода). Оно больше также у веществ, имеющих межмолекулярные водородные связи, например, у воды.
Наконец, самое большое поверхностное натяжение у веществ с металлическими и ионными связями между частицами: ртуть, расплавы металлов, оксидов, солей и т.д.
Величина поверхностного натяжения на границе раздела двух несмешивающихся жидкостей тоже зависит от разности их полярностей. Например, поверхностное натяжение воды на границе с бутиловым спиртом равно 1,6 мДж/м2, т.е. незначительно, а на границе с октаном С8Н18 равно 51,0 мДж/м2. Объясняется это тем, что молекулы бутилового спирта С4Н9ОН, так же как и молекулы воды, полярны. В то же время, молекулы С8Н18 неполярны. Поэтому разность полярностей на границе вода – бутиловый спирт меньше, чем на границе вода – октан. Следует отметить: чем меньше поверхностное натяжение на границе двух жидкостей, тем больше их взаимная растворимость. При полной взаимной растворимости жидкостей межфазное поверхностное натяжение равно нулю, так как исчезает поверхность раздела фаз.
У твердых тел по сравнению с жидкими межмолекулярные и межатомные взаимодействия больше. Соответственно на границе с воздухом они имеют и очень большое поверхностное натяжение: оксид алюминия Аl2O3 σ = 905 мДж/м2 (при 2123 K); MgO оксид магния σ = 1000 мДж/м2 (при 298 К): вольфрам W σ = 6814 мДж/м2 (при 298 К). Видно, что для более тугоплавких веществ значения удельной поверхностной энергии выше.
Поверхностное натяжение жидкостей зависит от температуры и давления. С повышением температуры поверхностное натяжение уменьшается. Объясняется это увеличением среднего расстояния между молекулами и уменьшением сил притяжения между молекулами. Для большинства неполярных жидкостей эта зависимость (на границе с газом) линейная. При
5
критической температуре поверхностное натяжение жидкости на границе с газом равно нулю (σ = 0), так как исчезает граница раздела между жидкостью и газом. Поверхностное натяжение на границе раздела нефть-вода с повышением температуры (при постоянном давлении) уменьшается. Поэтому с увеличением температуры возрастает их взаимная растворимость.
Повышение давления (при постоянной температуре) приводит к увеличению поверхностного натяжения на границе раздела вода - нефть.
Процесс изменения поверхностного натяжения в системе вода - нефть при одновременном увеличении температуры и давления сложен: поверхностное натяжение может, как уменьшаться, так и увеличиваться и даже оставаться постоянным.
1.3. Поверхностное натяжение растворов.
При растворении в жидкости каких либо веществ на поверхности раздела жидкость – газ появляются молекулы растворенного вещества. В результате изменяется разность полярностей жидкость – газ, поэтому происходит изменение поверхностного натяжения. При этом возможны три случая.
В первом случае, когда растворенное вещество менее полярно, чем растворитель, разность полярностей уменьшается, в результате понижается и поверхностное натяжение. Такие вещества называются поверхностно-
активными (ПАВ).
По отношению к воде ПАВами являются вещества, молекулы которых состоят из двух молекулярных групп − полярной и неполярной.
Полярные группы: –ОН, -СООН, -NН2, -SН, -О-, –СN, -СНО, -SО3Н и др.
Неполярная часть молекулы ПАВ состоит из углеводородного или ароматического радикалов: СnН2n+1, С6Н5. Полярные группы хорошо взаимодействуют с водой (гидратируются), а неполярные - хорошо взаимодействуют с неполярной средой (углеводородами, нефтью и т.д.) По этой причине молекулы ПАВ называют "дифильными"(склонные одновременно к взаимодействию с водой и углеводородной средой). Схематически такую "дифильную" молекулу (рис. 1 и 3) изображают в виде кружка (полярная группа) и волнистой линии или черточки (неполярный радикал).
При растворении такого ПАВ в воде его молекулы в поверхностном слое ориентируются полярной группой в сторону более полярной фазы – воды; неполярные группы ориентируются в сторону менее полярной фазы – в сторону газа. Поэтому разность полярностей на границе раздела фаз уменьшается и снижается поверхностное натяжение.
Примеры ПАВ: органические кислоты – СnН2n+1СООН, спирты −
СnН2n+1ОН, мыла, например, стеарат натрия − С17Н35СООNа, сульфокислоты и их соли, например, додецилсульфат натрия − С12Н25ОSО3Nа, соли аммониевых оснований и т.д.
Если полярная часть молекулы диссоциирует, то ПАВ называются
ионогенными, в противном случае – неионогенными.

6
Рис. 1. Схема молекулы ПАВ
.
Второй случай наблюдается, когда растворенное вещество более полярно, чем растворитель. Более полярные молекулы растворённого вещества появляются в поверхностном слое, поэтому разность полярностей жидкость – газ увеличивается, а поверхностное натяжение раствора возрастает. Такие вещества называются поверхностно-инактивными (ПИнАВ).
По отношению к воде к ним относятся все неорганические электролиты – кислоты, щелочи, соли. Из органических веществ к поверхностно – инактивным относятся лишь сильно ионизирующиеся, у которых неполярная группа очень небольшая, например, НСООН – муравьинная кислота, NН2СН2СООН – аминоуксусная кислота.
В третьем случае, когда в жидкости растворяется вещество, полярность которого близка к полярности растворителя, поверхностное натяжение остается практически неизменным. Такие вещества называются поверхностно –
нейтральными.
Например, смеси жидких углеводородов (С7Н16 − С8Н18), спиртов (СН3ОН − С2Н5ОН). В отношении воды к ним относятся сахара. Хотя следует заметить, что сахара могут быть ПАВ на границе водный раствор – твердая поверхность или другая жидкость.
1.4. Адсорбция на границе жидкость – газ
Взаимодействие между полярными молекулами растворителя и менее полярными молекулами ПАВ (например, Н2О – С3Н7СООН) всегда меньше взаимодействия между более полярными молекулами растворителя (Н2О-Н2 О). Поэтому молекулы ПАВ будут преимущественно выталкиваться из объема раствора на поверхность. В результате концентрация ПАВ в поверхностном слое становится больше, чем в объёме раствора.
Наоборот, взаимодействие между молекулами ПИнАВ и растворителя (например, Na2SO4 – H2O) всегда больше, чем между молекулами растворителя (Н2 О−Н2 О). Поэтому молекулы ПИнАВ стремятся перейти в объем раствора.
В результате концентрация ПИнАВ в поверхностном слое оказывается меньше, чем в объеме раствора.
7
Самопроизвольное изменение концентрации компонентов системы в поверхностном слое по сравнению с концентрацией в объемах фаз называется адсорбцией.
Адсорбция обозначается греческой буквой Г («гамма»), и измеряется в молях на квадратный метр (моль/м2). Связь между адсорбцией (избытком адсорбированного вещества − Г) в поверхностном слое, равновесной концентрацией растворенного вещества (с) и поверхностным натяжением (σ) на границе раствор – газ дается уравнением изотермы адсорбции Гиббса (1876):
Г = − |
с dσ |
, |
(5) |
|||
|
|
|
||||
RT dс |
||||||
|
|
|
||||
где с − равновесная концентрация ПАВ или ПИнАВ в растворе (моль/м3); R = 8,314 Дж/(моль×К) – универсальная газовая постоянная;
Т – температура (К).
Из уравнения Гиббса (5) видно, что при ddσс <0 (σ уменьшается с
увеличением концентрации – растворы ПАВ) адсорбция положительна Г>0 , т.е. концентрация растворённого вещества в поверхностном слое больше, чем в объеме раствора.
Если ddσс >0 (σ возрастает с увеличением концентрации – растворы
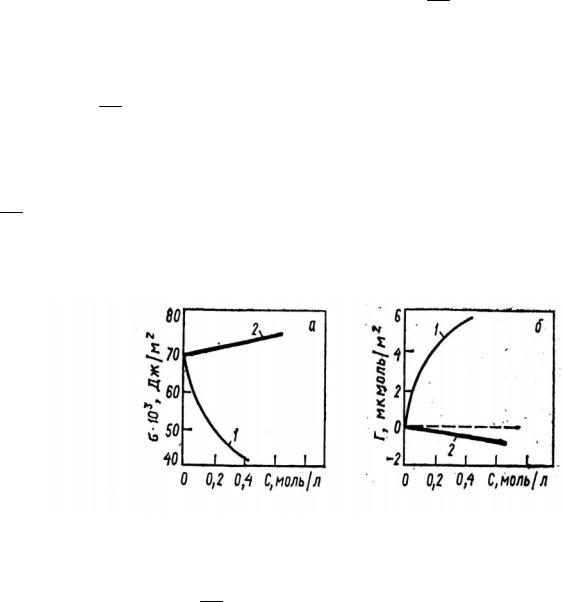
ПИнАВ), то адсорбция отрицательна Г<0 , т.е. концентрация ПИнАВ в поверхностном слое меньше, чем в объеме (см. рис. 2).
Наконец, если поверхностное натяжение не изменяется с концентрацией
dσ = 0, то концентрация растворенного вещества в поверхностном слое и в dс
объеме раствора одинакова; адсорбция равна нулю (Г=0, см. рис. 2б – пунктирная линия).
Рис.2. Изотермы поверхностного натяжения (а) и адсорбции (б) водных растворов: 1 - масляной кислоты С3Н7СООН; 2 - сульфата натрия Na2 SO4.
Величина g = – ddCσ называется поверхностной активностью. Она
служит мерой способности ПАВ уменьшать поверхностное натяжение.

8
Обычно g вычисляют для случая, когда концентрация ПАВ стремится к нулю g = (– ddσс )с→0. Для ПАВ g > 0, для ПИнАВ g < 0, для поверхностнонейтральных веществ g = 0.
1.5. Влияние на адсорбцию строения и размера молекул ПАВ
При адсорбции ПАВ из водного раствора главную роль играют неполярные группы – углеводородные радикалы. Именно они являются носителями поверхностной активности.
Углеводородные радикалы ПАВ выталкиваются из воды на поверхность (рис. 3), и адсорбция ПАВ положительна (Г>0). Чем длиннее углеводородный радикал, тем сильнее он выталкивается из воды на поверхность, тем выше поверхностная активность ПАВ. Поэтому в гомологическом ряду поверхностно-активных веществ "g" возрастает по мере увеличения длины цепи
в3 - 3,5 раза на одну группу СН2 (Правило Траубе).
Вобщем случае поверхностная активность зависит от соотношения неполярных и полярных групп в молекуле ПАВ.
Для молекул с большим числом полярных групп значения "g" невелики и
внекоторых случаях близки к нулю (например, сахароза С12Н22О11).
От соотношения полярных и неполярных групп в молекуле ПАВ зависит и его способность растворяться в воде или нефти. Например, используемые в нефтяной промышленности неионогенные ПАВ оксиэтилированные алкилфенолы могут быть представлены в виде общей формулы:
СnН2n+1С6Н4О – (СН2 – СН2 – О)m–Н (n=8 – 10).
Полярной здесь является оксиэтиленовая группа (СН2 – СН2 – О).
При m=4 получается промышленный ПАВ (ОП-4), плохо растворимый в воде, но растворимый в керосине. Препараты ОП-7 и ОП-10, в молекулах которых на радикал алкилфенола (СnН2n+1С6Н4О – ) приходится в среднем соответственно 7 и 10 групп окиси этилена хорошо растворяются в воде, но мало растворимы в керосине и маслах.
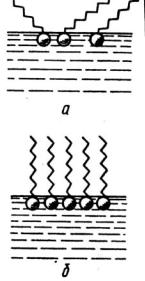
На рисунке 3 показана схема адсорбционного слоя.
При небольшой концентрации ПАВ молекулы располагаются горизонтально или под углом к поверхности жидкости (рис. 3а). При этом полярные группы остаются в воде, а углеводородные радикалы находятся в газовой фазе (правило уравнивания полярностей Ребиндера).
С увеличением концентрации число молекул ПАВ в поверхностном слое возрастает. Когда вся поверхность воды покроется молекулами ПАВ, образуется насыщенный адсорбционный слой с предельной адсорбцией Г∞ (рис.3б). Значение σ при этом приближается к значению, характерному для чистого жидкого ПАВ на границе с воздухом.
9
Рис.3. Схема адсорбционного слоя: а – ненасыщенный Г< Г∞; б – насыщенный Г = Г∞
По величине Г∞ можно рассчитать размеры молекул ПАВ: площадь поперечного сечения полярной группы (см. рис. 1)
S |
0 = |
1 |
|
|
(6); |
||
N A Г∞ |
|||||||
|
|
|
|
||||
и длину молекулы, которая равна толщина адсорбционного слоя |
|
||||||
δ |
= |
Г∞М |
|
(7) |
|||
|
|||||||
|
|
|
ρ |
|
|||
здесь NА = 6,02×10 23 моль -1 (число Авогадро), М – молярная масса ПАВ, ρ -плотность ПАВ.
Экспериментально установлено, что для всех членов гомологического ряда предельная адсорбция (Г∞) постоянна. Тогда из уравнения (6) следует, что величина S0 для членов одного гомологического ряда тоже является постоянной. Действительно, по данным полученным Ленгмюром, для гомологического ряда жирных кислот S0 = 0,2 нм2 , для спиртов S0 = 0,25 нм2
Таким способом впервые в истории химии были определены размеры молекул. На межфазной поверхности молекулы ПАВ тоже ориентируются в соответствии с правилом уравнивания полярностей Ребиндера: полярная группа находится (или примыкает) в более полярной фазе; неполярная – в менее полярной (см. рис. 4).
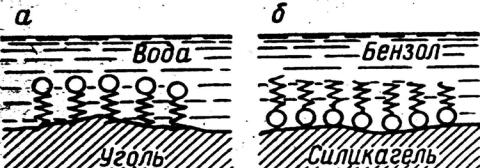
10
Рис.4. Ориентация молекул ПАВ на границе твердое тело - раствор: а) неполярный адсорбент (уголь) – полярный растворитель (вода);
б) полярный адсорбент (силикагель) – неполярный растворитель (бензол).
1.6. Уравнения Шишковского и Ленгмюра
Б.А. Шишковский (1909) опытным путём вывел зависимость поверхностного натяжения растворов (σ) от концентрации ПАВ:
σ = σо − a ln( 1 + b с ), |
(8) |
где σо − поверхностное натяжение воды (без ПАВ); с – концентрация ПАВ;
a и b - константы, характерные для данного ПАВ.
Дифференцируя уравнение (8), получим:
dσ |
= − |
ab |
. |
(9) |
dc |
|
|||
|
1 +bc |
|
||
Откуда при с→ 0 поверхностная активность равна:
g = (– |
dσ |
)с→0 = a × b. |
(10) |
|
|||
|
dс |
|
|
Если подставить (9) в уравнение Гиббса (5), то уравнение изотермы адсорбции примет следующий вид:
Г = |
a bс |
= Г∞ |
|
|
bс |
. |
(11) |
|||
|
|
|
|
|
|
|||||
RT 1 +bс |
1 |
+bс |
||||||||
|
|
|
|
|||||||
Анализ уравнения (11) показывает, что при сравнительно высоких концентрациях раствора, когда bc>>1, адсорбция стремится к предельному значению, отвечающему полному заполнению поверхности раздела фаз молекулами ПАВ:
Г∞ = |
a |
(12) |
|
RT |
|||
|
|
