
- •Должность, ученая степень, ученое звание, воинское звание, инициал имени, фамилия автора (авторов)
- •(Номер по тематическому плану изучения дисциплины) по дисциплине: «Биохимия»
- •(Наименование учебной дисциплины)
- •Сильная кислота гидрофосфат соль сильной кислоты дигидрофосфат
- •Щелочь дигидрофосфат гидрофосфат вода
- •Удалении из организма ионов водорода;
- •Реабсорбции бикарбоната из канальцевой жидкости;
- •Синтезе бикарбоната при его недостатке и удалении – при избытке.
- •Нарушения кислотно-основного состояния
- •Водно-электролитный обмен
- •Лабораторные показатели водно-электролитного обмена.
ВОЕННО-МЕДИЦИНСКАЯ АКАДЕМИЯ
Экз №__
Кафедра клинической биохимии и лабораторной диагностики
«УТВЕРЖДАЮ»
ИО начальника кафедры
клинической биохимии и
лабораторной диагностики
полковник медицинской службы
В.ПАСТУШЕНКОВ
«___» _____________ 2008 г.
доцент кафедры клинической биохимии и лабораторной диагностики
доктор медицинских наук В.АНТОНОВ
_____________________________________________________________________
Должность, ученая степень, ученое звание, воинское звание, инициал имени, фамилия автора (авторов)
ЛЕКЦИЯ № 29
_________________________________________
(Номер по тематическому плану изучения дисциплины) по дисциплине: «Биохимия»
___________________________________________________________
(Наименование учебной дисциплины)
на тему: «Биохимия кислотно-основного состояния и
водноэлектролитногообмена»
________________________________________________
(наименование темы занятий по тематическому плану изучения дисциплины)
с курсантами и студентами 2 курса факультетов подготовки врачей
(военно-медицинских специалистов иностранных армий)
Обсуждена и одобрена на заседании кафедры
«____» ____________ 200___ г.
Протокол №______
Уточнено (дополнено):
«____» ____________ 200___ г.
_____________________________________
(воинское звание, подпись, инициал имени, фамилия)
Лекция на тему: «Биохимия кислотно-основного состояния и
водноэлектролитногообмена»
Учебные групп: курсанты и слушатели II курса ФПВ
Цель лекции: Рассмотреть биохимические закономерности функционирования систем кислотно-основного состояния (КОС) и водно-электролитного обмена (ВЭО), показатели используемые в лабораторной диагностике их нарушений.
Время лекции: 2 часа
План лекции.
Введение.
Кислотно-основное состояние
- Буферные системы.
- Активность дыхательной системы и кислотно-основное состояние
- Функциональная активность почек и кислотно-основное состояние
.Нарушения кислотно-основного состояния
.Водно-электролитный обмен
.Лабораторные показатели водно-электролитного обмена.
Заключение
Введение
Высокоорганизованные организмы, включая и человека, имеют внутреннюю среду, которая сформировалась в процессе эволюционного развития и является необходимым структурным компонентом многоклеточного организма. Необходимость формирования внутренней среды в эволюции была обусловлена рядом обстоятельств, среди которых немаловажными стали изменения среды существования (внешней среды), несопоставимые с жизнедеятельностью клетки и интеграция клеток в многоклеточный организм. Внутреннюю среду организма можно разделить на «внутреннюю атмосферу» и «внутренний океан». «Внутренней атмосферой» называют объем воздуха, находящийся в альвеолах и мелких бронхиолах. Остальной воздух, который находится вне этого объема и контактирует с внешней атмосферой, определяют как воздух «мертвого пространства». «Мертвое пространство» выполняет функцию барьера между внешней атмосферой и воздухом альвеолярного пространства.
«Внутренний океан» включает в себя кровь, лимфу, межклеточную и межтканевую жидкости, ликвор, эндолимфу и другие специализированные водные растворы. Граница между внутренними растворами и внешней средой проходит по кожному покрову и слизистым оболочкам.
Внутреннюю среду характеризует относительно небольшой диапазон изменений количества газов и воды, органических и неорганических веществ, несмотря на то, что клетки утратившие возможность непосредственного получения пластического и трофического материала из внешней среды и удаления в нее продуктов своей жизнедеятельности, постоянно совершают обмен с внутренней средой организма. Таким образом, назначение внутренней среды состоит в создании оптимальных и очень стабильных условий для деятельности каждой клетки организма.
Кислотно-основное состояние
Постоянная концентрация ионов водорода во внутренней среде организма является одним из её важнейших физико-химических и физиологических свойств. Активность биохимических, физико-химических и физиологических процессов, составляющих функционально единую систему поддержания стабильной концентрации ионов водорода, определяют как кислотно-основное состояние (КОС).
Правильное течение процессов обмена веществ возможно при незначительных колебаниях концентрации ионов водорода в тканях. В процессе метаболизма в результате превращений веществ в течение 24 ч образуется около 15000 ммоль угольной кислоты (H2CO3) и до 1 ммоль/кг массы тела нелетучих кислот. Основным источником нелетучих кислот являются серосодержащие белки пищи и распадающиеся белки клеток, продукты неполного окисления жирных кислот и углеводов (кетокислоты, молочная кислота и др.). Значения рН, совместимые с жизнью, находятся в пределах от 6.80 до 7.80 единиц (160 нмоль/л - 16 нмоль/л). Состоянию нормы соответствует еще более узкий диапазон значений рН. В частности для крови он составляет 7.37–7.44, со средним значением 7.40 (40 нмоль/л). Образующиеся в результате метаболизма кислоты, а при их диссоциации ионы водорода и основания, в норме не должны изменять величину рН за пределы диапазона физиологической нормы. В организме физиологически приемлемый оптимум значений концентрации Н поддерживается благодаря сбалансированному уровню активности функционально единой системы, включающей биохимические, буферные и физиологические процессы.
Реакция организма на образование физиологически избыточных количеств СО2 и H включает:
1) химичеcкое действие вне- и внутриклеточных буферов;
2) изменение интенсивности:
- внутриклеточных биохимических процессов образования H+ и СО2;
- альвеолярной вентиляции, контролирующей уровень PСО2;
- почечной экскреции Н, реабсорбции и синтеза бикарбоната.
При нормальных условиях буферные, биохимические и физиологические процессы регуляции поддерживают устойчивое равновесие между образованием и удалением Н и СО2, что обеспечивает в крови значение рН – 7.4 – 6.8 (рис.1).
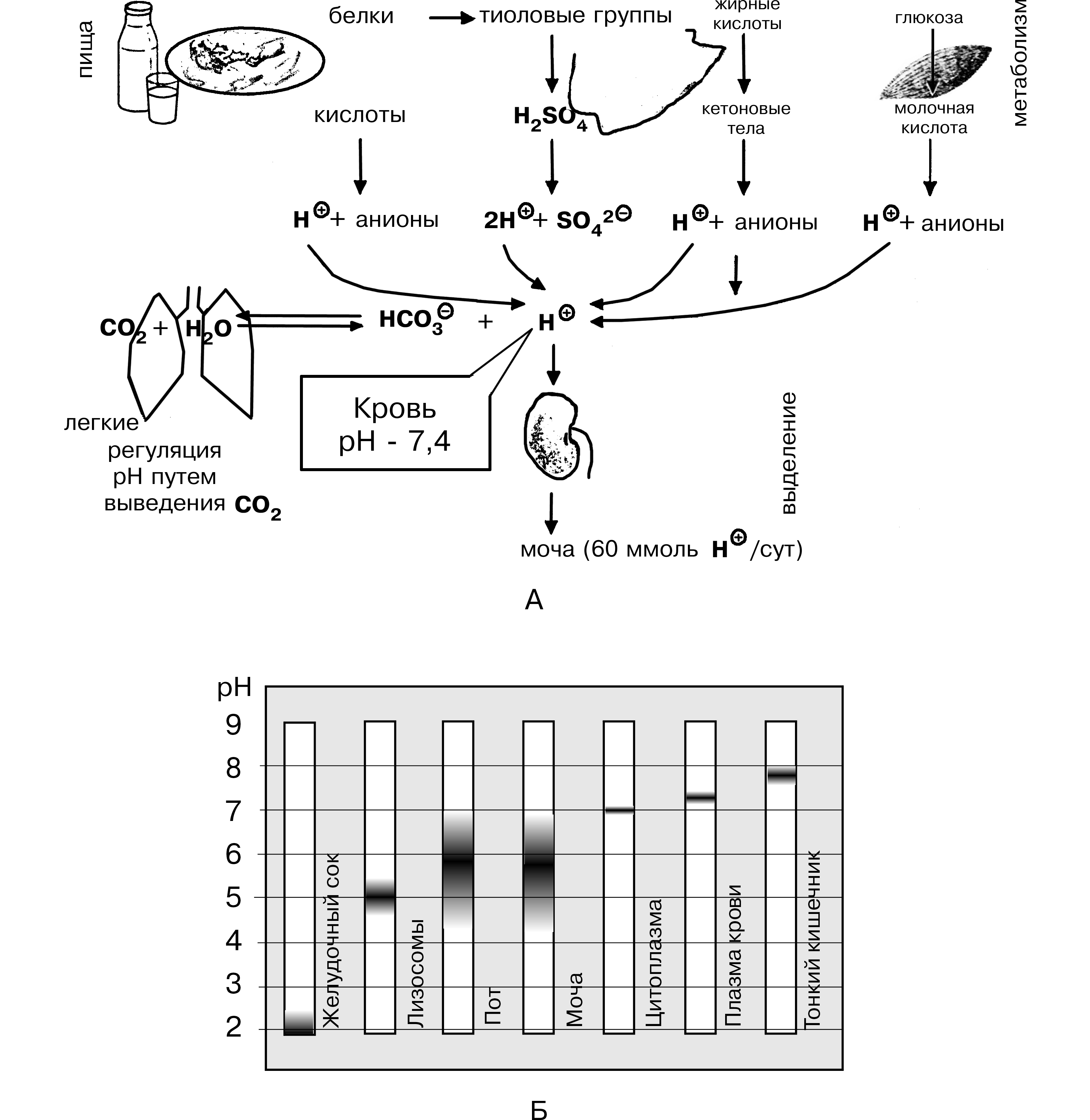
Рис.1. А – продукция ионов водорода в организме человека (pH крови отражает уровень равновесия между процессами продукции и удаления ионов водорода). Б – pH биологических сред организма в сравнении с плазмой крови
БУФЕРНЫЕ СИСТЕМЫ
Соединения, предотвращающие резкое изменение концентрации ионов водорода, называются буферами. К ним относятся кислотно-основные пары, образованные слабыми кислотами (НА) и их кислотными остатками (А), которые обладают основными свойствами, так как способны связывать ионы водорода:
Н А НА
Основными буферными системами организма являются - бикарбонатная, гидрофосфатная и белковая, включающая гемоглобиновый буфер(рис.2).
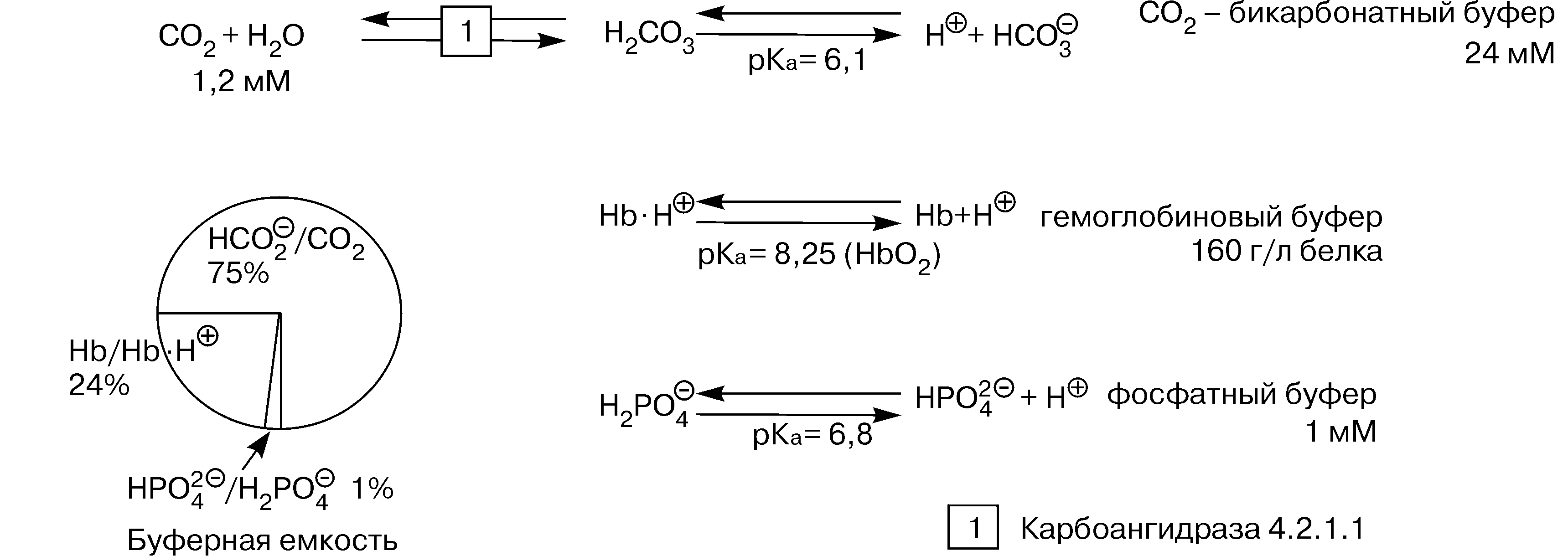
Рис.2. Буферные системы плазмы крови
Другие буферные системы организма менее важны в количественном отношении. Буферные системы в организме присутствуют как вне, так и внутри клеток. В буферной системе взаимосвязь между компонентами – ионами водорода, основными остатками и молекулами кислоты подчиняется закону действующих масс:
Ка [Н] А]/НА],
где Ка – константа диссоциации кислоты, её значение соответствует молярной концентрации кислоты, при которой половина всех молекул вещества находится в ионизированной форме.
Преобразуя это уравнение относительно концентрации иона водорода получаем:
[Н]=Ка[НА]/ А],
Логарифмируя значения величин уравнения, имеем:
pH= рКа + lg ([A]/[НА]),
где рН – отрицательный десятичный логарифм молярной концентрации ионов водорода(-lg [H]);
рКа – отрицательный десятичный логарифм значения константы диссоциации кислоты – (lg [Ка]).
Полученное выражение – это уравнение Гендерсона – Гассельбаха. Оно позволяет рассчитать рН буферной системы по значениям рКа и отношению молярных концентраций основания и кислоты, или же, напротив, определить величину молярного отношения основания и кислоты, когда известны значения рН и рКа.
Внеклеточные буферы
Внеклеточные буферы в течение 1–2 с реагируют на изменения рН при нагрузке как кислотами, так и щелочами. Внеклеточные буферы способны компенсировать более 50% органических и практически всех неорганических кислот, образующихся при сбалансированном метаболизме. Более половины буферной емкости внеклеточных буферов приходится на бикарбонатную буферную систему. Остальная часть внеклеточной буферной емкости распределяется в основном между гидрофосфатной, белковой и другими буферными системами.
ФОСФАТНАЯ БУФЕРНАЯ СИСТЕМА
(H2PO4-/ HPO42-)
Фосфатная буферная система в крови не играет столь значимой роли, как бикарбонатная, однако ее доля в буферной емкости плазмы крови все же достаточно значительна. Компоненты фосфатной буферной системы реагируют с кислыми или основными эквивалентами, что ситуационно определяется характером воздействия на забуференную среду.
Действие фосфатной буферной системы при нагрузке среды кислыми продуктами проявляется увеличением содержания дигидрофосфата (H2PO4-) и снижением концентрации гидрофосфата (HPO42-).
Например:
Н2SO4 + 2Na2HPO4 Na2SO4 + 2NaH2PO4
