
Система фибринолиза
Это ферментная система, действие которой заключается в деградации (лизисе) фибрина, реканализации сосудов и восстановлении кровотока. Она препятствует образованию диссеминированного тромбоза и активизируется одновременно с системой свёртывания и системой антикоагулянтов,
Система фмбринолиза крайне многофакторна, но основных компонентов в ней три:
1. Плазминоген, преобразующийся при активации в плазмин.
2. Активаторы плазминогена:
- фактор XIIа в комплексе с плазменным калликреином и высокомолекулярным кининогеном (ВМК);
тканевый плазминогеновый активатор (ТПА), вырабатывающися в эндотелии; среди подобных ему можно назвать урокиназу, продуцируемую почечной тканью.
Активаторы плазминогена содержатся в том числе во всех форменных элементах крови, откуда освобождаются при их разрушении.
3. Ингибиторы фибринолиза:
PAI-1 (plasminogen activator inhibitor – 1);
- α2-антиплазмин.
Существует два пути активации плазминогена – внешний и внутренний (рис.5).
ПЛАЗМИНОГЕН

ВНУТРЕННИЙ ПУТЬ ВНЕШНИЙ ПУТЬ
ТПА





PAI-1 PAI+ТПА
Активаторы форменных
э Урокиназа
 лементов
крови
лементов
крови
ПЛАЗМИН α2-Антиплазмин α2-макроглобулин

Рис. 5. Система фибринолиза
Активация по внешнему пути осуществляется за счёт ТПА, поступаюшего из эндотелия сосудов. Секреция ТПА идёт постоянно и усиливается под действием самых различных гуморальных или физических стресорных факторов (адреналин, вазопресин, глюкокортикоидные гормоны, никотинова7я кислота, физическая нагрузка, различные травмы и пр.). Этот активатор обладает выраженным сродством как к фибрину так и плазминогену. Связываясь на поверхности фибрина, или внутри сгустка эти белки образуют тройной комплекс (плазминоген-фибрин-ТПА). Таким образом разрушение фибрина происходит как на поверхности сгустка, так и внутри его. Активатор урокиназного типа, в отличие от ТПА, не связывается с фибрином, но фиксируется на поверхности различных клеток, имеющих рецепторы для плазминогена, что ведёт к образованию активного плазмина на эндотелии и различных форменных элементах крови, участвующих в формировании тромба.
Внутренний путь активации фибринолиза аналогичен внутреннему пути в системе свёртывания, то есть, это контактная поверхность, приводящая к образованию фактора XIIa и калликреина. И тот и другой факторы переводят плазминоген в плазмин. Последний в свою очередь по механизму положительной обратной связи ускоряет активацию фактора Хагемана и прекалликреина, что приводит к значительному ускорению как самого фибринолиза, так и системы свёртывания. Таким образом поддерживается необходимый баланс между образованием и лизисом фибрина.
Как правило образование плазмина из плазминогена происходит in situ, внутри фибринового сгустка. Этот феномен отмечается вследствие того, что плазминоген и его активатор – ТПА обладают повышенным сродством к фибрину, связываются с ним ещё в период образования фибриновой сетки и оказываются внутри сформировавшегося сгустка. Именно там и происходит активация плазминогена и расщепление тромба.
Под влиянием плазмина расщепляется как фибрин, так и фибриноген. Фибриноген распадается на высокомолекулярные фрагменты. Вначале образуется фрагмент X. Затем идёт формирование фрагмента Y за счёт освобождения из фрагмента Х фрагмента D. Фрагмент Y в свою очередь распадается на фрагмент Е и второй фрагмент D. Фрагменты X и Y относятся к ранним продуктам деградации фибриногена (ПДФ) (рис.4). Они образуются на ранних этапах фибринолиза и отличаются достаточно большой молекулярной массой. При их дальнейшем протеолизе плазмином появляются фрагменты E и D, обладающие меньшей массой и не поддающиеся дальнейшему фибринолизу. При гидролизе фибрина образуются несколько отличные сложные фрагменты, основными из которых являются D-димеры. Считается, что D-димеры - это участки молекулы фибриногена связанные прочной ковалентной глутамил-лизиновой связью, образованной в момент формирования нерастворимого фибрина – полимера.
ПДФ обладают выраженным действием на все звенья гемостаза. Они связывают тромбин, препятствуют образованию протромбиназы. Ранние ПДФ препятствуют полимеризации мономеров фибрина, способствуя образованию и накоплению растворимых комплексов мономеров фибрина (РКМФ), поздние - подавляют адгезию и агрегацию тромбоцитов за счёт блокады рецепторов последних. ПДФ играют важнейшую роль в диагностике приобретённых коагулопатий и, в первую очередь, синдрома диссеминированного внутрисосудистого свёртывания. Фрагменты D и E усиливают действие брадикинина, ангиотензина и гистамина на сосудистую стенку, что приводит к дополнительному выходу активаторов плазминогена и ускорению фибринолиза. ПДФ усиливают фибринолитическую активность крови в 13 раз. Обнаружение повышенного уровня ПДФ всегда свидетельствует о наличии плазминемии, то есть об активации фибринолиза.
Фибриноген Растворимый
фибрин-мономер Растворимый
фибрин-полимер ФИБРИН









ПДФ ф.IIa ф.XIIIa
X
D
Y
D
У
E D-D


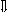 D-димер
D-димер
ПЛАЗМИН

Рис.4. Гидролиз фибрина. Образование ПДФ.
Плазмин является специфическим ферментом не только для фибрина и фибриногена, он расщепляет факторы V и VIII, а также компоненты комплемента С1, С3 и С4, хотя значительно слабее чем фибрин.
Фибринолиз ингибируется соединениями, которые непосредственно связывают плазмин или тормозят активацию плазминогена. Основным ингибитором плазмина является PAI-1, он постоянно продуцируется и секретируется эндотелиоцитами, инактивирует как тканевой, так и урокиназный активаторы плазминогена, в крови и в клетках связан с адгезивным гликопротеином – витронектином. Это увеличивает период полураспада PAI в 2-4 раза и позволяет оказывать более пролонгированное действие в местах локального фибринолиза. Другой не менее важный ингибитор - α2-антиплазмин. Он синтезируется в печени и способен соединяться как с плазмином, так и необратимо с фибрином, что обусловлено наличием фактора XIIIа. Разрушая плазмин, находящийся в кровотоке, α2-антиплазмин способствует тому, что в физиологических условиях в плазме свободный плазмин практически не встречается. Кроме того этот ингибитор связывает трипсин, химотрипсин, прекалликреин, ф.Xa, урокиназу и ТАП. Плазмин, связанный с α2-антиплазмином, теряет способность разрушать фибрин, а фибрин, связавшись с этим ингибитором, становится весьма устойчивым к действию фибринолитических агентов. Плазмин, который уже связан с фибрином, инактивируется α2-макроглобулином.
Это ещё один ингибитор фибринолиза. Действие его несколько слабее и медленнее чем предыдущего, но, вероятно, α2-макроглобулин нейтрализует плазмин, если он не может быть связан с α2-антиплазмином. К ингибиторам фибринолиза относятся также α1-антитрипсин, α1-химотрипсин, интер-1α-трипсин, антитромбин-III, интер-α-глобулин, ингибитор фактора Хагемана и др.
Таким образом, взаимодействие трёх звеньев одной системы, осуществляемое под контролем ЦНС, приводит к тонкому сбалансированному взаимодействию ферментных и неферментативных факторов, низкомолекулярных веществ и ионов. В результате чего любое повреждение кровеносного русла в течение нескольких минут локально тромбируется с последующим восстановлением целостности сосудистой стенки.
ОБЩИЕ ПРЕДСТАВЛЕНИЯ О НАРУШЕНИЯХ СИСТЕМЫ ГЕМОСТАЗА
Наиболее частыми проявлениями патологии гемостаза являются различные виды кровотечений. Кровотечения могут быть проявлениями самостоятельного геморрагического заболевания, осложнением другой патологии, проявлениями местных сосудисто-тканевых повреждений. Причинами геморрагий могут быть как генетические дефекты, так и приобретенные нарушения факторов свёртывания. Любое изолированное или сочетанное нарушение в одном или нескольких звеньях гемостаза может привести к развитию кровоточивости, клинические проявления которой во многих случаях сходны. Поэтому точное определение причины нарушений системы гемостаза явлеятся необходимым условием для проведения адекватной гемостатической терапии.
На основании клинико-анамнестических данных необходимо установить наличие геморрагического диатеза и тип кровоточивости - коагуляционный или капиллярный (табл. 2). Затем определить локализацию дефекта в системе гемостаза. При коагуляционном типе кровоточивости изменения лежат в плазменно-коагуляционном звене гемостаза, при капиллярном же, нарушены механизмы сосудисто-тромбоцитарного звена свёртывания, то есть встречаются при вазопатиях и тромбоцитопатиях.
У больных с дефектом в сосудисто-тромбоцитарном звене гемостаза кровотечения начинаются обычно сразу после травмы (ранние), вследствие несостоятельности образования первичного тромбоцитарного тромба. У этих больных может быть нарушена и окончательная остановка кровотечения вследствие недостаточной коагуляционной функции тромбоцитов и затруднения образования фибринового сгустка.
Поздние кровотечения характерны для коагулопатий, обусловленных дефектом плазменных факторов свёртывания. Они возникают через несколько часов или суток после травмы. Данный феномен объясняется тем, что образование первичной тромбоцитарной пробки не нарушено, однако окончательный фибриновый тромб нестойкий и не может противостоять давлению крови особенно в сосудах среднего калибра.
Таблица 2
Определение характера кровоточивости по клиническим проявлениям
|
Клинические проявления |
Характер кровоточивости | |
|
Коагуляционный |
Капиллярный | |
|
Гематомы (синяки) |
Большие |
Небольшие поверхностные |
|
Гемартрозы |
Часто встречаются у тяжело больных как основной признак |
Не характерны |
|
Петехии |
Отсутствуют |
Типичные проявления |
|
Носовые кровотечения |
Редко |
Часто как основной вид кровотечений |
|
Кровотечения при поверхностных травмах (порезах, ссадинах, царапинах) |
Отсутствуют |
Длительные |
|
Кровотечения после экстракции зуба |
Начинаются через несколько часов после операции и не останавливаются даже после тампонады лунки |
Начинаются сразу после операции и обычно останавливаются после тампонады лунки |
|
Послеоперационные кровотечения |
Поздние, с образованием гематом |
Кровотечения в основном во время операции |
|
Характерные проявления при умеренной кровоточивости |
Большие гематомы после тупых травм и опасные кровотечения после ранений с повреждением кожных покровов и операций |
Носовые и маточные кровотечения |
Для кровотечений, связанных с нарушениями в плазменно-коагуляционом звене, типичны кровоизлияния в полости и мягкие ткани. При дефектах в сосудисто-тромбоцитарном звене характерны кровотечения из слизистых оболочек: носовые, желудочно-кишечные, маточные, а также внутрикожные экхимозы и петехии.
Определение типа кровоточивости диктует необходимость проведения направленных лабораторно-диагностических исследований. Однако у любого первичного больного, независимо от типа кровоточивости необходимо выполнить тесты, характеризующие функцию всех компонентов системы гемостаза, чтобы исключить сопутствующие нарушения в другом звене, а также не пропустить болезнь Виллебранда и афибриногенемию – заболевания, в основе которых лежат изменения нескольких компонентов гемостаза, и отмечается смешанный тип кровоточивости. Кроме того, кровотечения из слизистых оболочек могут быть главным клиническим признаком при ряде коагулопатий, таких как дефицит факторов VII и X. Сочетанные нарушения в системе гемостаза нередки и при приобретенной кровоточивости. Они могут выражаться как в дефиците прокоагулянтов, так и в повышении активности антикоагулянтных и фибринолитических факторов. Поэтому, когда при выполнении минимальной ориентировочной коагулограммы (табл.3) получают результаты, указывающие на преобладание того или иного вида нарушений, то требуется проведение дополнительных исследований.
Таблица 3
Обязательный объём лабораторных исследований при первичном
обследовании больных с геморрагическим заболеванием
|
№ п/п |
Тесты, характеризующие сосудисто-тромбоцитаный гемостаз |
Тесты, характеризующие плазменно-коагуляционный гемостаз |
|
1 |
Длительность кровотечения |
Время свёртывания венозной крови |
|
2 |
Число тромбоцитов |
Время рекальцификации плазмы |
|
3 |
Адгезивно-агрегационная активность тромбоцитов |
Коалиновое время свёртывания плазмы |
|
4 |
|
Активированное парциальное тромбопластиновое время (АПТВ) |
|
5 |
|
Одноступенчатое протромбиновое время (протромбиновый индекс) |
|
6 |
|
Тромбиновое время |
|
7 |
|
Концентрация фибриногена |
|
8 |
|
Тест растворимости фибринового сгустка в мочевине (активность ф.XIII) |
Заключение
Таким образом, взаимодействие трёх звеньев одной системы, осуществляемое под контролем ЦНС, приводит к тонкому сбалансированному взаимодействию ферментных и неферментативных факторов, низкомолекулярных веществ и ионов. В результате чего любое повреждение кровеносного русла в течение нескольких минут локально тромбируется с последующим восстановлением целостности сосудистой стенки.
преподаватель, к.м.н., ассистент, подполковник м/с
Грашин Р.А.
“_____”______________200__ г.
