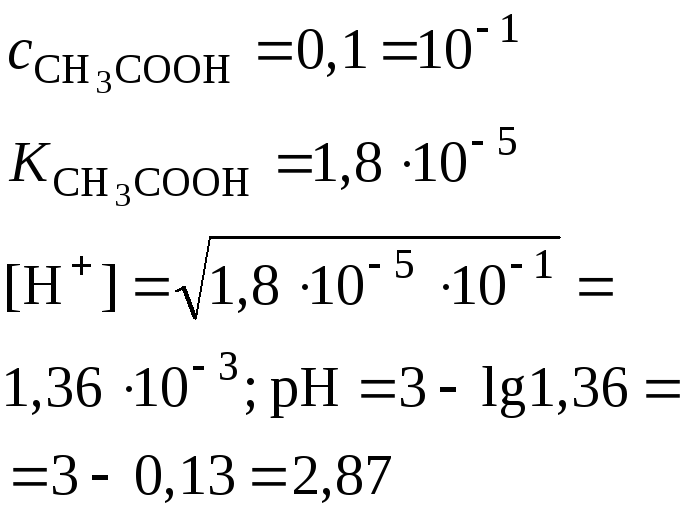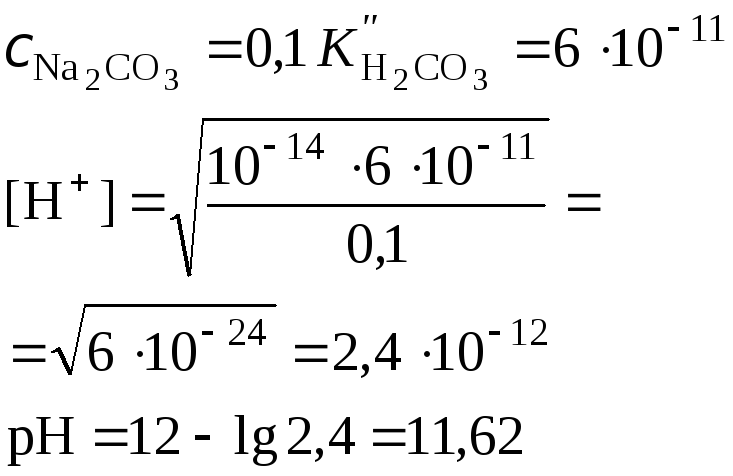- •Методы кислотно-основного титрования, или методы нейтрализации
- •2.1. Характеристика метода
- •2.2. Установление точки эквивалентности
- •3.3. Графический метод изображения процесса нейтрализации
- •2.4. Титрование сильной кислоты сильным основанием
- •2.5. Титрование слабой кислоты сильным основанием
- •2.6. Титрование слабого основания сильной кислотой
- •2.7.Определение содержания Na2co3 и NaOh при их совместном присутствии
- •Концентрация ионов водорода в водных растворах кислот, оснований и солей, подвергающихся гидролизу
2.7.Определение содержания Na2co3 и NaOh при их совместном присутствии
Определение содержания Nа2СО3иNaOHв их смеси может быть выполнено двумя методами, основанными на различных принципах.
Метод 1.Сначала титруют анализируемую смесь 0,1н. кислотой в присутствии фенолфталеина. При этом нейтрализуется весьNaOН и «наполовину»Nа2СО3,превращаемый вNаНСО3. Этим путем можно установить, сколько миллилитров кислоты (VНС11) идет на титрованиеNаOH+1/2Nа2СО3. Затем раствор дотитровывают кислотой в присутствии метилового оранжевого. Так устанавливают, сколько миллилитров кислоты требуется на титрованиеNаНСО3, образовавшегося изNа2СО3, т. е. половиныNа2СО3.
Таким образом, пользуясь двумя индикаторами, удается наблюдать две точки эквивалентности: первую, когда полностью нейтрализовавNaOHи «наполовину»Nа2СО3, и вторую, когда нейтрализуется NaHСО3. Вэтот момент наступает полная нейтрализация смесиNа2СО3+NaOН. В первой точке эквивалентности:
рН =1/2(рКН2СО3 +рКН2СО3) = 1/2(6,4+10,3)=8,35
Следовательно, когда едкий натр будет полностью нейтрализован, а карбонат натрия превратится в бикарбонат, раствор станет слабощелочным. Этот момент фиксируют с помощью фенолфталеина, меняющего свой цвет и интервале рН—8,0—10,0. Во второй точке эквивалентности:
pH =1/2 рКН2СО3‑ 1/2lgСН2СО3 = 1/2 6,4 ‑lg5 10-5 = 3,85
Этот момент фиксируют с помощью метилового оранжевого, меняющего спою окраску и интервале рН =3,1—4,4.
Уравнения реакции:
ОН⁻ + Н+ Н2О
СО32⁻ +Н+ НСО3
НСО3- +Н+ Н2СО3 ⇄Н2О + СО2
Методика определения. К титруемому раствору прибавляют 3—5капель фенолфталеина и титруют. 0,1н. раствором НС1 до обесцвечивания. По достижении первой точки эквивалентности отсчитывают количество0,1 н.раствора кислоты, израсходованной на нейтрализацию NaOHи «половины»Na2CO3 — VHCl1. Затем к титруемому раствору прибавляют 1—2 капли метилового оранжевого и титруют до конца. По окончании титрования отсчитывают израсходованное количество кислотыVHClII. Титрование лучше проводить со «свидетелями».
Щелочные растворы легко поглощают CO2из воздуха. Поэтому отмеренный объем анализируемого раствора титруют немедленно и быстро, избегая излишнего взбалтывания.
Приложение
Концентрация ионов водорода в водных растворах кислот, оснований и солей, подвергающихся гидролизу
Концентрация ионов водорода в водном растворе зависит от концентрации кислоты, щелочи, соли, от константы диссоциации слабых кислот и слабых оснований и от ионного произведения воды.
В таблице приведены формулы для вычисления концентрации ионов водорода или гидроксила в различных растворах.
|
Раствор |
Формула для вычисления концентрации ионов водорода или гидроксила в водном растворе |
Пример |
|
Сильная кислота разбавленная (например, НС1) |
[H+] =cкисл. рН = ‑ lgcкисл. |
сHCl = 0,1 [H+] = 0,1 = 10-1; pH = 1 |
|
Сильная щелочь разбавленная (например, NaOH) |
[OH‾] =cосн. рOН = ‑lgcосн. |
сNaOH = 0,1; OH‾ = 10-1 pOH = 1; pH = 14 ‑ 1 = 13 |
|
Слабая кислота (например, СН3СООН) |
|
|
|
Слабая щелочь (например, NH4OH) |
|
|
|
Слабая кислота в присутствии ее соли (например, СН3СООН+ + СН3СООNa)
|
|
|
|
Слабая щелочь в присутствии ее соли (например, NН4ОН+ + NН4Сl) |
|
|
|
Соль слабой кислоты и сильной щелочи (например, СН3СООNa)
|
|
рН= 9-lg3,6= 8,4 |
|
Соль слабого основания и сильной кислоты (например, NH4Cl) |
|
|
|
Соль слабой двухосновной кислоты (например, Na2CO3 |
|
|
|
Кислая соль слабой двухосновнойкислоты (например, NaHCO3) |
|
|
Интервалы перехода окраски некоторых индикаторов*
|
Индикатор |
Интервал перехода pH |
Значение pT |
Окраска |
рКHInd | |
|
в кислой среде, молекулярная форма |
в щелочной среде, ионная форма | ||||
|
Тимоловый голубой (1-й переход) |
1,2-2,8 |
2 |
Красный |
Желтый |
1,7 |
|
Метиловый оранжевый |
3,1-4,4 |
4 |
Красный |
Желтый |
3,7 |
|
Метиловый красный |
4,4-6,2 |
5 |
Красный |
Желтый |
5,1 |
|
Лакмус |
5,0—8,0 |
7 |
Красный |
Синий |
|
|
Феноловый красный |
6,4—8,0 |
7 |
Желтый |
Красный |
8,0 |
|
Тимоловый голубой (2-й переход) |
8,0—9,6 |
8 |
Желтый |
Голубой |
9,2 |
|
Фенолфталеин |
8,0—10,0 |
9 |
Бесцветный |
Красный |
9,2 |
|
Тимолфталеин |
9,4-10,6 |
10 |
Бесцветный |
Синий |
9,7 |
|
Ализариновый желтый |
10,0-12,0 |
11 |
Желтый |
Сиреневый |
10.7 |