
ред.Рыбкиной - Простое вещество (2000)
.pdf31
Проследим зависимость физических свойств простых веществ от химического и кристаллохимического строения на примере такого физиче- ского свойства, как температура плавления. Стоящие рядом в таблице Д.И. Менделеева под номерами 6 и 7 углерод и азот немного отличаются друг от друга как элементы – радиусы атомов, энергии ионизации, сродство к элек-
трону и электроотрицательность их соответственно равны: |
|
|||
C |
rат., Å |
Еи, эВ |
Ее, эВ |
ОЭО |
0,77 |
11,26 |
1,27 |
2,5 |
|
N |
0,70 |
14,53 |
-0,21 |
3,0 |
Однако физические свойства простых веществ |
углерода и азота |
|||
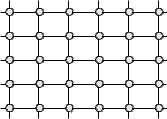
совсем непохожи. Углерод – это в обычных условиях кристаллическое ве- щество с очень твердым кристаллом (алмаз), tпл.(алмаз) = 3000 °С. Азот в обычных условиях – газ, tпл.(N2) = -209,86 °С. Причина такого отличия – в различии кристаллохимического строения этих веществ. Углерод образует за счет ковалентных связей при sp3-гибридизации пространственную поли- мерную структуру – кристалл; это по существу одна молекула (рис. 5.2). Азот представляет собой вещество, состоящее из отдельных молекул соста- ва N2. Атомы в молекуле между собой связаны очень прочно (Есв. = 941,2 кДж/моль). Молекулярная структура сохраняется в газообразном, жидком и твердом агрегатных состояниях. В узлах кристаллической решетки твердого азота находятся молекулы N2 (рис. 7.1).
Образование различных внутренних структур, какие мы видели у углерода и азота (такое положение наблюдается во многих других случаях), обусловлено энергетической выгодой той или иной связи и соответствую- щей структуры для данного элемента. Так для азота образование тройной
связи в молекуле N≡N (одна σ-связь и две π-связи) оказалось энергетически более выгодным, чем образование трех одинарных связей: энергия связи в
молекуле равна 941 кДж/моль, а три связи в цепочке N − N − N − N да-
250 |
250 |
250 |
дут только 750 кДж/моль. У углерода каждая связь −С − С − С − |
в алмазе |
|
374 |
374 |
|
равна 374 кДж/моль, а тройная связь между атомами углерода (одна σ-связь и две π-связи) – всего 535 кДж/моль. И в ацетилене Н-С≡С-Н такая связь получается только с затратой энергии (образование ацетилена из простых
веществ идет с затратой энергии H° = +229 кДж/моль).
2C(графит) + H2(г) ↔ Н-С≡С-Н(г) ; H° = +229 кДж/моль,
поэтому ацетилен неустойчивое, взрывоопасное вещество.
По своим свойствам простое вещество азот имеет большое сходство с простыми веществами кислородом, фтором, хлором, кристаллохимическое строение которых похоже между собой. Все эти вещества состоят из моле- кул состава Э2, которые в кристалле удерживаются друг около друга за счет сил Ван-дер-Ваальса.
32
Энергии частиц (молекул), необходимые для разрушения кристал-
лической решетки и испарения невелики и достигаются уже при низких
температурах (tпл.(N2) = -209,86 °C), (tкип.(N2) = -195,8 °C). В привычных для нас условиях азот – газообразное вещество.
Углерод же больше похож на своих соседей: бор (tпл.(B) = 2300 °C), кремний (tпл.(Si) = 1400 °C), внутреннее строение которых сходно с кристал- лохимическим строением углерода – полимера за счет ковалентных связей между атомами углерода.
Изменение физических свойств с изменением характера связи меж- ду атомами элемента можно наблюдать, например, в ряду C – Si – Ge – Sn – Pb. Углерод – типичный неметалл, непроводник, а свинец – металл, прово- дит электрический ток. Свойства этих веществ никак не подтверждают, что C и Pb – аналоги. Температура плавления изменяется следующим образом:
tпл., °С |
C(графит) Si |
Ge |
|
b-Sn |
Pb |
|
||
>3000 |
1400 |
958,5 |
231,85 |
327,4 |
свойств в |
|||
|
|
|
|
|
|
Такие изменения |
||
|
|
|
|
|
этом ряду имеют место из-за измене- |
|||
|
|
|
|
|
ния химической связи между атомами |
|||
|
|
|
|
|
элементов и внутренней структуры в |
|||
|
|
|
|
|
этих простых веществах. В углероде |
|||
|
|
|
|
|
ковалентная связь между атомами об- |
|||
|
|
|
|
|
разует полимер. Здесь нет какого-либо |
|||
|
|
|
|
|
вклада металлической связи, все ва- |
|||
|
|
|
|
|
лентные электроны разобраны и на- |
|||
Рис. |
7.1. |
Кристаллическая |
мертво привязаны к атомам. В свинце |
|||||
при некотором сохранении ковалент- |
||||||||
решетка твердого азота. |
|
|||||||
|
ности достаточно явно |
проявляется |
||||||
|
|
|
|
|
||||
металлическая связь, вклад которой достаточно велик. Свинец имеет гранецентрированную кубическую кри- сталлическую структуру, характерную для металлов. Si – Ge – Sn занимают промежуточное положение между С и Pb. С постепенным нарастанием ме- таллических свойств, подтверждением чего является рост их электропрово- димости: Si и Ge – полупроводники, а Sn – уже проводник.
Удельное электрическое сопротивление указанных простых ве-
ществ соответственно равно: |
|
|
|
||
|
C |
Si |
Ge |
Sn |
Pb |
r×10-6, Ом×см |
5×1020 |
106 |
4×106 |
9,3 |
18,8 |
(Выпадение из ряда Ge и Pb объясняется d- и f-сжатием).
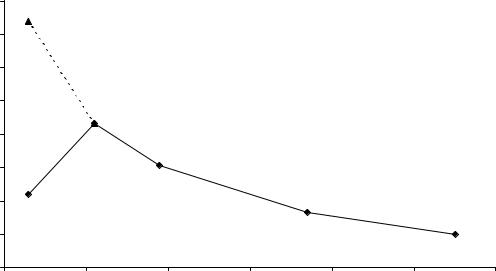
Очень наглядно можно наблюдать влияние и свойств атомов и хи-
мической связи в простом веществе на физические свойства этого вещества на примере металлов IA группы и галогенов. На рис. 7.2 и 7.3 показано из- менение электропроводности щелочных металлов и энергии связи в моле-

33
кулах галогенов (Г2). Удельное электрическое сопротивление металлов IA
группы соответственно равно: |
|
|
|
|
Cs |
Rb |
K |
Na |
Li |
r×10-6, Ом×см 18,83 |
11,3 |
6,15 |
4,34 |
8,55 |
Приняв условно электропроводность Cs за 1, мы получим зависи- мость, приведенную на рис. 7.2. От Cs к Na электропроводность увеличива- ется, хотя казалось бы, должно быть наоборот, т.к. прочность удержания электронов около своих атомов от Cs к Na увеличивается. Энергия иониза- ции у Cs, Rb, K и Na равна соответственно:
|
Cs |
Rb |
K |
Na |
Еи, кДж/моль |
3,89 |
4,77 |
4,84 |
5,13 |
Однако, |
величина электропроводности определяется числом сво- |
|||
бодных электронов в единице объема, а это число от Cs к Na будет увеличи- ваться, т.к. уменьшается объем одного атома. Радиусы атомов в ангстремах равны соответственно:
|
Cs |
Rb |
K |
Na |
Li |
rат., нм |
0,265 |
0,247 |
0,227 |
0,154 |
0,134 |
и в единице объема ( V = 43 ×p×r3 ) поместится атомов Na, например, в 5 раз
больше, чем атомов Cs, в 4,1 раза больше, чем атомов Rb и в 3,2 раза боль- ше, чем атомов К. Таким образом, хотя от Cs к Na “свободность” электро- нов несколько уменьшается, но электронов в единице объема от Cs к Na становится значительно больше. Как видно, от Cs к Na влияние числа сво- бодных электронов в единице объема сказывается сильнее, чем уровень “свободности” каждого электрона и электропроводность от Cs к Na увели- чивается.
Для Li же все наоборот: электропроводность Li уменьшается, хотя число электронов увеличилось по сравнению и с Na, и с К. Причиной этого является заметное влияние ковалентности в связи между атомами Li. Из-за этого резко падает уровень свободности электронов, и, хотя число этих электронов в единице объема простого вещества увеличивается, электро- проводность лития уменьшается.
Еще рассмотрим влияние на физические свойства простых веществ
исвойств атомов, и характера связи между атомами на примере галогенов как простых веществ (Г2). В табл. 7.1 приведены некоторые свойства атомов
имолекул Г2 галогенов.
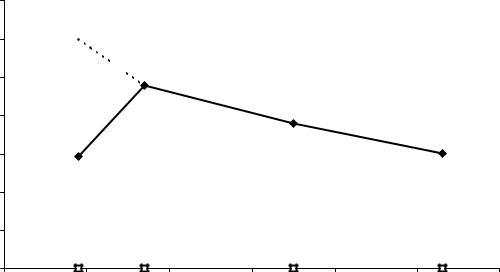
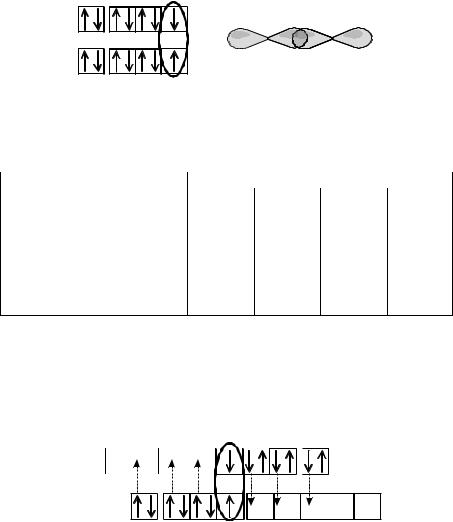
Прочность связи в молекулах галогенов увеличивается снизу вверх по таблице Д.И. Менделеева от I2 к Cl2, т.к. уменьшается радиус атомов, доля перекрывания электронных облаков увеличивается, и прочность s- связи увеличивается.
|
8 |
|
|
|
|
|
|
|
7 |
(Li) |
|
|
|
|
|
|
|
|
|
|
|
|
|
ед. |
6 |
|
|
|
|
|
|
,усл. |
|
|
|
|
|
|
|
5 |
|
|
|
|
|
|
|
Электропроводность |
|
|
|
|
|
|
|
4 |
|
Na |
|
|
|
|
|
|
|
|
|
|
|
||
3 |
|
K |
|
|
|
|
|
|
|
|
|
|
|
||
2 |
Li |
|
|
Rb |
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
Cs |
|
0 |
|
|
|
|
|
|
|
0 |
10 |
20 |
30 |
40 |
50 |
60 |
|
|
Порядковый номер элементов в таблице Д.И. Менделеева |
|
||||
Рис. 7.2. Изменение электропроводности в ряду металлов IA группы.
Есв., кДж/моль
350
300
250
200
150
100
50
0
 239,05
239,05
189,94
147,67 |
150,73 |
F2 |
Cl2 |
Br2 |
I2 |
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0 |
10 |
20 |
30 |
40 |
50 |
60 |
Порядковый номер элемента в таблице Д.И. Менделеева
Рис. 7.3. Изменение энергии связи в молекулах галогенов в ряду F2 - I2 от порядкового номера элемента.
36
На рис. 7.2 показана зависимость энергии связи в молекулах галогенов от порядкового номера элемента:
t
Г2 ↔ 2Г
ns2 np5
ns2 |
np5 |
|
|
|
|
Рис. 7.4. σ-связь в молекулах галогенов |
|
||||
|
|
|
|
Таблица 7. 1 |
|
Некоторые свойства атомов и молекул Г2 галогенов |
|||||
|
|
|
|
|
|
Свойство |
|
|
Наименование галогена |
|
|
|
фтор |
хлор |
бром |
иод |
|
|
|
||||
Атомный радиус, нм |
|
0,064 |
0,099 |
0,111 |
0,128 |
Межъядерное расстояние в |
0,1418 |
0,1928 |
0,2384 |
0,2662 |
|
молекулах Г2, нм |
|
|
|
|
|
Энергия термической |
диссо- |
147,67 |
239,05 |
189,94 |
150,73 |
циации Г2 → 2Г, кДж/моль |
|
|
|
|
|
Порядковый номер галогена в |
9 |
17 |
35 |
53 |
|
таблице Д.И. Менделеева, (N) |
|
|
|
|
|
Прочность связи в молекуле фтора уменьшается. Этот факт объяс-
няется тем, что в молекулах Cl2, Br2 и I2 связь между атомами, кроме σ- связи неспаренных p-электронов (рис.7.4), осуществляется еще и за счет донорно-акцепторного взаимодействия. Образуется так называемая датив- ная связь, когда между атомами не одна, а две или более донорно- акцепторных связей. На рис. 7.5 показано, как это происходит в молекуле хлора.
|
|
3d0 |
3p5 |
3s2 |
||
|
|
|
|
|
|
|
|
|
σ |
3s2 |
3p5 |
3d0 |
Рис. 7.5. Схема образования σ- и дативной связи в молекуле хлора.
37
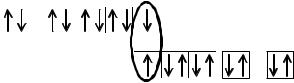
Из рис. 7.5 видно, что в молекуле хлора одна σ-связь, и есть возможность образования до 6 ковалентных связей по донорно-акцепторному механизму. Аналогичная возможность есть у брома и иода. У фтора нет возможности образования связей по донорно-акцепторному механизму, т.к. нет вакант-
ных d-орбиталей, и связь между атомами осуществляется за счет одной σ- связи (рис. 7.6).
1s2 |
2s2 |
|
|
2p5 |
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2p5 |
2s2 |
1s2 |
Рис. 7.6. Схема образования σ-связи в молекуле фтора (F2).
Таким образом, монотонное усиление связи в молекулах галогенов от I2 к Cl2, обусловленное уменьшением размеров атомов галогенов, казалось бы нелогично нарушается в случае фтора. Нелогично потому, что атомы фтора меньше, чем атомы хлора. Однако, у фтора изменился характер химической связи между атомами в молекуле, и этот фактор пересиливает влияние уменьшения размера атомов у F2.
Многие свойства простых веществ проявляют периодичность. Их периодичность связана с периодичностью в свойствах элементов, т.е. в пе- риодичности простых веществ проявляется природа элементов и периоди- ческое изменение их свойств.
Периодический закон «¼выражает свойства элементов, а не про- стых тел. Свойства простых и сложных тел находятся в периодической
зависимости от атомного веса элементов только потому, что ¼сами яв- ляют результат свойства¼ элементов, их образующих»
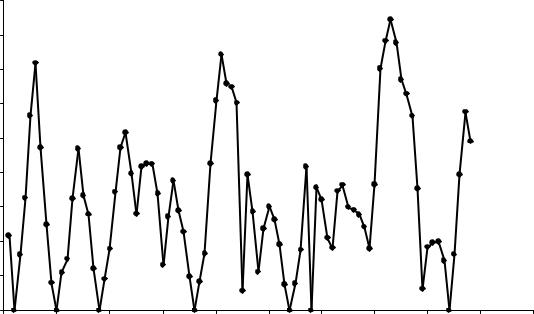
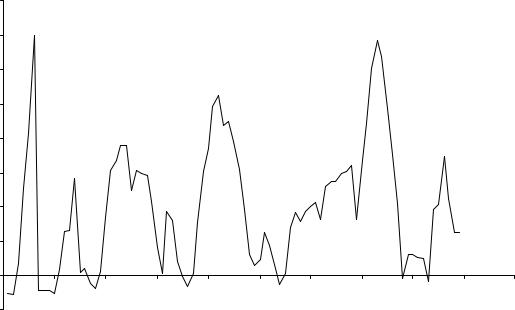
Д.И. Менделеев На рис. 7.7 – 7.9 показаны периодические изменения энтальпий атомизации (энергии, необходимой для превращения простых веществ в отдельные, независимо существующие атомы), температур плавления и
энергии диссоциации двухатомных молекул гомоатомных соединений с ростом порядкового номера элемента, образующего эти соединения. Похо- жие зависимости имеют место и для ряда других физических свойств про- стых веществ.
|
900 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
W |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
800 |
|
|
|
|
|
|
|
|
|
Nb |
|
|
|
|
Ta |
Re |
|
|
|
|
|
|
C |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
кДж/моль |
700 |
|
|
|
|
|
|
|
|
|
Mo |
|
|
|
|
Hf |
|
Os |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
Tc |
|
|
|
|
|
Ir |
|
|
|
||
600 |
|
|
|
|
|
|
|
|
Zr |
Ru |
|
|
|
|
|
|
Th |
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
Pt |
|
|
||||||
атомизации, |
B |
|
|
|
|
|
V |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
500 |
N |
|
Si |
|
Ti |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
FeCo |
|
|
Y |
|
|
|
La |
|
|
|
|
|
U |
|
|||
400 |
|
|
|
|
|
Ni Ge |
|
Pd |
|
|
|
|
|
Ac |
|
||||||
|
|
|
|
|
Cr |
|
|
|
|
Pr Gd |
Tb |
|
|
|
|
||||||
Ээнтальпия |
|
|
|
|
Sc |
|
|
|
|
|
|
|
Lu |
Au |
|
|
|
||||
Be |
|
Al |
P |
Cu |
|
As |
|
Ag |
Sn |
|
Nd |
Ho |
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
300 |
|
|
S |
|
|
|
|
Sb |
Dy |
|
|
|
|
|
|||||||
H |
O |
|
|
Mn |
Ga |
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
Er |
|
PbTlBi |
|
|
|||||||||
200 |
|
|
|
|
Ca |
|
|
Se |
|
In |
Ba |
Sm |
Tm |
|
|
|
|||||
|
|
Li |
Mg |
|
|
|
|
Sr |
|
Te |
|
|
|
|
Ra |
|
|||||
|
|
|
|
|
|
|
Eu |
Yb |
|
|
|
|
|||||||||
|
|
|
|
|
Zn |
|
|
|
|
|
|
|
Po |
|
|||||||
|
100 |
|
Na Cl |
|
K |
|
|
|
|
Cd I |
|
|
|
|
|
|
|||||
|
F |
|
|
Br |
|
Rb |
Cs |
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
Hg |
|
|
|
|||||||
|
0 |
|
|
|
|
|
|
|
|
|
Rh |
|
|
|
|
|
|
|
|
||
|
10Ne |
|
|
Ar |
|
|
|
|
|
|
|
Xe Ce60 |
|
|
|
|
|
|
|||
|
0 He |
|
|
|
30 |
|
Kr |
40 |
50 |
70 |
|
80 |
Rn |
90 |
100 |
||||||
|
|
|
20 |
|
|
|
|||||||||||||||
|
|
|
|
Порядковый номер элемента в периодической системе Д.И. Менделеева |
|
|
|||||||||||||||
Рис. 7. 7. Зависимость энтальпии атомизации простых веществ от порядкового номера элементов.
|
4000 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
C |
|
|
|
|
|
|
|
|
|
|
|
|
W |
|
|
|
|
|
|
3500 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Re |
|
|
|
|
3000 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Ta |
|
|
|
|
|
0С |
|
|
|
|
|
|
|
|
|
Mo |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
, |
2500 |
|
|
|
|
|
|
|
|
Nb |
|
|
|
|
|
|
|
Ir |
|
|
|
плавления |
|
|
|
|
|
|
|
|
Ru |
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Hf |
|
|
|
|
||
|
B |
|
|
|
|
V Cr |
|
|
Tc |
|
|
|
|
|
|
|
|
|
|
||
2000 |
|
|
|
|
|
|
Rh |
|
|
|
|
|
|
|
|
Th |
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
Ti |
FeCo |
|
Zr |
|
|
|
|
Ho |
Tm |
Lu |
Pt |
|
|
|||
Температура |
|
|
|
|
Si |
|
|
Pd |
|
|
|
|
|
|
|
||||||
1500 |
|
|
|
Sc |
Y |
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
Ni |
|
|
|
TbDy |
Er |
|
|
|
|
|
|||||
|
Be |
|
|
|
|
|
|
|
|
|
|
|
Gd |
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
1000 |
|
|
|
|
|
Mn |
Cu |
Ge |
|
Ag |
LaNd |
Sm |
|
|
|
Au |
Ac |
U |
|
||
|
|
|
|
Ca |
|
|
|
|
|
|
Ra |
|
|
||||||||
|
|
|
Al |
|
As |
Sr |
Sb |
Ba |
Pr |
|
|
|
|
|
|
||||||
|
|
|
|
|
Yb |
|
|
|
|
|
|||||||||||
|
500 |
|
|
Mg |
|
|
|
|
|
|
|
|
Ce Eu |
|
|
|
|
Np Pu |
|
||
|
|
|
|
|
|
|
Zn |
Se |
|
Cd |
Te |
|
|
|
|
|
PbBi |
|
|||
|
|
|
|
|
S |
|
|
|
|
|
|
|
|
|
|
||||||
|
|
Li |
|
Na |
|
|
Ga |
|
I |
Cs |
|
|
|
|
Tl |
Po |
|
||||
|
|
|
K |
|
|
Rb |
In Sn |
|
|
|
|
|
|||||||||
|
0 |
|
|
P |
|
Br |
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Hg 80 Rn |
|
|
|||
|
|
0 |
N |
10 |
Cl |
Ar20 |
|
30 |
40 |
50 |
Xe |
|
60 |
|
70 |
90 |
100 |
||||
|
|
|
Kr |
|
|
||||||||||||||||
|
-500 |
H He |
|
OF Ne |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Порядковый номер элемента в периодической системе Д.И. Менделеева |
|
|||||||||||||||
Рис. 7.8. Зависимость температур плавления простых веществ от порядкового номера элементов. |
|||||||||||||||||||||
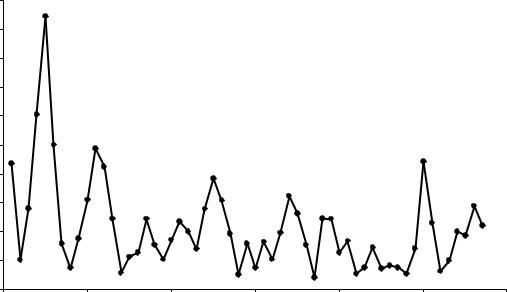
|
|
1000 |
|
N2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
, |
|
900 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
молекул |
|
800 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
двухатомных |
|
700 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
/моль |
600 |
C2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
P2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
500 |
H2 |
O2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Ta2 |
|
|
||
диссоциации |
кДж |
400 |
|
|
S2 |
|
|
As2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Sb2 |
|
|
|
|
|
|
|
|
|||
|
|
Si2 |
|
|
|
|
Se2 |
|
|
|
|
|
|
|
|
Th2 |
|
||||
300 |
|
|
|
Ge2 |
|
|
|
Te2 |
|
|
|
|
|
|
|||||||
|
B2 |
V2 |
|
|
|
|
|
|
La2 Ce2 |
|
|
|
|
|
|||||||
|
|
|
Ni2 |
|
|
|
|
|
|
|
|
Au2 Bi2 |
|
||||||||
Энергия |
|
200 |
|
|
Cl2 |
Cr2 |
Cu2 |
Br |
|
Y2 Ag2 |
|
I2 |
Nd |
Tb2 |
|
U2 |
|||||
|
|
Al2 |
|
|
2 |
|
|
|
|||||||||||||
|
|
|
|
Co2 |
|
|
|
|
Sn2 |
2 |
Lu2 |
Po2 |
|
||||||||
|
|
|
F2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
100 |
Li2 |
|
Ti2 |
Fe2 |
Ga2 |
|
|
|
In2 |
|
|
Pr2 |
|
Ho2Er2 |
Pb2 |
|
||||
|
|
|
Na2 |
Sc2 |
|
|
|
|
Pd2 |
|
|
|
Eu2 |
Dy2 |
|
|
|||||
|
|
|
|
K2 |
|
|
|
|
Rb2 |
|
|
Cs2 |
|
|
Tm2 |
Tl2 |
|
||||
|
|
0 |
|
|
|
|
|
|
|
|
Sm2 |
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0 |
|
10 |
|
20 |
|
|
|
30 |
|
|
|
|
40 |
|
|
50 |
|
60 |
|
|
|
|
|
Порядковый номер элемента в периодической системе Д.И. Менделеева |
|
||||||||||||||||
Рис. 7.9. Энергия диссоциации двухатомных молекул гомоатомных соединений.
