
ред.Рыбкиной - Простое вещество (2000)
.pdf41
§8. ХИМИЧЕСКИЕ СВОЙСТВА ПРОСТЫХ ВЕЩЕСТВ
При рассмотрении физических свойств простых веществ подчерки- валось, что они в основном присущи макроскопическим количествам веще- ства (особенно в конденсированном состоянии).
Что же касается химических свойств, то они главным образом оп- ределяются свойствами атомов, молекул, поскольку химическое взаимодей- ствие всегда протекает на атомном или молекулярном уровне. Однако ре- ально наблюдаемая химическая активность твердых простых веществ в за- метной мере зависит, например, от величины поверхности соприкоснове- ния, структуры кристалла и т.п., т.е. от макроскопических характеристик веществ.
Так, мелкодисперсный цинк (цинковая пыль) значительно энергич- нее взаимодействует с кислотами, чем гранулированный: цинковая пыль восстанавливает азотную кислоту до аммиака, а гранулированный цинк – только до низших оксидов азота.
Хорошо известна также способность многих металлов (Al, Fe, Ti, Cr и др.) к пассивации в агрессивных окисляющих средах, хотя сами эти ме- таллы достаточно активны. Кроме того, различные модификации одного и
того же простого вещества также могут заметно различаться по химической активности (например, белый и красный фосфор).
Таким образом, химические свойства простых веществ пред-
ставляют собой производную атомной, молекулярной и кристаллической форм химической организации со всеми характерными для них способностями.
По химическим свойствам простые вещества, как известно, также подразделяются на металлы и неметаллы. С этими двумя классами генети- чески связаны соответствующие ряды характеристических соединений (ос- новных и кислотных), гидроксидов (оснований и кислот). Относительной особенностью этих рядов является способность к взаимодействию с образо- ванием солей, т.е. к взаимной нейтрализации в широком смысле слова.
Чем ярче выражены металлические и неметаллические свойства простых веществ, тем активнее взаимодействие между ними и их характе- ристическими соединениями. Таким образом, в химии ярко проявляется симметричность относительно кислотно-основного взаимодействия, причем каждый из генетических типов базируется на одном из двух классов про- стых веществ.
Сэтих позиций становится более понятным явление амфотерности
вшироком смысле как общего свойства простых веществ и их характери- стических производных.
42
Осложняющим обстоятельством здесь является то, что кислотно- основное взаимодействие между характеристическими соединениями про- исходит без изменения степени окисления, а взаимодействия с участием простых веществ непременно являются окислительно-восстановительными.
Таким образом, для простых веществ два вида взаимодействия (ки- слотно-основное и окислительно-восстановительное) сливаются воедино.
Эта особенность наглядно прослеживается при взаимодействии металлов с неметаллами, причем первые – восстановители, в соединениях присутству- ют в окисленной форме (катионообразователи), а вторые – окислители и выполняют роль анионообразователей, выступающих в соединении в вос- становленной форме. Например:
|
+2 −2 +4 −2 |
+2 +4 −2 |
|
|
Ca O+ C O2 |
→ Ca C O3 |
(1), |
|
0 0 |
+1 −1 |
|
но |
2 Li+ Cl2 → 2 Li Cl |
(2) |
|
И в первом, и во втором случаях имеет место кислотно-основное взаимодействие. Но во втором случае, когда реагируют простые вещества, оно сопровождается и окислительно-восстановительным процессом, что и ведет к изменению степени окисления атомов элементов реагирующих ве- ществ. В первом же случае окислительно-восстановительного процесса нет, нет и изменения степени окисления.
Таким образом, окислительно-восстановительная сущность при взаимодействии металлов с неметаллами выражена весьма выпукло. Но при этом образуются соли бескислородных кислот, т.е. происходит нейтрализа- ция в широком смысле. В то же время это взаимодействие можно рассмат- ривать и как кислотно-основное.
КОНТРОЛЬНЫЕ ВОПРОСЫ
1.К какому классу относятся простые вещества: смеси, растворы, химиче- ские соединения?
2.Присутствуют ли в природе простые вещества в свободном виде?
3.Какие Вы знаете способы получения простых веществ: а) из смесей; б) из химических соединений?
4.Чем отличается химический элемент от простого вещества?
5.Каковы основные характеристики элемента?
6.Назовите несколько свойств, характеризующих простое вещество.
7.Какие типы химической связи могут реализоваться в простом веществе?
8.Чем отличается в простом веществе ковалентно-молекулярное строение от ковалентно-координационного?
43
9.Каким фактором электронного строения атомов простого вещества обу- словлена возможность реализации ковалентной связи и металлической? Что такое линия Цинтля?
10.Как читается правило Юм Розери; какая внутренняя структура реализу- ется в простом веществе, вытекающая из этого правила?
11.Какие явления называются аллотропией и полиморфизмом?
12.Почему у простых веществ явление полиморфизма называют аллотропи- ей?
13.По каким свойствам делятся простые вещества на металлы и неметаллы с позиции физика и с позиции химика?
14.Каковы условия образования в простом веществе металлической хими- ческой связи и ковалентной?
15.Как проходит линия, разделяющая металлы и неметаллы в периодиче- ской системе Д.И. Менделеева?
16.Чем объясняется отступление от общего правила образования химиче- ской связи у бора, свинца, висмута, полония?
17.Чем объясняется аналогичное изменение tпл. у простых веществ, образо-
ванных d-элементами IV, V, и VI периодов (Sc – Zn; Y – Cd; La – Hg)?
18.Чем объясняются особенно высокие температуры плавления у таких простых веществ: хром, молибден, вольфрам?
ПРИЛОЖЕНИЕ 1.
НОМЕНКЛАТУРА ПРОСТЫХ ВЕЩЕСТВ
Простые вещества, как правило, называют так же, как и соответст- вующие химические элементы, например: магний, ртуть, сурьма, ксенон и др.
Для аллотропных форм простых веществ, молекулярные формулы которых известны, в названиях указывают число атомов в молекуле с по-
мощью числовых приставок: |
|
|
|||
1 |
– моно; |
5 |
– пента; |
9 – нона; |
|
2 |
– ди; |
6 |
– гекса; |
10 |
– дека; |
3 |
– три; |
7 |
– гепта; |
11 |
– ундека; |
4 |
– тетра; |
8 |
– окта; |
12 |
– додека. |
Неопределенное число обозначается приставкой поли.
Примеры систематических названий простых веществ (в скобках даны традиционные названия):
H – моноводород (атомный водород);
H2 – диводород (молекулярный водород);
O2 – дикислород (молекулярный кислород);
44
O3 – трикислород (озон);
N2 – диазот (молекулярный азот);
S8 – октасера (кристаллическая сера); Sn – полисера (аморфная сера);
P4 – тетрафосфор (белый фосфор);
Pn – полифосфор (черный фосфор); и т.д.
Для твердых полиморфных модификаций допускается их обозначе-
ние греческими буквами: α (альфа), β (бета), γ (гамма), δ (дельта) и т.д., на- чиная с низкотемпературных модификаций. Например, олово имеет сле- дующие модификации, устойчивые в определенных границах температуры:
α-Sn - α-олово (серое олово) ниже 13 °С;
β-Sn - β-олово (белое олово) от 13,2 °С до 161 °С; γ-Sn - γ-олово выше 161 °С.
Ранее употреблявшиеся обозначения Snα, Snβ более не применяются.
В формулах и названиях простых веществ может быть указана кри- сталлическая структура модификаций. Для этого применяют следующие сокращенные обозначения кристаллических систем:
куб. – кубическая; |
тетр. – тетрагональная; |
ромб. – (орто) ромбическая; |
монокл. – моноклинная; |
гекс. – гексагональная; |
триг. – тригональная; |
трикл. – триклинная. |
|
Сокращенные обозначения сингоний указываются в круглых скоб- ках после формулы или названия простого вещества.
Например, для кристаллической серы известны следующие моди- фикации:
α-S, или S (ромб.) - α-сера, или сера (ромб.);
β-S, или S (монокл.) - β-сера, или сера (моноклинная). Аморфные состояния в формулах и названиях обозначают так: С (ам.) – углерод (ам);
S (ам.) – сера (ам.)
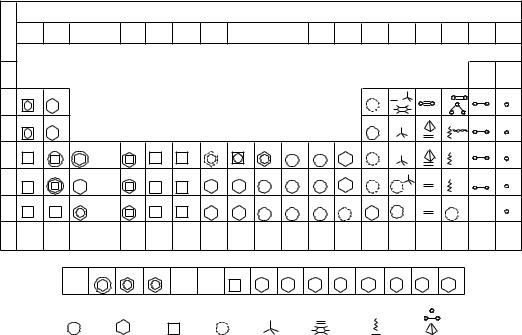
ПРИЛОЖЕНИЕ 2.
СТРУКТУРА ПРОСТЫХ ВЕЩЕСТВ
П |
|
|
|
|
|
|
|
Группы элементов |
|
|
|
|
|
|
|
|||
е |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
р |
IA |
IIA |
IIIБ |
IVБ |
VБ |
VIБ |
VIIБ |
|
VIIIБ |
|
IБ |
IIБ |
IIIA |
IVA |
VA |
VIA |
VIIA |
VIIIA |
и |
|
|
||||||||||||||||
о |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
д |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(H) |
He |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
Li |
Be |
|
|
|
|
|
|
|
|
|
|
B |
C |
N |
O |
F |
Ne |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3 |
Na |
Mg |
|
|
|
|
|
|
|
|
|
|
Al |
Si |
P |
S |
Cl |
Ar |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4 |
K |
Ca |
Sc |
Ti |
V |
Cr |
Mn |
Fe |
Co |
Ni |
Cu |
Zn |
Ga |
Ge |
As |
Se |
Br |
Kr |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
5 |
Rb |
Sr |
Y |
Zr |
Nb |
Mo |
Tc |
Ru |
Rh |
Pd |
Ag |
Cd |
In |
Sn |
Sb |
Te |
I |
Xe |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
6 |
Cs |
Ba |
La - Lu |
Hf |
Ta |
W |
Re |
Os |
Ir |
Pt |
Au |
Hg |
Tl |
Pb |
Bi |
Po |
At |
Rn |
|
|
Ac -*(Lr) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
7 |
Fr |
Ra |
Rf |
Db |
Sg |
Bh |
Hn |
Mt |
|
|
|
|
|
|
|
|
|
|
|
|
** |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
* |
La Ce |
Pr |
Nd |
Pm |
Sm |
Eu |
Gd |
Tb |
Dy |
Ho |
Er |
Tm |
Yb |
Lu |
|
|
|
|
|
1 |
2 |
|
3 |
|
4 |
|
5 |
|
6 |
|
7 |
|
8 |
|
|
1 – кубическая гранецентрированная; 2 – гексагональная; 3 – объемно центрированная; 4 – прочие структу- ры; 5 – алмазоподобная; 6 – слоистая; 7 – цепная; 8 – островная (молекулярная).
46
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1.Я.А. Угай. Общая химия. М.: Высш. шк., 1984. С. 173-200.
2.Я.А. Угай. Неорганическая химия. М.: Высш. шк., 1989. С. 25-47.
3.В.И. Спицын, Л.И. Мартыненко. Неорганическая химия. М.: Изд. МГУ, 1991. 320 с.
4.Краткая химическая энциклопедия. М.: Советская энциклопедия. 1967.
Т. 3.
5.Р.А. Лидин и др. Номенклатура неорганических соединений. М.: Химия, 1983. 12 с.
6.Дж. Хьюи. Неорганическая химия. М.: Химия, 1987. 132 с.
7.В. Шротер и др. Химия. /Пер. с нем. В.А. Молочко и др. М.: Химия, 1989. С. 18.
8.М.Х. Карапетьянц, М.Л. Карапетьянц. Основные термодинамические константы неорганических и органических веществ. М.: Химия, 1968. 470 с.
9.Р.А. Лидин, Л.Л. Андреева, В.А. Молочко. Справочник по неорганиче- ской химии. М.: Химия, 1987. 320 с.
47
ОГЛАВЛЕНИЕ
ВВЕДЕНИЕ.................................................................................................... |
3 |
§1. ОСНОВНЫЕ ПРИНЦИПЫ И СПОСОБЫ ПОЛУЧЕНИЯ |
|
ПРОСТЫХ ВЕЩЕСТВ................................................................................. |
4 |
§2. ОСОБО ЧИСТЫЕ ВЕЩЕСТВА............................................................ |
8 |
§3. ХИМИЧЕСКИЙ ЭЛЕМЕНТ И ПРОСТОЕ ВЕЩЕСТВО.................. |
10 |
§4. КРИСТАЛЛОХИМИЧЕСКОЕ СТРОЕНИЕ ПРОСТЫХ ВЕЩЕСТВ
........................................................................................................................ |
|
13 |
§5. АЛЛОТРОПИЯ И ПОЛИМОРФИЗМ.................................................. |
23 |
|
§6. МЕТАЛЛЫ И НЕМЕТАЛЛЫ............................................................... |
24 |
|
§7. ФИЗИЧЕСКИЕ СВОЙСТВА ПРОСТЫХ ВЕЩЕСТВ....................... |
29 |
|
§8. ХИМИЧЕСКИЕ СВОЙСТВА ПРОСТЫХ ВЕЩЕСТВ...................... |
41 |
|
КОНТРОЛЬНЫЕ ВОПРОСЫ.................................................................... |
42 |
|
ПРИЛОЖЕНИЕ 1. |
НОМЕНКЛАТУРА ПРОСТЫХ ВЕЩЕСТВ............ |
43 |
ПРИЛОЖЕНИЕ 2. |
СТРУКТУРА ПРОСТЫХ ВЕЩЕСТВ...................... |
45 |
БИБЛИОГРАФИЧЕСКИЙ СПИСОК....................................................... |
46 |
|
Учебное издание
Простое вещество
Составитель: Кириченко Эдуард Александрович
Редактор Т.П. Бабокина Компьютерная верстка Н.А. Емельянова
Лицензия ЛР №020714 от 02.02.98. Подписано в печать 10.11.2000 Формат 60х84 1/16. Бумага типографская №2. Отпечатано на ризографе. Усл. печ. л. 2,59. Уч. - изд. л. 1,50. Тираж 150 экз. Заказ №
Российский химико-технологический университет им. Д.И. Менделеева Новомосковский институт. Издательский центр
Адрес университета: 125047 Москва, Миусская пл., 9 Адрес института: 301670 Новомосковск, Тульской обл., Дружбы, 8
