
ред.Рыбкиной - Простое вещество (2000)
.pdf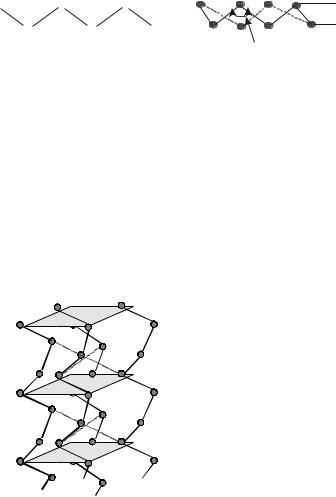
|
|
|
|
21 |
. . |
.S. |
. . |
.S. |
0,205 нм |
.S. |
|
.S. |
|
|
|
|
|
|
1080 |
|
1) |
|
|
2) |
Рис. 4.11. Структура серы: 1) зигзагообразная цепь; 2) зигзагообразная цепочка, замкнутая в восьмичленное кольцо.
Таблица 4. 2
Расстояния между атомами в структурах ромбической серы, селена и теллура
|
|
|
|
|
|
Sромб. |
|
Se |
Te |
|
Расстояние между атомами в слое, нм |
|
0,210 |
|
0,232 |
0,286 |
|||||
Расстояние между атомами соседних слоев, нм |
0,330 |
|
0,346 |
0,374 |
||||||
|
|
|
|
|
|
|
Элементы VIIA груп- |
|||
|
|
|
|
|
пы (галогены), в соответствии |
|||||
|
|
|
|
|
с правилом 8-N, должны в |
|||||
|
|
|
|
|
||||||
|
|
|
|
|
кристаллах |
простых |
веществ |
|||
|
|
|
|
|
иметь |
координационное чис- |
||||
|
|
|
|
|
ло, равное 1, т.е. каждый атом |
|||||
|
|
|
|
|
может |
иметь лишь |
одного |
|||
|
|
|
|
|
близлежащего соседа, и моле- |
|||||
|
|
|
|
|
кулы состоят из двух атомов. |
|||||
|
|
|
|
|
Галогены в твердом состоянии |
|||||
|
|
|
|
|
||||||
|
|
|
|
|
(иод при обычных условиях, а |
|||||
|
|
|
|
|
остальные при низких темпе- |
|||||
|
|
|
|
|
ратурах) образуют молеку- |
|||||
Рис. 4. 12. Структура гексагональных |
лярные |
|
|
кристаллические |
||||||
структуры, |
в которых между |
|||||||||
селена и теллура |
атомами в |
|
гантелеобразных |
|||||||
|
|
|
|
|
молекулах |
расстояния значи- |
||||
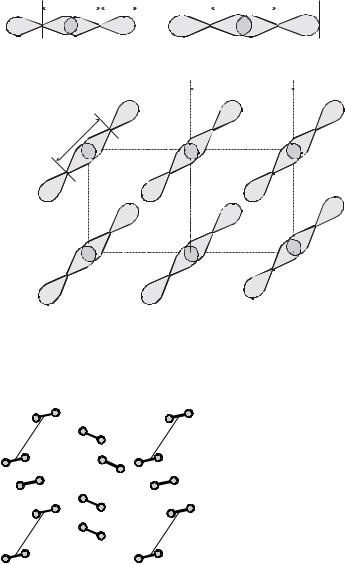
тельно меньше, чем между молекулами. Так, для хлора длина связи в моле- куле 0,202 нм, а расстояние между молекулами в кристалле 0,334 нм (рис. 4.13). На рис. 4.14 приведена кристаллическая решетка иода.
|
|
|
|
|
|
|
22 |
|
|
|
|
|
|
|
|
|
||
F2 |
|
|
|
|
|
|
|
|
|
|
|
Cl2 |
||||||
0,130 нм |
|
0,067 нм |
|
|
|
|
|
|
0,202 нм |
|
|
|||||||
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1) |
|
|
|
|
2) |
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
0,334 нм |
|||||
|
|
|
м |
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
н |
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
,2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3)
Рис. 4.13. Молекулы галогенов: 1) молекула фтора (F2); 2) молекула хлора (Cl2); 3) кристаллическая решетка хлора.
|
|
|
|
|
|
Наконец, |
прави- |
|
|
|
|
|
|
ло Юм-Розери можно |
|||
|
|
|
|
|
||||
|
|
|
|
|
применить и к элементам |
|||
|
|
|
|
|
VIIIA группы (благород- |
|||
|
|
|
|
|
ные газы). В соответст- |
|||
|
|
|
|
|
||||
|
|
|
|
|
вии с этим правилом, при |
|||
|
|
|
|
|
образовании кристаллов |
|||
|
|
|
|
|
простых |
веществ |
коор- |
|
|
|
|
|
|
||||
|
|
|
|
|
динационное |
число |
||
|
|
|
|
|
должно быть равно ну- |
|||
|
|
|
|
|
лю. Действительно, кри- |
|||
|
|
|
|
|
||||
Рис. 4.14. Кристаллическая решетка иода. |
сталлы |
благородных га- |
||||||
зов состоят из одноатом- |
||||||||
|
|
|
|
|
||||
23
ных молекул, связанных силами Ван-дер-Ваальса.
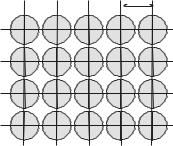
В кристаллической решетке какого-либо из указанных веществ расстояние между центрами атомов сравнимо с их удвоенным радиусом (рис. 4.15).
0,394 нм
Рис. 4. 15. Кристаллическая решетка аргона.
§5. АЛЛОТРОПИЯ И ПОЛИМОРФИЗМ
При рассмотрении простых веществ мы сталкиваемся с явлением аллотропии – существованием атомов одного и того же элемента в виде различных простых веществ за счет разного состава и строения молекул, хотя построены эти молекулы из атомов одного и того же элемента. Кисло- род существует в виде O2 и O3; сера – в виде S2, S4, S6, S8; углерод в газовой
фазе – в виде C2, C3, C4, C5, C6; C7.
При переходе в кристаллическое состояние возникают различные кристаллические структуры: сера – моноклинная, ромбическая, пластиче- ская; фосфор – белый, красный, черный; углерод – алмаз, графит, карбин; олово – белое и серое и т.д.
Существование для вещества одного химического состава несколь- ких кристаллических форм называется полиморфизмом.
Например, сера ромбическая и моноклинная, представлена на рис. 5.1, углерод в виде графита и алмаза – на рис. 5.2. Однако, для простых ве- ществ явление полиморфизма часто подводят под одно общее название – аллотропия.
Поэтому говорят об аллотропных модификациях углерода, хотя казалось бы, нужно говорить о полиморфных формах углерода: алмаз, гра- фит, карбин. Или говорят об аллотропии олова, хотя имеют в виду поли- морфные формы существования олова (серое и белое), которые различаются кристаллической структурой. Серое олово (α-Sn) имеет алмазоподобную структуру, ρα-Sn = 5,75 г/см3, устойчиво при температуре ниже 13,2 °С. Белое
24
олово (β-Sn) - металлическая форма олова имеет характерную для металлов структуру, ρβ-Sn = 7,29 г/см3, устойчиво при температуре выше 13,2 °С. При понижении температуры переход белого олова в серое (этот процесс идет быстрее, если в белое олово попали кристаллики серого олова – “оловянная чума”) сопровождается резким увеличением объема и разрушением изделий или соединений из олова.
Многие простые вещества существуют в нескольких аллоропных формах. Например, плутоний имеет 6 аллотропных форм, фосфор – 4 и т.д. Поэтому при наличии немногим более 100 элементов существует около 400 простых веществ.
§6. МЕТАЛЛЫ И НЕМЕТАЛЛЫ
То, что в простом веществе взаимодействуют абсолютно одинако- вые атомы, создает возможности для возникновения только двух вариантов химической связи: ковалентной неполярной и металлической.
Именно наличие возможности в простых веществах возникновения только этих двух видов связи разделило все простые вещества на две груп- пы по своим свойствам: неметаллы и металлы.
Следует иметь в виду, что и металлическая, и ковалентная связь в чистом виде в простых веществах встречается нечасто (алмаз, O2, N2, Cl2, щелочные металлы и некоторые другие немногие случаи). Более обычной является ситуация, когда между атомами простого вещества осуществляется и металлическая, и ковалентная связь. Обозначив условно общую величину химической связи в простом веществе через Ψобщ. связ., а ковалентную и ме-
таллическую составляющие соответственно через Ψковал. и Ψметалл., мы мо- жем выразить эту ситуацию через выражение:
Ψобщ. связ. = С1Ψковал. + С2Ψметалл.
Превалирование той или иной связи позволяет относить данное простое вещество или к металлам, или к неметаллам.
Относить то или иное простое вещество к одной из этих групп не всегда просто. Единственным надежным критерием, позволяющим разли- чать металлы и неметаллы в кристаллическом состоянии, служит знак тем- пературного коэффициента электрической проводимости (у металлов – от- рицательный, т.е. с повышением температуры проводимость уменьшается, а у неметаллов – положительный, т.е. электрическая проводимость неметал- лов с повышением температуры повышается).
Однако и из этого правила есть исключения. Графит с повышением температуры уменьшает свою электрическую проводимость, т.е. ведет себя как металл, однако во всем остальном это типичный неметалл.
Знание электронного строения атомов позволяет нам определить положение представителей этих групп в периодической системе Д.И. Мен- делеева и сделать некоторые выводы об их строении и свойствах. Ковалент-
25
ная связь или металлическая превалирует в данном простом веществе, оп- ределяется электронным строением атома. Для образования ковалентной связи атомы должны обладать количеством валентных электронов, доста- точным для образования устойчивой электронной системы – октета. При нехватке для этого электронов осуществляется коллективное электронно- атомное взаимодействие, т.е. металлическая связь.
α− сера |
β− сера |
Рис. 5.2. Форма кристаллов ромбической (α-S) и моноклинной (β-S)
|
|
а) |
|
|
б) |
1) |
2) |
3) |
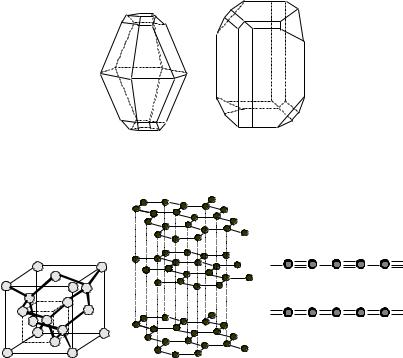
Рис. 5.1. Структура алмаза (1), графита (2) и карбина (3) – модификации а) и б)
На этой основе в периодической системе можно провести верти- кальную границу между элементами IIIA и IVA групп в длиннопериодной таблице Д.И. Менделеева. Слева от этой линии расположены элементы с
недостаточным числом валентных электронов для образования октета с валентными электронами соседних атомов. Справа же от этой линии распо-
ложены элементы, имеющие достаточное число валентных электронов для
26
образования устойчивой электронной системы – октета с валентными элек- тронами соседних атомов (рис. 6.1). Эта вериткаль называется границей Цинтля. Ее положение в периодической системе обусловлено тем, что в
соответствии с современными представлениями о механизме образования ковалентной связи, особой устойчивостью обладает полностью завершенная октетная ns2np6- электронная конфигурация, свойственная благородным газам. Поэтому для реализации ковалентного взаимодействия при образова- нии простых веществ необходимо, чтобы каждый атом имел не менее четы- рех валентных электронов, которые с четырьмя внешними электронами со- седних атомов образуют октет.
Четырьмя и более электронами на внешней орбитали обладают элементы IVA, VA, VIA и VIIA групп, поэтому в простых веществах эле- ментов этих групп доминирует ковалентная связь.
Все элементы, располагающиеся слева от границы Цинтля, харак- теризуются дефицитом электронов, в силу чего в плотноупакованных кри-
сталлических структурах соответствующих простых веществ доминирует металлическая связь.
Граница Цинтля не является границей между металлами и неметал- лами, а лишь разграничивает элементы с нехваткой и достаточным числом валентных электронов для образования октета.
Обращает на себя внимание ряд исключений. Так, свинец, распо- ложенный справа от границы Цинтля, обладает плотноупакованной кри- сталлической решеткой с металлическим типом связи. Для последнего представителя VA группы – висмута – характерно координационное число 8, т.е. мы имеем дело не с фиксированными ковалентными связями, а со структурой с металлической связью. Аналогичное положение и с полонием. Объясняется это тем, что с увеличением атомного номера элемента в преде- лах каждой группы возрастает количество электронных слоев и уменьша- ются различия в энергиях соседних орбиталей. Вследствие этого у тяжелых
аналогов при образовании простых веществ валентные электроны могут занимать более высокие вакантные орбитали. В случае свинца, висмута и полония валентные электроны могут попадать на вакантные (в изолирован- ных невозбужденных атомах) 6d-орбитали. При этом число возможных со- стояний превышает число валентных электронов, т.е. наблюдается дефицит электронов, что и приводит к возникновению плотноупакованных структур с металлическим типом связи.
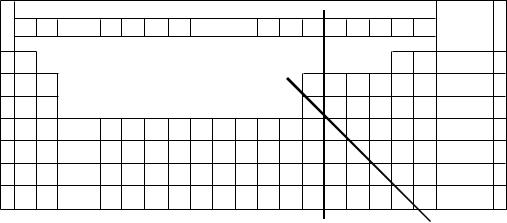
|
|
|
|
|
ПЕРИОДИЧЕСКАЯ |
СИСТЕМА ЭЛЕМЕНТОВ Д.И. МЕНДЕЛЕЕВА |
|
|
|
||||||||||||||||||||||
П |
|
|
|
|
|
|
|
|
|
|
|
Группы элементов |
|
|
|
|
|
|
|
|
|
|
|
|
П |
||||||
е |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Валентная |
е |
|||||||
р |
IA |
IIA |
|
IIIБ |
IVБ |
VБ |
VIБ |
VIIБ |
|
VIIIБ |
|
|
IБ |
IIБ |
IIIA |
IVA |
VA |
VIA |
VIIA VIIIA |
р |
|||||||||||
и |
|
|
|
|
оболочка |
и |
|||||||||||||||||||||||||
о |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
о |
д |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
д |
1 |
H 1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(H) |
He2 |
1s |
1 |
||
2 |
Li |
3 |
4 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
B |
5 |
C |
6 |
N |
7 |
O |
8 |
F |
9 |
10 |
2s 2p 2 |
|
|
Be |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Ne |
|||||||||
3 |
|
11 |
12 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Al |
13 |
Si |
14 |
P |
15 |
S |
16 |
|
17 |
18 |
3s 3p 3 |
|
Na |
Mg |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Cl |
Ar |
|||||||||
4 |
K |
19 |
20 |
|
21 |
22 |
V |
23 |
24 |
|
25 |
26 |
|
27 |
Ni |
28 |
29 |
30 |
|
31 |
|
32 |
|
33 |
|
34 |
|
35 |
36 |
3d 4s 4p |
4 |
|
Ca |
Sc |
Ti |
|
Cr |
Mn |
Fe |
Co |
|
Cu |
Zn |
Ga |
Ge |
As |
Se |
Br |
Kr |
||||||||||||||
5 |
|
37 |
38 |
Y |
39 |
40 |
|
41 |
42 |
Tc |
43 |
44 |
|
45 |
|
46 |
47 |
48 |
In |
49 |
|
50 |
|
51 |
|
52 |
I |
53 |
54 |
4f 5d 6s 6p |
5 |
Rb |
Sr |
|
Zr |
Nb |
Mo |
|
Ru |
Rh |
Pd |
Ag |
Cd |
|
Sn |
Sb |
Te |
|
Xe |
||||||||||||||
6 |
|
55 |
56 |
57 |
71 |
72 |
|
73 |
74 |
|
75 |
76 |
Ir |
77 |
|
78 |
79 |
80 |
Tl |
81 |
|
82 |
Bi |
83 |
|
84 |
|
85 |
86 |
5f 6d 7s 7p 6 |
|
Cs |
Ba |
La - Lu |
Hf |
Ta |
W |
Re |
Os |
|
Pt |
Au |
Hg |
|
Pb |
|
Po |
At |
Rn |
||||||||||||||
7 |
|
87 |
88 |
89 |
* 103 |
104 |
105 |
106 |
107 |
108 |
|
109 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
7 |
||
Fr |
Ra |
Ac - (Lr) Rf |
Db |
Sg |
Bh |
Hn |
Mt |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
** |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Линия Цинтля |
|
|
Линия, отделяющая |
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
металлы от неметаллов |
|||||
* |
57 |
58 |
Pr |
59 |
|
60 |
61 |
62 |
63 |
64 |
65 |
66 |
67 |
68 |
69 |
70 |
71 |
La |
Ce |
|
Nd |
Pm |
Sm |
Eu |
Gd |
Tb |
Dy |
Ho |
Er |
Tm |
Yb |
Lu |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
** |
89 |
90 |
|
91 |
U |
92 |
93 |
94 |
95 |
96 |
97 |
98 |
99 |
100 |
101 |
102 |
103 |
Ac |
Th |
Pa |
|
Np |
Pu |
Am |
Cm |
Bk |
Cf |
Es |
Fm |
Md |
(No) |
(Lr) |
|||
Рис. 6.1. Расположение линии Цинтля и линии, отделяющей металлы от неметаллов, в периодической системе элементов Д.И. Менделеева.

28
С другой стороны, бор, находящийся слева от границы Цинтля, об- ладающий дефицитом валентных электронов, в виде простого вещества ха- рактеризуется неметаллическими свойствами. Из-за кайносимметричности 2p-орбитали, и, вследствие этого, высоких значений потенциала ионизации и электроотрицательности, бор имеет затруднения к обобществлению элек- тронов в пределах всего кристалла. В силу дефицита валентных электронов в кристаллических модификациях бора, наблюдается их обобществление, которое ограничено локальными атомными группами. Поэтому бор образу- ет сложные кристаллические решетки, структурным элементом которых служит икосаэдр (рис. 6.2), который является своеобразным кластером, со- стоящим из 12 атомов бора.
Таким образом, граница между
металлами и неметаллами не совпадает с границей Цинтля, а проходит по
диагонали в общем направлении от бериллия к астату между элементами B-
Al, Si – Ge, As – Sb, Te – Po (рис. 6.1).
Обоснованность диагональной границы между металлами и неметаллами наглядно проявляется в длиннопериодной форме таблицы Д.И. Менделеева (рис.
6.1), в которой элементы Б-групп (переходные металлы), а также
лантаноиды и актиноиды естественным образом располагаются слева от этой границы. Все d- и f-элементы в виде простых веществ образуют плот- ноупавкованные кристаллические структуры с доминирующим металличе- ским типом связи, хотя здесь и проявляется ковалентный вклад, обуслов- ленный наличием дефектных внутренних электронных уровней.
Принадлежность элементов и соответствующих им простых ве- ществ к металлам или неметаллам имеет одну причинность – это свойства атомов элементов, строение их внешних электронных оболочек. Однако,
деление элементов и простых веществ на металлы и неметаллы в известной степени неоднозначно. С одной стороны, металлы и неметаллы различают по их физическим свойствам, которые проявляются у соответствующих простых веществ. Так, для металлов характерны: высокая теплопроводность и электрическая проводимость, отрицательный температурный коэффици- ент электропроводности, специфический металлический блеск, ковкость, пластичность и т.п. Физические свойства неметаллов существенно иные: они хрупки, обладают низкой теплопроводностью и электрической прово- димостью с положительным температурным коэффициентом и др.
С другой стороны, различие между металлами и неметаллами про- является и в химических свойствах: для первых характерны основные свой-
29
ства оксидов и гидроксидов, и восстановительное действие; для вторых – кислотный характер оксидов и гидроксидов, и окислительная активность.
Ориентируясь на физические свойства, к типичным металлам сле- дует отнести, например, медь, серебро, золото, обладающие наиболее высо- кой проводимостью и пластичностью. Однако по химическим свойствам эти вещества вовсе не относятся к типичным металлам, поскольку стоят в элек- трохимическом ряду напряжений металлов правее водорода. В то же время для элементов IA группы, являющихся по химическим свойствам самыми активными металлами, некоторые физические характеристики (например, электрическая проводимость) выражены не так ярко.
Таким образом, подразделяя простые вещества на металлы и неме- таллы, всегда следует иметь в виду, по каким свойствам это деление осуще- ствляется: по химическим или физическим.
Деление на металлы и неметаллы относительно, поскольку сущест- вуют так называемые амфотерные элементы, причем амфотерность их про- является и в физических, и в химических свойствах. При этом следует под- черкнуть, что в данном случае речь идет об амфотерности самих элемен-
тов и соответствующих простых веществ, а не об амфотерности их со- единений в различных степенях окисления.
Амфотерные элементы, как и следовало ожидать, группируются вблизи диагональной границы, разделяющей металлы и неметаллы.
§7. ФИЗИЧЕСКИЕ СВОЙСТВА ПРОСТЫХ ВЕЩЕСТВ
При рассмотрении физических свойств простых веществ и характе- ра их изменения в периодической системе, следует различать влияние на них свойств элементов, а также влияние характера связи между атомами элемента. На физические свойства простых веществ могут влиять обе фор- мы химической организации вещества (молекула и кристалл), или только одна из них.
Очевидно, такие свойства, как температуры плавления и кипения, твердость и вязкость, электрическая проводимость и т.п., относятся только к конденсированному состоянию вещества. С другой стороны, например, магнитные свойства (диа- и парамагнетизм) характерны как для кристаллов, так и для молекул.
Для простых веществ, особенно в конденсированном состоянии, набор физических свойств, т.е. существенных признаков, отличающих одно вещество от другого, весьма обширен.
В качестве примера можно перечислить классы таких характери-
стик:
∙термодинамические свойства (энергия атомизации, энтропия, энталь- пия, температура фазовых превращений и т.п.);
30
·кристаллохимические свойства (тип структуры, аллотропия и поли- морфизм);
·физико-механические свойства (твердость, сжимаемость, внутреннее трение, линейное и объемное расширение и т.п.);
·электрофизические свойства (электронная проводимость, тип, концен- трация и подвижность носителей заряда, ширина запрещенной зоны и т.п.);
·оптические, магнитные и иные свойства.
Разброс количественных характеристик простых веществ по каж- дому из свойств, как правило, очень велик. Несколько примеров:
Ør(H2) = 0,0807 г/см3, r(Li) = 0,53 г/см3, r(Os) = 22,5 г/см3;
Øtпл.(H2) = -259,1 °С, а tпл.(W) = +3410 °С;
Øпо электропроводимости Ag, Cu – лучшие проводники электричества,
(удельное сопротивление 1,49×10-6 ом×см и 1,55×10-6 ом×см) а Bкр., Салмаз – полные изоляторы (удельное сопротивление 1,8×106 ом×см и 5×1014 ом×см);
Øкоэффициент теплопроводности Ag 1,096, а графита 0,00040;
Øэнергия диссоциации двухатомных молекул N2 – 940,5 кДж/моль, Cs2 –
37,95 кДж/моль, Be2 – 58,5 кДж/моль;
Øэнергия атомизации W – (848,5 кДж/моль), Os – (493 кДж/моль), а у инертных газов – 0, у щелочных металлов – (40 – 80 кДж/моль).
Простые вещества имеют широкую гамму цветов: от почти черного
у графита и иода до белого у фосфора. А между ними серебристо-серые разных оттенков большинство металлов, бурый бром, желтое золото, крас- ная медь и т.д.
По пластичности: не поддающиеся какой-либо пластической обра- ботке (ковка, протягивание, прокатка) углерод (алмаз), мышьяк, иод, и в то же время золото прокатывается до фольги толщиной 8×10-5 мм, а медь - 6×10-
4 мм; проволока протягивается из платины до Æ = 1,5×10-2 мм, из серебра – до Æ = 4×10-2 мм.
Твердость металлов колеблется в широких пределах. Например, у Cr твердость по Бринелю 217-236 кг/мм2, а при насыщении водородом – до
650 Па/мм2, а у Rb – 0,022 Па/мм2.
Этот перечень физических свойств простых веществ можно было бы продолжить, однако уже из этого короткого перечисления видно, как велико многообразие этих свойств.
Свойства простых веществ зависят от свойств тех элементов, кото- рые их образуют. Но не в меньшей, а порой и в большей степени свойства
простых веществ зависят от внутреннего строения простого вещества (строение молекулы, кристаллическая структура), что называют кристалло- химическим строением вещества.
