
balans
.pdf′′ |
′ |
|
100% |
|
100% |
|
|||||
mСН О |
= mСН О |
|
|
|
|
= 488,28кг/ час |
|
|
|
= 503,38кг/ час |
|
100% |
−ωпр.СН О% |
100% |
−3% |
||||||||
2 |
2 |
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
2 |
|
|
|
|
|
|
ωСН2О ,% – содержание основного вещества в составе
технического реагента СН2О; ωпр.СН2О ,% – содержание примесей в составе технического
реагента СН2О (% масс.).
7. Масса примесей технического реагента СН2О равна:
′′ |
′′ |
′ |
∆mCH 2O |
= mCH 2O −mCH 2O = 503,38кг / час − 488,28кг / час =15,10кг / час |
|
Аналогичный расчет проводят для реагента Н2 . |
||
8. |
Найдем |
стехиометрическую массу реагента Н2 , |
необходимую для получения заданного количества продукта
СН3ОН :
m |
= |
вM Н2 mСН3ОН |
|
= 2кг/ кмоль 416,67кг/ час = 26,04кг/ кмоль |
|||||||
|
|
|
|
||||||||
Н2 |
|
rMСН ОН |
|
32кг/ кмоль |
|||||||
|
|
|
3 |
|
|
|
|
|
|
|
|
|
9. Масса чистого реагента Н2 |
с учетом его конверсии |
|||||||||
m′Н2 |
|
|
|
|
1 |
|
1 |
|
|
||
= mН2 |
|
|
|
= 26,04кг/ час |
|
= 28,93кг/ час |
|||||
Х |
Н2 |
0,9 |
|||||||||
|
ΧН2 |
– конверсия реагента Н2 |
|
, выраженная в долях. |
|||||||
|
10. |
Масса непревращенного |
остатка реагента Н2 после |
||||||||
окончания процесса:
∆m′H 2 = m′H 2 −mH 2 = 28,93кг/ час−26,04кг/ час = 2,89кг/ час
11. Масса технического реагента Н2 ( m′H′2 ) с учетом его состава:
21
m′H′2 = m′H 2 |
100% |
= 28,93кг/ час |
100% |
= 30,14кг/ час |
100% −ωH 2 ,% |
100% − 4% |
ωН2 ,% – содержание основного вещества в составе технического реагента Н2 ;
ωпр.Н2 ,% – содержание примесей в составе технического
реагента Н2 (% масс.).
12. Масса примесей реагента Н2 (∆ m′Н′2 ) равна:
∆m′′Н2 = m′′Н2 −m′Н2 = 30,14кг/ час − 28,93кг/ час =1,21кг/ час
13. Составляем уравнение материального баланса для
данного процесса:
mCH′′ 2O + m′H′2 = mCH 3OH + ∆mCH′ 2O + ∆m′H 2 + ∆mCH′′ 2O + ∆m′H′2 =
503,38 +30,14 = 416,67 +97,65 + 2,89 +15,10 +1,21
533,52кг/час = 533,52кг/час
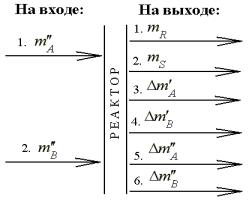
14. Составляем схему материальных потоков на входе и выходе из реактора:
22
15. Составляем таблицу материального баланса
Приход |
|
Расход |
|
|
||
Компонент |
кг/ч |
% масс |
Компонент |
|
кг/ч |
% масс |
1.Технический |
|
|
1. Целевой продукт |
|
|
|
реагент, СН2О |
503,38 |
94,35 |
СН3ОН |
|
416,67 |
78,09 |
в том числе: |
|
|
2. Непревращенный |
|
|
|
|
|
остаток СН2О |
|
97,65 |
18,30 |
|
чистыйСН2О |
488,28 |
91,52 |
|
|||
3. Непревращенный |
|
|
|
|||
примесьСН2О |
15,10 |
2,83 |
|
|
|
|
остаток Н2 |
|
2,89 |
0,54 |
|||
2.Технический |
|
|
|
|||
|
|
4. Примеси реагента |
|
|
|
|
реагент, Н2 |
30,14 |
5,65 |
|
15,10 |
|
|
СН2О |
|
|
||||
в том числе: |
|
2,83 |
||||
|
|
5. Примеси реагента |
|
|
||
чистый Н2 , |
28,93 |
5,42 |
|
1,21 |
|
|
Н2 |
|
0,23 |
||||
примеси Н2 |
1,21 |
0,23 |
|
|
||
|
|
|
|
|||
Итого: |
533,52 |
100,00 |
Итого: |
|
533,22 |
100,00 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
16.Рассчитаем расходные коэффициенты по сырью:
-теоретические
γ |
Т |
= |
а МСН2 |
О |
= |
1 30кг/ кмоль |
= 0,9375 кг/ кг |
СН2О |
r M CH 3OH |
1 32кг/ кмоль |
|||||
|
|
|
|
|
|||
γ |
Т |
= |
|
|
в МН2 |
|
|
|
= |
|
1 2кг/ кмоль |
= 0,0625 кг/ кг |
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
Н2 |
|
r M CH3OH |
|
|
1 32кг/ кмоль |
|
||||||||||
|
|
|
|
|
|
|
|||||||||||
- практические |
|
|
|
|
|
|
|
|
|
||||||||
|
|
φ |
|
|
|
|
′′ |
|
|
|
|
|
503,38кг/ час |
|
|||
γ |
|
= |
mCH 2O |
|
= |
=1,2081 кг/ кг |
|||||||||||
СН2О |
mCH 3OH |
|
416,67кг/ час |
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
φ |
|
|
|
|
m′H′2 |
|
|
|
|
|
30,14кг/ час |
= 0,0723кг/ кг |
|||
|
γН2 |
= |
|
|
|
|
= |
|
|
|
|
||||||
|
|
mCH 3OH |
|
416,67кг/ час |
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
23 |
|
|
|
17.Рассчитаем выход продукта СН3ОН
|
|
|
ΦСН3ОН |
= |
mCH 3OH |
100% |
|
|||
|
|
|
max |
|
||||||
|
|
′ |
|
|
|
|
|
mCH 3OH |
|
|
max |
|
r MCH3OH |
|
488,28кг/час1 32кг/ кмоль |
||||||
|
mCH2O |
|
||||||||
m |
= |
|
|
|
= |
|
|
|
|
=520,83кг/час |
|
|
|
|
|
|
|
||||
CH OH |
|
a MCH O |
|
|
1 30кг/ кмоль |
|
||||
3 |
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
ΦСН3ОН = |
416,67кг/ час 100% =80,00% |
||||||
|
|
|
|
|
520,83кг/ час |
|
||||
24
2.2 Расчет материального баланса простого необратимого процесса с заданной пропускной способностью установки по техническому сырью
Исходные данные
Пропускная способность реактора по техническому реагенту А.......................................
Содержание примесей в реагенте А …………….
Конверсия реагента А …………………………….
Масса технического реагента В, поданного в реактор …………….
Содержание основного вещества Н2 в реагенте В
Реакция для расчета: аА + вВ → rR + sS
m′A′
ωпр. А,%
ХА
m′В′
ωВ ,%
1. Рассчитываем массу чистого реагента А, поданного в химический реактор:
m′A =m′′А |
(100% −ωпр%.А) , либо |
′ |
′′ |
ω%A |
|
|
|
|
|||
100% |
|
mA |
=mA 100% |
||
ω%A – содержание основного компонента, (% масс);
ωпр%.А – содержание примесей в составе технического
реагента А (% масс.).
2.Масса примесей технического реагента А:
∆m′A′ =m′A′ −m′A
3.Находят массу реагента А, израсходованную на
химическое превращение в реакторе: mA =m′A X A
ХА – конверсия, выраженная в долях.
4.Рассчитывают массу непревращенного остатка реагента
Апосле окончания процесса:
∆ m′A= m′A - mA
25
5. Массу реагента В, израсходованного на химическое превращение, рассчитывают по стехиометрии:
mВ = вMВmА
аM А
6. Находят массу чистого реагента В, поданного в реактор:
|
′′ |
% |
) , либо |
|
% |
|
m′В = |
m |
(100% −ωпрВ |
m′В = |
m′′ ωB |
||
|
100% |
|
|
100% |
||
ωпр%.В – содержание примесей в составе технического
реагента В (% масс.); ωВ% – содержание основного компонента, (% масс);
7. Масса примесей в составе технического реагента В:
∆m′В′ =m′В′ −m′В
8. Рассчитывают массу непревращенного остатка реагента В после окончания процесса:
∆ m′В = m′В - mВ
9. Масса целевого продукта, образующегося в результате реакции:
mR = mArMR aMA
10. Если образуется побочный продукт (S), находят его массу:
mS = mAsMS aM A
11.Составляют уравнение материального баланса: m′A′ +m′B′ =mR +mS +∆m′A +∆m′B +∆m′A′ +∆m′B′
12.Составляют схему материальных потоков.
13.Составляют таблицу материального баланса.
26
15. Рассчитывают теоретические и практические расходные коэффициенты, конверсию реагента В, выход целевого продукта.
Пример 2. Расчет материального баланса простого необратимого процесса с заданной пропускной способностью установки по техническому сырью.
Исходные данные могут быть представлены в виде задания, где указана пропускная способность химического реактора (установки) по сырью, например, по техническому реагенту СН2О
Исходные данные
Пропускная способность реактора по техническому |
|
′′ |
||
реагенту СН2О............................................................... |
|
|||
Содержание основного вещества в техническом |
mCH 2O =100кг |
|||
ωCH2O = 93%масс |
||||
СН2О ………………………………………………….. |
||||
Конверсия СН2О ……………………………………. |
ΧСН2О = 0,85 |
|||
Масса технического Н2, …………………………….. |
m′′H 2 |
=100кг |
||
|
|
|||
Содержание чистого вещества Н2 в техническом….. |
ωН2 |
=90%масс |
||
Реакция для расчета: CH2O + Н2 → CH3OH |
|
|
||
1. |
Рассчитаем молярные массы всех участников |
|||
процесса и составим теоретический материальный баланс
CH2O + Н2 → CH3OH
МСН2О =30кг/ кмоль
МН2 = 2кг/ кмоль
МСН3ОН =32кг/ кмоль
27

МСН2О + МН2 = МСН3ОН
30кг/кмоль + 2 кг/кмоль = 32 кг/кмоль
2.Рассчитаем массу чистого реагента СН2О, поданного в химический реактор
mCH′ 2O = mCH′′ 2O ω100CH 2O%,% =100кг10093%% =93кг
ωСН2О ,% – содержание основного компонента, (% масс);
ωпр.СН2О – содержание примесей в составе технического реагента СН2О (% масс.).
3. Масса примесей технического реагента СН2О
∆m′′ =m′′ −m′ =100кг−93кг =7кг.
СН2О СН2О СН2О
4 . Найдем массу реагента СН2О, израсходованную на химическое превращение в реакторе:
mСН |
′ |
О |
XСН2О |
=93кг 0,85 =79,05кг |
2О = mСН2 |
ΧСН2О – конверсия, выраженная в долях.
5.Рассчитаем массу непревращенного остатка реагента СН2О после окончания процесса:
′О = mСН′ 2О −mСН2О =93кг −79,05кг =13,95кг
6. Найдем массу реагента Н2, израсходованного на химическое превращение, согласно стехиометрии:
m = |
вMН |
2 |
mСН О |
= |
1 2кг/ кмоль 79,05кг |
=5,27кг |
|
|
|
2 |
|
||||
аMСН |
|
1 30кг/ кмоль |
|||||
Н2 |
о |
|
|
||||
|
|
|
2 |
|
|
|
|
7. Найдем массу чистого реагента Н2, поданного в реактор:
28
m′H 2 |
= |
m′H′ |
2 ωH 2 ,% |
= |
100кг 90% |
=90кг |
|
100% |
100% |
||||
|
|
|
|
|
ωпр. Н2 ,% – содержание примесей в составе технического реагента Н2, (% масс.);
ωН2 ,% – содержание основного компонента, (% масс);
8.Рассчитаем массу примесей в составе технического
реагента Н2:
∆mН′′2 =mН′′2 −mН′2 =100кг −90кг =10кг
9. Рассчитаем массу непревращенного остатка реагента Н2 после окончания процесса:
∆mΗ′ 2 = mΗ′ 2 −mΗ2 =90кг −5,27кг =84,73кг
10. Масса целевого продукта, образующегося в результате реакции:
m |
= |
mСН О |
r MСН ОН |
= |
79,05кг 1 32кг/ кмоль |
=84,32кг |
2 |
3 |
|
||||
|
|
|
||||
СН ОН |
|
a |
MСН О |
|
1 30кг/ кмоль |
|
3 |
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
11. Составляем уравнение материального баланса:
′′ |
О |
′′ |
′ |
О |
′ |
′′ |
О |
′′ |
mСН2 |
+mН2 |
=mСН3ОН +∆mСН2 |
+∆mН2 |
+∆mСН2 |
+∆mН2 |
100кг+100кг=84,32кг+13,95кг+84,73кг+7кг+10кг 200кг=200кг
29
12. Составляем таблицу материального баланса
Приход |
|
|
Расход |
|
|
||
|
|
|
|
|
|
|
|
Компонент |
кг |
% масс |
|
Компонент |
|
кг |
% масс |
1.Технический |
100,00 |
|
1. |
Целевой продукт |
|
|
|
реагент, СН2О |
50,00 |
СН3ОН |
|
84,32 |
42,16 |
||
в том числе: |
|
46,50 |
2. |
Непревращенный |
|
13,95 |
6,98 |
чистый СН2О |
93 |
остаток СН2О |
|
||||
примеси СН2О |
7,00 |
3,50 |
3. |
Непревращенный |
|
|
|
2.Технический |
|
|
остаток Н2 |
|
84,73 |
42,37 |
|
реагент, Н2 |
100,00 |
50,00 |
4. |
Примеси реагента |
|
|
|
в том числе: |
|
|
СН2О |
|
7,00 |
3,50 |
|
чистый Н2, |
90,00 |
45,00 |
6. |
Примеси реагента Н2 |
|
10,00 |
5,00 |
примеси Н2 |
10,00 |
5,00 |
|
|
|
|
|
Итого: |
200,00 |
100, 00 |
Итого: |
|
200,0 |
100, 00 |
|
|
|
|
|
|
|
|
|
13. Рассчитаем теоретические и практические расходные коэффициенты, конверсию реагента Н2, выход целевого
продукта. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
-теоретические: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
Т |
|
|
|
|
|
а МСН2О |
|
|
|
|
1 30кг/ кмоль |
= 0,9375 кг/ кг |
||||||||||||
γСН2О |
= |
|
|
|
|
|
|
|
|
|
= |
|
|
|
|
|
|
|
|
|||||
|
r M CH 3OH |
|
1 32кг/ кмоль |
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
Т |
|
|
|
|
|
в МН2 |
|
|
|
|
1 2кг/ кмоль |
= 0,0625 кг/ кг |
||||||||||||
γН2 |
= |
|
|
|
|
|
|
|
|
|
|
= |
|
|
|
|
|
|
|
|
|
|||
|
r M CH 3OH |
1 32кг/ кмоль |
||||||||||||||||||||||
|
|
|
|
|
|
|
||||||||||||||||||
- практические |
|
|
′′ |
|
|
|
|
|
|
|
|
100кг |
|
|
|
|
||||||||
|
|
|
|
φ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
γ |
|
|
|
= |
mCH 2O |
|
= |
|
=1,186 кг/ кг |
||||||||||||||
|
|
СН2 |
О |
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
mCH 3OH |
|
|
84,32кг |
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
γ |
φ |
|
= |
|
m′H′ |
2 |
|
|
|
= |
|
|
100кг |
=1,186 кг/ кг |
||||||||
|
|
Н2 |
|
mCH 3OH |
|
|
|
84,32кг |
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
30 |
|
|
|
|
||
