
- •Основные законы фазового равновесия бинарных систем
- •Введение
- •Диаграммы фазового равновесия бинарных систем
- •Основное уравнение фазового равновесия жидкостьпар
- •Законы Коновалова
- •Законы Вревского
- •Для точки азеотропа из третьего закона Коновалова (уравнение (17)) выразим отношение вторых производных потенциала:
- •С учетом (31) уравнение (30) имеет вид:
- •Задания к практическим занятиям
- •По курсу «Физико-химические основы процессов разделения»
- •Задание 1. Обработка и анализ экспериментальных
- •Данных по парожидкостному равновесию бинарных систем
- •Задание 2. Законы Коновалова
- •Задание 3. Законы Вревского
- •Коэффициенты зависимостей давлений насыщенных паров компонентов от температуры [11]
- •Основная литература
- •Дополнительная литература
- •Условные обозначения
- •Индексы
- •Содержание
- •117571 Москва, пр. Вернадского 86.
Для точки азеотропа из третьего закона Коновалова (уравнение (17)) выразим отношение вторых производных потенциала:
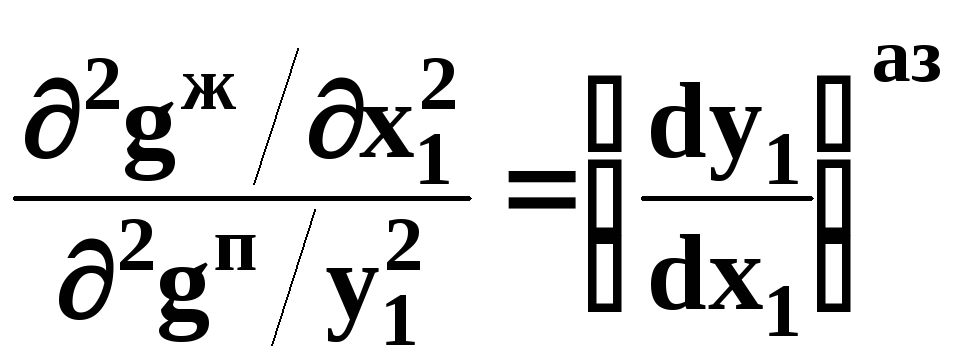 (31)
(31)
С учетом (31) уравнение (30) имеет вид:
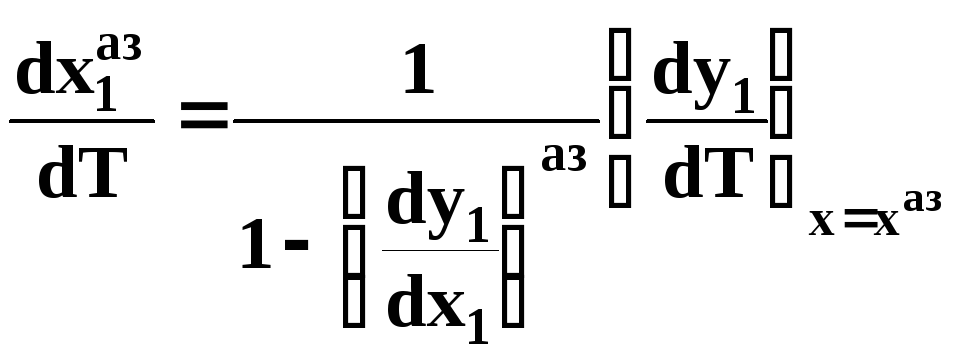 (32)
(32)
Математический вывод третьего закона Вревского базируется на анализе знаков величин, входящих в уравнение (32).
Для
положительного азеотропа
![]() и,
следовательно,
и,
следовательно,
![]() и
и
![]() имеют одинаковые знаки.
имеют одинаковые знаки.
Для
отрицательного азеотропа
![]() и,
следовательно,
и,
следовательно,
![]() и
и
![]() имеют разные знаки.
имеют разные знаки.
Приведем формулировку третьего закона Вревского: при увеличении температуры (давления) и для закрепленного состава жидкой фазы
для положительного азеотропа изменение составов пара и азеотропа происходит однонаправленно (симбатно);
для отрицательного азеотропа изменение составов пара и азеотропа происходит разнонаправленно (антибатно).
Проиллюстрируем действие закона экспериментальными данными, представленными в графическом виде (рис. 6.). В системе с положительным азеотропом (рис. 6а) при увеличении температуры (давления) состав азеотропа обогащается компонентом 1. Для закрепленного состава жидкой фазы в паровой фазе также увеличивается содержание этого компонента ( y’> yаз ). Представленный пример качественно соответствует поведению системы этанол (1)бензол (2). В системе с отрицательным азеотропом (рис. 6б) наблюдаем иную картину: при увеличении температуры (давления) пар обогащается компонентом 2, а азеотропкомпонентом 1 (антибатное изменение).
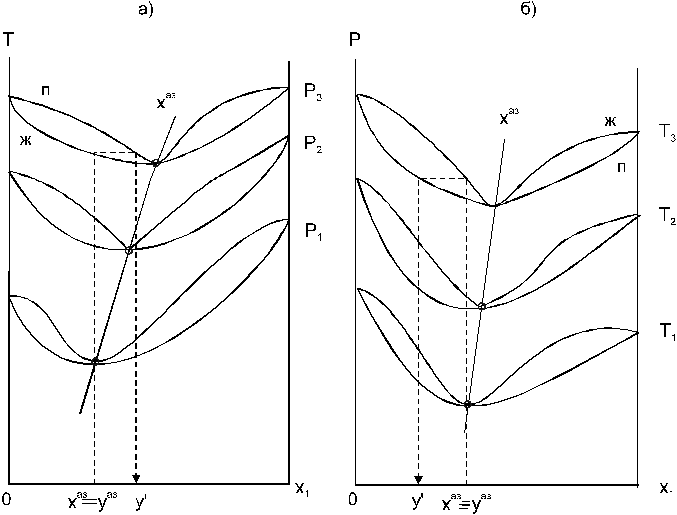
Рис. 6. Графическая интерпретация третьего закона Вревского
в системах с положительным (а) и отрицательным (б) азеотропами.
Р1 < P2 < P3 , T1 < T2 <T3
Действие законов Вревского ограничено критическими параметрами.
Общий анализ уравнения Ван-дер-Ваальса позволил дать математическую экспликацию основных законов парожидкостного равновесия бинарных систем, полученных экспериментальным путем.
Приложение
Задания к практическим занятиям
По курсу «Физико-химические основы процессов разделения»
Задание 1. Обработка и анализ экспериментальных
Данных по парожидкостному равновесию бинарных систем
Построить диаграммы фазового равновесия бинарных систем: ху, Тху (Рху), а также зависимости коэффициентов активности i, коэффициентов распределения кi и относительной летучести компонентов от состава жидкой фазы (по легкокипящему компоненту). Сделать вывод о характере отклонения системы от идеального поведения. При наличии азеотропа определить его тип и параметры.
|
№ |
Система |
Условия равновесия |
Данные ПЖР |
|
1 |
этантиол (1) пентан (2) |
760 мм рт. ст. |
[10, табл. 366] |
|
2 |
ацетон (1) хлороформ (2) |
760 мм рт. ст. |
[10, табл. 167] |
|
3 |
триметилборат (1) – трихлорэтилен (2) |
760 мм рт. ст. |
[18] |
|
4 |
вода (1) – морфолин (2) |
75.2 град. С |
[14] |
|
5 |
|
95.2 град. С |
|
|
6 |
бензол (1) – гептан (2) |
760 мм рт. ст |
[9, табл. 1466] |
|
7 |
|
500 мм рт. ст. |
|
|
8 |
1-бутанол (1) – морфолин (2)
|
90.2,град. С |
[14] |
|
9 |
110.2 град. С |
| |
|
10 |
этанол (1)- пирролидин (2) |
60.2 град. С |
[15] |
|
11 |
бутанол (1) |
65 град. С |
[17] |
|
12 |
диметилформамид(2) |
125 град. С |
|
|
13 |
винилацетат (1) – этанол (2) |
300 мм рт. ст. |
[10, табл. 331] |
|
14 |
|
700 мм рт. ст. |
|
|
15 |
вода (1) – этиленгликоль (2) |
760 мм рт. ст. |
[9, табл. 311] |
|
16 |
хлорбензол (1) нитробензол (2) |
95 град. С |
[20] |
|
17 |
ацетон (1) – метанол (2) |
35 град. С |
[10, табл. 216] |
|
18 |
|
45 град. С |
|
|
19 |
2метил2пропанол (1) хлорбензол (2) |
760 мм рт. ст. |
[19] |
|
20 |
фенол (1) – бензиловый спирт (2) |
75 мм рт. ст |
[16] |
