
- •Основные законы фазового равновесия бинарных систем
- •Введение
- •Диаграммы фазового равновесия бинарных систем
- •Основное уравнение фазового равновесия жидкостьпар
- •Законы Коновалова
- •Законы Вревского
- •Для точки азеотропа из третьего закона Коновалова (уравнение (17)) выразим отношение вторых производных потенциала:
- •С учетом (31) уравнение (30) имеет вид:
- •Задания к практическим занятиям
- •По курсу «Физико-химические основы процессов разделения»
- •Задание 1. Обработка и анализ экспериментальных
- •Данных по парожидкостному равновесию бинарных систем
- •Задание 2. Законы Коновалова
- •Задание 3. Законы Вревского
- •Коэффициенты зависимостей давлений насыщенных паров компонентов от температуры [11]
- •Основная литература
- •Дополнительная литература
- •Условные обозначения
- •Индексы
- •Содержание
- •117571 Москва, пр. Вернадского 86.
Основное уравнение фазового равновесия жидкостьпар
Для бинарных двухфазных систем уравнение фазового равновесия получено Ван-дер-Ваальсом. Оно позднее было обобщено на многокомпонентные системы А.В.Сторонкиным 7. В работах кафедры получена модифицированная форма уравнения Ван-дер-Ваальса-Сторонкина.
Вывод уравнений
фазового равновесия жидкость-пар
базируется на выражении разности нулевых
потенциалов (![]() )
фаз в координатах функции Гиббса (
)
фаз в координатах функции Гиббса (![]() ).
).
Приведем основные уравнения, используемые для вывода:
- уравнения нулевого потенциала
![]() (5)
(5)
![]() (5а)
(5а)
- уравнения функции Гиббса:
![]() (6)
(6)
![]() (6а)
(6а)
Из (6), (6а) с учетом
![]() ,
,![]() ,
следует:
,
следует:
![]() (7)
(7)![]() (7а)
(7а)
- условия фазового равновесия
![]() (8)
(8)
Тогда уравнение парожидкостного равновесия бинарной системы для процесса испарения (фазовый переход жидкость пар) выглядит следующим образом:
![]() (9)
(9)
где множители при дифференциалах температуры и давления энтропийный и объемный эффекты фазового перехода жидкостьпар при образовании 1 моля паровой фазы из бесконечно большого количества жидкой фазы. Здесь и далее необходимо помнить, что производные берутся при постоянных Т и Р.
![]() (10)
(10)
![]() (11)
(11)
Соответственно, для процесса конденсации (фазовый переход пар жидкость) уравнение равновесия запишем в следующем виде:
![]() (12)
(12)
где
![]() соответственно,
энтропийный и объемный
эффекты фазового перехода паржидкость при
образовании 1 моля жидкой фазы из
бесконечно большого количества паровой
в изобарно-изотермических условиях.
соответственно,
энтропийный и объемный
эффекты фазового перехода паржидкость при
образовании 1 моля жидкой фазы из
бесконечно большого количества паровой
в изобарно-изотермических условиях.
Отметим,
что фазовые эффекты рассмотренных
переходов имеют разные знаки, при этом
![]()
![]() ,
,![]()
![]() .
Равенство
этих величин справедливо
только
для однокомпонентных систем и для
азеотропных составов.
.
Равенство
этих величин справедливо
только
для однокомпонентных систем и для
азеотропных составов.
Подробный вывод уравнений (9) и (12) дается в лекциях.
В случае однокомпонентных систем все концентрационные слагаемые в выражении (9) исчезают, и оно переходит в известное уравнение Клаузиуса-Клапейрона:
![]() (13)
(13)
в котором
![]() - молярная теплота испарения вещества.
- молярная теплота испарения вещества.
Уравнения Ван-дер-Ваальса содержат информацию о растворе и фазовых переходах и являются полной математической моделью фазового равновесия. Последнее позволяет использовать эти уравнения для математического вывода основных законов ПЖР.
Рассмотрим частные формы уравнения Ван-дер-Ваальса для фазового перехода жидкость пар в бинарной системе. В изотермических условиях (Т=const,dТ = 0) выражение (9) преобразуется к виду:
![]() (14)
(14)
В изобарических условиях (Р = const)dP= 0. Тогда справедливо:
![]() (15)
(15)
Соответственно, в изотермо–изобарических условиях (Р, Т = const) имеем:
![]() .
(16)
.
(16)
Используя уравнения Ван-дер-Ваальса и его частные формы для равновесия жидкость–пар бинарной системы, дадим математическую интерпретацию известных законов Коновалова и Вревского. Выводы базируются на анализе знаков всех величин, входящих в конкретное уравнение.
Законы Коновалова
Законы Коновалова лежат в основе теории процессов перегонки и ректификации бинарных смесей. Они действуют в условиях изменения одной переменной и устанавливают связь между изменениями составов фаз и давлением (температурой), т.е. описываются частными формами уравнения Ван-дер-Ваальса.
Первый закон Коновалова.
Первый закон Коновалова относится к азеотропным точкам. Преобразуем частные формы уравнения Ван-дер-Ваальса (14) и (15):
![]() (14а)
(14а)
![]() (15а)
(15а)
В точке азеотропа
составы фаз равны: ![]() ,
т.е.
,
т.е.![]() .
.
Вторая производная
![]() - конечная величина, знак которой
определяется типом экстремума зависимости
- конечная величина, знак которой
определяется типом экстремума зависимости![]() потенциала
от состава. Для устойчивых фаз эта
величина всегда положительна.
потенциала
от состава. Для устойчивых фаз эта
величина всегда положительна.
При фазовом
переходе жидкостьпар
объем и энтропия системы увеличиваются:![]() на
величину изменения объема при испарении;
на
величину изменения объема при испарении;![]() на
величину энтропии испарения, т.е.
на
величину энтропии испарения, т.е.![]() характеризуются положительным конечным
значением.
характеризуются положительным конечным
значением.
Следовательно,
равенства (14а) и (15а) будут выполняться
только при
![]() и
и
![]() ,
что соответствует наличию экстремума
на зависимостях
,
что соответствует наличию экстремума
на зависимостях
![]() и
и
![]() .
.
Приведем две формулировки закона Коновалова:
- если давление (либо температура) сосуществования двух бинарных фаз имеют экстремум (максимум или минимум), то фазы имеют одинаковые составы;
- вдоль изотермы (изобары) в
азеотропной точке наблюдается экстремум
на зависимости
![]() (
(![]() ).
).
Рис.
1 может служить графической иллюстрацией
данного закона. Если бинарная смесь
имеет точку, которая характеризуется
равенством составов паровой и жидкой
фаз, то на концентрационных зависимостях
![]() при постоянной температуре (
при постоянной температуре (![]() при
постоянном давлении) этому составу
отвечает экстремальное значение давления
(температуры).
при
постоянном давлении) этому составу
отвечает экстремальное значение давления
(температуры).
Следует отметить, что обсуждаемые экстремумы являются относительными, т. к. реализуются при определенных закрепленных условиях.
Азеотропные данные (состав, температура, давление) являются необходимой информацией при разработке принципиальных технологических схем разделения бинарных и многокомпонентных смесей. Они публикуются в периодической физико-химической литературе, а также приводятся в специальных справочниках [8, 9].
Вывод о наличии либо отсутствии азеотропа можно сделать и при анализе экспериментальных данных о ПЖР. Однако чаще всего точные азеотропные параметры в наборах данных не приводятся (табл.1,2). В этом случае необходимо соответствующим образом обработать экспериментальную информацию (задание 1), руководствуясь следствием из первого закона Коновалова.
Следствие
из первого закона Коновалова
относится к
характеру хода зависимости коэффициентов
распределения компонентов от состава
![]() вблизи азеотропа: в окрестности
особой точки
вблизи азеотропа: в окрестности
особой точки
![]() для положительного азеотропа и
для положительного азеотропа и![]() для отрицательного.
для отрицательного.
Таблица 1.
Данные парожидкостного равновесия
в системе этанол (1) –вода (2) [10]
-
x1
50 град. С
70 град. С
y1
Р
y1
Р
мольн. %
мм рт. ст.
мольн. %
мм рт. ст.
0
0
92.5
0
233.8
11.00
47.38
161.4
46.62
405.4
24.70
57.53
187.2
56.04
463.5
38.80
62.70
199.3
61.39
492.8
50.50
66.81
206.75
65.78
511.1
58.10
69.89
211.0
69.07
521.4
72.40
77.35
217.6
76.81
537.0
80.80
82.86
220.1
82.47
542.4
89.90
90.19
221.47
89.95
544.7
92.45
92.50
221.5
92.29
544.5
95.37
95.31
221.5
95.15
543.9
97.31
97.24
218.7
97.13
543.3
100.0
100.0
220.8
100.0
541.2
Таблица 2.
Парожидкостное равновесие в системе вода (1) –муравьиная кислота (2)
при 50 мм рт. ст. [9]
-
x1
y1
t
x1
y1
t
мольн. %
град. С
мольн. %
град. С
0
0
28.5
62.4
65.5
42.1
17.8
4.2
33.7
66.3
70.9
41.9
23.8
9.4
35.3
74.0
82.2
41.3
36.3
20.0
38.7
78.5
86.6
40.8
42.9
28.7
40.0
82.5
90.5
40.4
50.4
43.3
42.0
91.8
95.3
39.8
56.0
53.9
42.3
94.1
97.6
39.3
59.1
61.1
42.3
100.0
100.0
38.4
Второй закон Коновалова справедлив для всех точек, исключая азеотропные и точки чистых компонентов.
Рассмотрим частные формы уравнения Ван-дер-Ваальса (14а) и (15а) при различных соотношениях составов паровой и жидкой фаз. Учтем приведенный выше анализ знаков величин, входящих в уравнения.
Если
![]() ,
то при Т=const
,
то при Т=const
![]() ;
при Р=const
;
при Р=const
![]() .
.
Если
![]() ,
то при Т=const
,
то при Т=const
![]() ;
при Р=const
;
при Р=const
![]() .
.
Дадим
объединенную формулировку второго
закона Коновалова для изобарических
(изотермических) условий: пар по
сравнению с жидкостью обогащен тем
компонентом, добавление которого в
жидкую фазу (![]() )понижает
ее температуру кипения
)понижает
ее температуру кипения
![]() (повышает давление над раствором
(повышает давление над раствором![]() ).
).
Графическая
интерпретация закона для зеотропных
смесей представлена на рис. 2. Как видно,
пар по сравнению с жидкостью обогащен
первым компонентом (![]() )
– компонентом, при добавлении которого
к жидкой фазе
)
– компонентом, при добавлении которого
к жидкой фазе
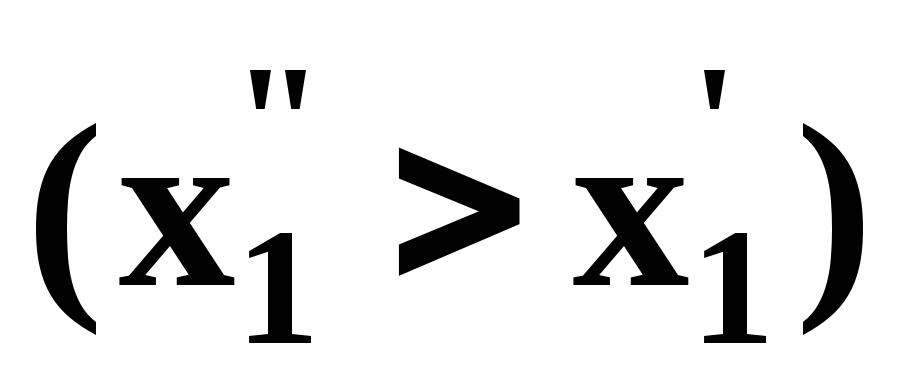 температура вдоль изобары уменьшается
температура вдоль изобары уменьшается
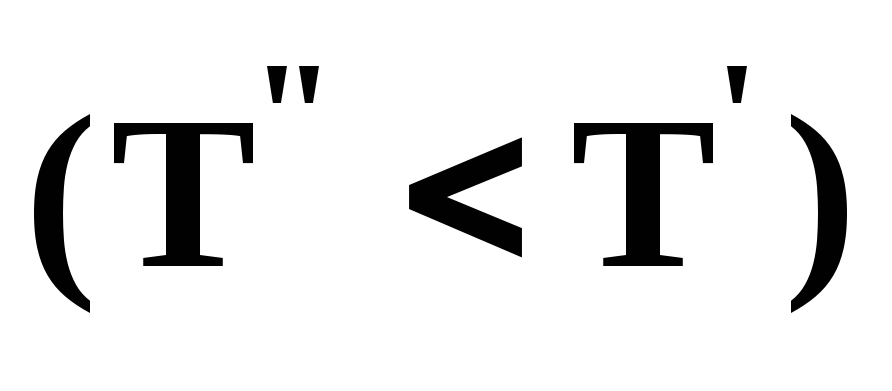 ,
а давление вдоль
изотермы повышается
,
а давление вдоль
изотермы повышается
 .
.
В таблице 1 приведены экспериментальные данные ПЖР, позволяющие проиллюстрировать закон Коновалова на примере системы с положительным азеотропом. Рассмотрим данные при 70 град.С (х1аз 90 мольн. %). Для области соcтавов жидкой фазы 0<x1<x1азпар обогащается этанолом (y1> x1 ), при добавлении которого к жидкой фазе общее давление над раствором растет. Для составов, расположенных «правее» азеотропаx1аз<x1< 1 пар обогащен водой (y1<x1 ), при добавлении которой к жидкой фазе общее давление над раствором растет. Таким образом, пар по сравнению с жидкостью обогащен тем компонентом, добавление которого в жидкую фазу повышает давление над раствором (для рассмотренного примера).
Третий закон Коновалова.
Запишем для фазовых переходов, соответственно жидкость пар и пар жидкость в изобарических условиях частные формы уравнения Ван-дер-Ваальса:
![]() (15а)
(15а)
![]() (15б)
(15б)
После преобразования получим:
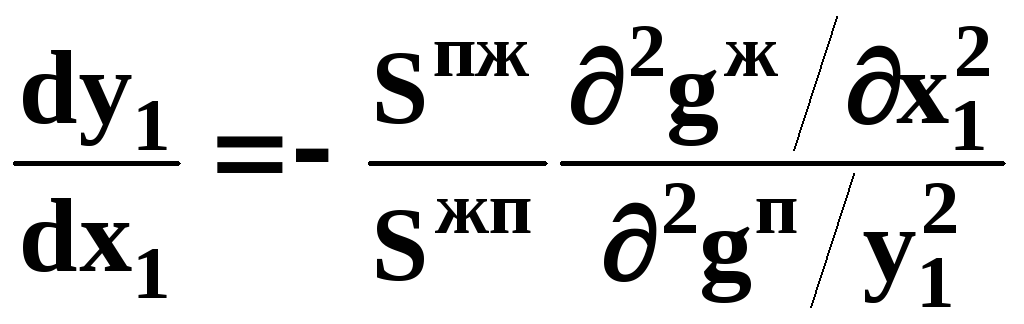 (17)
(17)
В
силу устойчивости фаз вторые производные
![]() потенциала
положительны. Знаки
потенциала
положительны. Знаки
![]() и
и
![]() противоположны. Следовательно,
противоположны. Следовательно,
![]() .
.
Третий закон Коновалова формулируется следующим образом: составы равновесных паровой и жидкой фаз в изотермических и изобарических условиях изменяются однонаправленно (симбатно).
На рис. 4 представлена графическая интерпретация данного закона. Независимо от типа системы при увеличении содержания первого компонента в жидкой фазе (х”1 > x’1) увеличивается его концентрация в паре (y1”>y1’).
Действие 3-го закона Коновалова можно проиллюстрировать и табличными экспериментальными данными. Например, в системе вода (1) – муравьиная кислота (2) при обогащении жидкой фазы водой (см. табл. 2) увеличивается и ее содержание в паровой фазе.
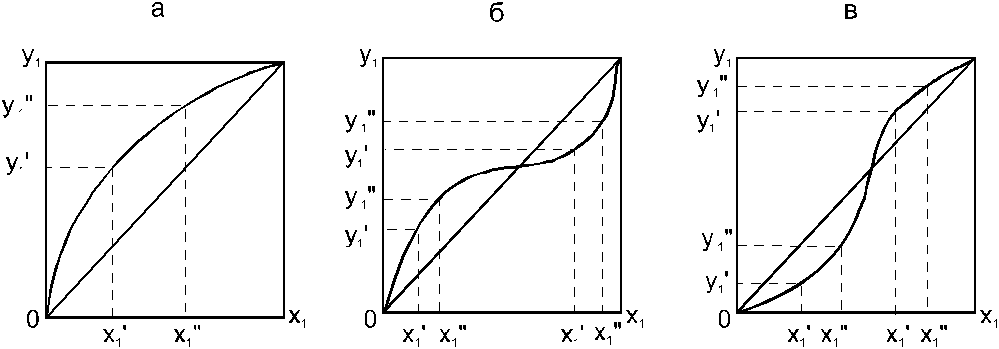
Рис. 4. Графическая интерпретация третьего закона Коновалова:
а - зеотропная смесь; б, в - азеотропные системы.
Следует отметить, что диапазоны условий, в которых действуют законы Коновалова, ограничены. Первый и третий законы не выполняются в критической точке. Область действия второго закона Коновалова ограничена координатой вблизи критической точки: в изотермических условиях точкой, для которой наблюдается нулевой объемный эффект; в изобарических условиях – точкой, где равен нулю энтропийный эффект.
