
ГОС / 52
.doc52. Макроскопической будем называть систему, состоящую из большого числа (большего 1010) хаотически движущихся микрочастиц. Микрочастицы – это атомы, молекулы, элементарные частицы (электроны, фотоны и др.). Признание хаотичности движения частиц означает, что мы принципиально отказываемся от попытки определения микроскопического движения каждой частицы.
Макроскопическую систему можно назвать статистической или термодинамической (в зависимости от статистического или термодинамического подхода). Примером макросистемы является газ в цилиндре, вода в сосуде и т.п. Таким образом, предмет исследования статистической физики и термодинамики один и тот же - макроскопические системы, однако методы исследования разные:
1) Статистический метод.
Э тот
метод является модельным. Он использует
представления о характере взаимодействия
между частицами. В данном методе
макроскопические характеристики системы
считаются случайными величинами и
определяются средние значения этих
величин и устанавливаются физические
законы, связывающие средние значения.
Рассмотрим простую систему (газ в
цилиндре с поршнем) : p(t)
– давление на поршень является сложной
функцией времени вследствие хаотичности
ударов молекул.
тот
метод является модельным. Он использует
представления о характере взаимодействия
между частицами. В данном методе
макроскопические характеристики системы
считаются случайными величинами и
определяются средние значения этих
величин и устанавливаются физические
законы, связывающие средние значения.
Рассмотрим простую систему (газ в
цилиндре с поршнем) : p(t)
– давление на поршень является сложной
функцией времени вследствие хаотичности
ударов молекул.
Необходимо взять среднее значение p(t)
по интервалу времени Т. Это время должно
быть большим по сравнению с временным
интервалом между ударами молекул о
поршень и малым по сравнению с характерным
временем изменения положения поршня.
![]() =
р - это наблюдаемое в эксперименте
давление. Статистическая физика дает
рецепт определения средних значений
физических величин, и как эти средние
(например давление p )
связываются с объемом V
и другими характеристиками системы.
Функциональные связи между статистическими
средними величинами - это и есть законы
статистической физики.
=
р - это наблюдаемое в эксперименте
давление. Статистическая физика дает
рецепт определения средних значений
физических величин, и как эти средние
(например давление p )
связываются с объемом V
и другими характеристиками системы.
Функциональные связи между статистическими
средними величинами - это и есть законы
статистической физики.
2) Термодинамический метод.
В основе термодинамического подхода лежат общие законы природы (закон сохранения и превращения энергии, закон неубывания энтропии в изолированной макроскопической системе и др.), которые формулируются в форме постулатов. Термодинамический метод является общим, не зависит от вида макроскопической системы. Однако он не позволяет получить уравнение состояния, вычислять термические коэффициенты, теплоемкость и другие характеристики конкретных систем. Эти данные (и некоторые зависимости) берутся из эксперимента или определяются методами статистической физики. Система в термодинамическом методе характеризуется небольшим числом макроскопических параметров. Например, простая система характеризуется объемом, давлением. Уравнение же состояния системы в рамках термодинамики преподносится как опытный факт.
Термодинамические параметры.
Под термодинамической системой будем понимать систему, состоящую из большого числа хаотически движущихся частиц, к изучению которой применяется термодинамический метод.
В термодинамическом подходе отказываются от микроскопического изучения систем и пользуются некоторыми исходными постулатами, которые берутся из опыта.
 С макроскопической
точки зрения термодинамическая система
описывается с помощью небольшого набора
физических величин – параметров,
относящихся ко всей рассматриваемой
системе. Различают внутренние и внешние
параметры.
С макроскопической
точки зрения термодинамическая система
описывается с помощью небольшого набора
физических величин – параметров,
относящихся ко всей рассматриваемой
системе. Различают внутренние и внешние
параметры.
Внешние параметры определяются окружающими систему телами.
Внутренние параметры определяются состоянием частиц системы.
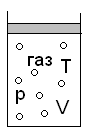
Рассмотрим простую систему – газ в цилиндре с поршнем.
 Поршень зафиксирован:
Поршень зафиксирован:
V – объём – внешний параметр
p –давление – внутренний параметр
T - температура
V – фиксирован окружением
Поршень свободен:
p – давление определяется внешним окружением (грузом)
![]() , S – сечение поршня, p
– внешний параметр
, S – сечение поршня, p
– внешний параметр
V – объём – внутренний параметр
Деление параметров на внешние и внутренние является условным и зависит от ситуации.
Если параметры, характеризующие систему, с течением времени не меняются, и в системе нет стационарных потоков тепла, электричества и др., то такое состояние системы называется равновесным.
С микроскопической точки зрения состояние системы непрерывно меняется, проходя совокупность микросостояний, соответствующих данному макросостоянию. В рамках термодинамики от таких изменений отвлекаются и вводят понятие равновесного состояния как некоторого статического состояния. Равновесное состояние термодинамической системы является абстракцией опытных наблюдений и носит характер постулата.
Если параметры, характеризующие систему с течением времени меняются, то система совершает термодинамический процесс.
Если в термодинамическом процессе система проходит ряд только равновесных состояний, то процесс называется равновесным или квазистатическим.
Равновесный процесс – это идеализация, однако к нему можно приближаться, осуществляя изменение параметров достаточно медленно.
Рассмотрим критерий квазистатичности процесса.
Пусть а – некоторый параметр системы, Δа – изменение параметра.
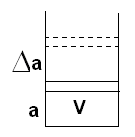 τ – время релаксации (время,
в течение
τ – время релаксации (время,
в течение
которого система придёт в состояние равновесия
после изменения параметра на Δа)
![]() -
скорость прихода системы в состояние
-
скорость прихода системы в состояние
равновесия.
Пусть совершается реальный процесс изменения
параметра а ,
![]() -скорость
процесса изменения параметра а.
-скорость
процесса изменения параметра а.
Условие равновесности процесса:
![]() ,
то есть скорость изменения параметра
в реальном процессе должна быть много
меньше скорости релаксации. Если принять
для простой системы
,
то есть скорость изменения параметра
в реальном процессе должна быть много
меньше скорости релаксации. Если принять
для простой системы
![]() ~
~![]() , где
, где
![]() -
средняя длина свободного пробега
молекул, а
-
средняя длина свободного пробега
молекул, а
![]() - среднее время между столкновениями,
то
- среднее время между столкновениями,
то
![]() и условие равновесности процесса примет
вид:
и условие равновесности процесса примет
вид:
![]()
1. Всякая термодинамическая система, предоставленная самой себе, с течением времени приходит в состояние термодинамического равновесия и самопроизвольно из него выйти не может.
С точки зрения статистической физики система может выходить из данного макросостояния в другое макросостояние с некоторой вероятностью.
Самопроизвольный выход системы из данного макросостояния называется флуктуацией.
2. Если две системы находятся порознь в равновесии с третьей, то они находятся в равновесии между собой.
Свойство транзитивности равновесия говорит о том, что существует некоторый универсальный параметр, не зависящий от вида системы и одинаковый у систем, находящихся в равновесии друг с другом. Этот параметр называется температурой.
Прибор, измеряющий температуру – термометр. Термометр имеет шкалу, на которой каждому значению параметра указывается некоторая числовая величина. Поскольку измеряемая термометром температура зависит от вида термометра, то такая температура называется эмпирической.
3. В состоянии термодинамического равновесия внутренние параметры являются функциями внешних параметров и температуры.
Пример: давление газа в сосуде определяется объемом и температурой.
Термические и калорические уравнения состояния.
Рассмотрим простую термодинамическую систему с параметрами V и T.
Из всех простых систем существует самая простая – это идеальный газ.
Зависимость внутренних параметров от внешних параметров и температуры называется термическим уравнением состояния.
Зависимость внутренней энергии от внешних параметров и температуры называется калорическим уравнением состояния.
р=р(V,T) – термическое уравнение (1.18)
U=U(V,T) – калорическое уравнение (1.19)
Термодинамика не позволяет определить вид этих уравнений, но постулирует их существование.
Для идеального газа термическим уравнением является уравнение Менделеева – Клайперона.
![]() (2.20)
(2.20)
m – масса газа
M – молярная масса газа
R – универсальная газовая постоянная (R=8,31 Дж/моль . К)
Идеальный газ – это система хаотически движущихся молекул, в которой можно пренебречь потенциальной энергией взаимодействия молекул по сравнению с их кинетической энергией.
В качестве калорического соотношения выступает закон Джоуля:
Внутренняя энергия идеального газа при данной температуре не зависит от занимаемого объёма.
U=U(T) (2.21)
Для реального газа одним из термических уравнений является уравнение Ван-дер–Ваальса.
![]() (2.20`)
(2.20`)
Где ν = m/M
– число молей вещества, константа
![]() учитывает взаимодействие молекул,
учитывает взаимодействие молекул,
![]() – их объем.
– их объем.
Внутренняя энергия реального газа зависит не только от температуры, но и от занимаемого объёма: U=U(V,T), причем
![]() (2.21`)
(2.21`)
