
3. Спектр атома водорода
Вид оптических спектров атомов определяется их энергетические спектром. Методами квантовой механики можно получить точное и полное описание спектра для атома, имеющего один электрон, т.е. для атома водорода (и водородоподобных ионов), в то время как задача о многоэлектронных атомах может быть решена лишь приближенно. Можно показать, каким образом в квантовой механике возникает квантование энергии.
Атом является квантовой системой и для его описания следует применить квантово-механическое уравнение Шредингера. Запишем уравнение Шредингера для стационарных состояний:
![]() ,
(2)
,
(2)
где
![]() − лапласиан (оператор Лапласа) (в
декартовых координатах лапласиан равен:
− лапласиан (оператор Лапласа) (в
декартовых координатах лапласиан равен:![]() ),
),
![]() − масса рассматриваемой частицы,
− масса рассматриваемой частицы,
![]() − полная энергия частицы,
− полная энергия частицы,
![]() − потенциальная энергия частицы во
внешнем поле,
− потенциальная энергия частицы во
внешнем поле,
![]() − волновая функция частицы.
− волновая функция частицы.
Решая уравнение (2), находят
волновые функции частицы. Для атома
водорода, например,
![]() -функция
для основного состояния имеет вид
-функция
для основного состояния имеет вид
![]() ,
где
,
где![]() − боровский радиус (
− боровский радиус (![]() м).
м).
Волновая функция должна
удовлетворять так называемым стандартным
условиям, т.е. должна быть конечной,
однозначной и непрерывной (её производная,
кроме того, также должна быть однозначной
и непрерывной). Эти условия могут
выполниться лишь при определенных
значениях полной энергии электрона
![]() .
Это и означает, что энергия атома может
принимать лишь определенные, дискретные
значения, т.е. энергия квантуется.
.
Это и означает, что энергия атома может
принимать лишь определенные, дискретные
значения, т.е. энергия квантуется.
В задаче об атоме водорода волновая функция удовлетворяет стандартным условиям лишь при значениях энергии
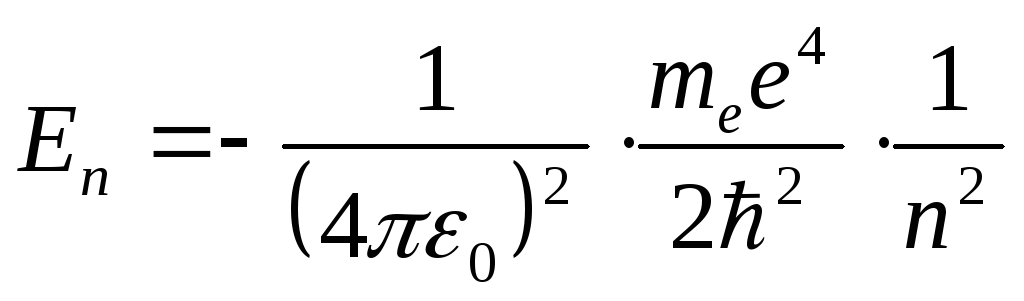 ,
(3)
,
(3)
где
![]() Ф/м
− электрическая постоянная,
Ф/м
− электрическая постоянная,
![]() − масса электрона (
− масса электрона (![]() кг).
кг).
Знак минус означает, что
электрон находится в связанном состоянии.
Число
![]() ,
определяющее значение энергии, называется
главным квантовым числом. Такие же
значения энергии атома водорода
получаются и в “полуклассической”
(или “полуквантовой”) теории Бора.
,
определяющее значение энергии, называется
главным квантовым числом. Такие же
значения энергии атома водорода
получаются и в “полуклассической”
(или “полуквантовой”) теории Бора.
Схема уровней энергии, определяемых формулой (3), дана на рис. 2. Совокупность спектральных линий для атома водорода, таким образом, определяется выражением
![]() ,
(4)
,
(4)
где
 − постоянная Ридберга,
− постоянная Ридберга,![]() с-1,
с-1,
![]() и
и![]() − главные квантовые числа (
− главные квантовые числа (![]() ,
,![]() ).
).
Формула (4) называется формулой Бальмера-Ритца.
Л инии
в спектре атома водорода группируется
вспектральные серии.
При
инии
в спектре атома водорода группируется
вспектральные серии.
При ![]() и
и
![]() получаетсясерия
Лаймана (переходы с
верхних уровней на основной). Эта серия
находите я в УФ
области спектра и не видна глазом. При
получаетсясерия
Лаймана (переходы с
верхних уровней на основной). Эта серия
находите я в УФ
области спектра и не видна глазом. При
![]() и
и
![]() получаетсясерия
Бальмера. Она находится
в видимой части спектра, и именно она
наблюдается и изучается в данной
лабораторной работе. Следующая серия
соответствует
получаетсясерия
Бальмера. Она находится
в видимой части спектра, и именно она
наблюдается и изучается в данной
лабораторной работе. Следующая серия
соответствует ![]() и
и
![]() .
Она называетсясерией
Пашена и лежит в
невидимой ИК-области
спектра. Имеются и другие серии:
.
Она называетсясерией
Пашена и лежит в
невидимой ИК-области
спектра. Имеются и другие серии: ![]() −серия Брэкета,
−серия Брэкета,![]() −серия Пфунда,
−серия Пфунда,![]() −серия Хамфри (рис. 2).
−серия Хамфри (рис. 2).
4. Расчет длин волн видимых линий спектра атома водорода
Учитывая, что глаз человека воспринимает свет с длинами волн 400 - 800 нм, и, пользуясь формулой Бальмера-Ритца, определите, сколько линий атома водорода попадает в видимую часть спектра.
II. Порядок выполнения работы
Целью лабораторной работы является изучение спектра испускания атомарного водорода, вычисление постоянной Ридберга и энергии ионизации атома водорода. Изучить спектр испускания − значит перечислить линии, наблюдаемые в спектре данного вещества и указать соответствующие им длины волн.
