
Khimia / Химия / ХИМИЯ НОВЫЕ ЛАБЫ / лаба 11 / Теоретическая часть
.docТеоретическая часть
Гидролиз – взаимодействие ионов растворенной соли с ионами Н+ и ОН- воды.
В связи с этим процессом в растворе соли могут присутствовать противоположные ионы Н+ или ОН-, которые приводят к изменению рН среды.
Существует 4 типа солей:
-
Сильного основания и слабой кислоты (Na2S, K2CO3)
-
Слабого основания и сильной кислоты ((NH4)2SO4, CuCl2)
-
Слабого основания и слабой кислоты (CuCO3, Al(CH3COO)3)
-
Сильного основания и сильной кислоты (Na2SO4, NaCl)
Гидролиз солей сильного основания и слабой кислоты
Щелочная среда
рН>7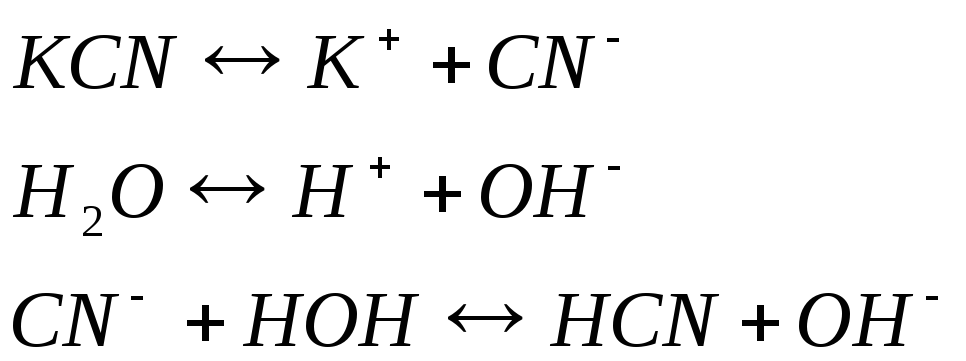

Гидролиз этих солей идет по аниону. Если анион многозарядный, то гидролиз идет по стадиям.
Гидролиз солей слабого основания и сильной кислоты
Кислая среда
pH<7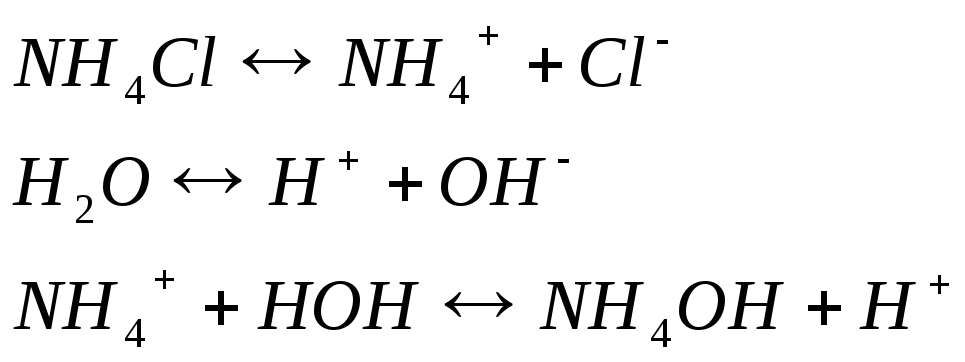

Гидролиз этих солей идет по катиону. Если катион многозарядный, то гидролиз идет по ступеням.
Гидролиз солей слабого основания и слабой кислоты. Идет в 1 стадию, одновременно по катиону и аниону рН около 7.
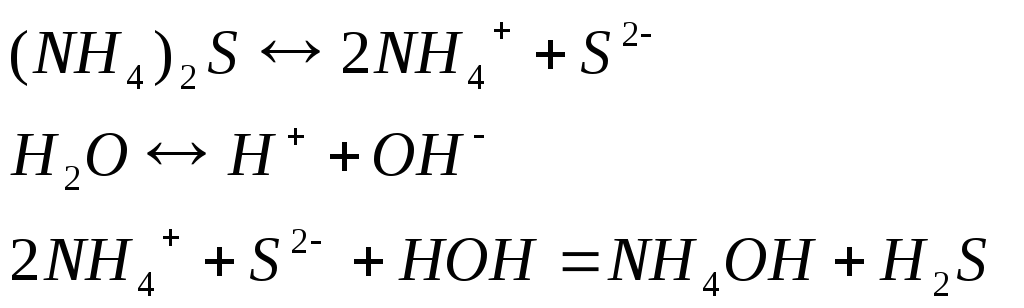
Гидролиз солей сильного основания и сильной кислоты. Гидролизу не подвергаются, т.к ни ион Н+ ни ОН- не взаимодействуют с ионами соли в растворе, т.е не образуется ни слабого основания ни слабой кислоты рН=7.
Гидролиз характеризуется некоторыми показателями:
-
Константой гидролиза
-
Степенью гидролиза
Кгидр=Крав*[НОН]
β – степень гидролиза
![]()
Факторы, влияющие на степень гидролиза:
-
Температура (при повышении температуры, повышается степень гидролиза)
-
Разбавление раствора (более разбавленные растворы имеют более высокую степень диссоциации)
-
Наличие одноименных ионов
Добавление к раствору солей соединений с одноименным ионом, образующимся в процессе гидролиза, приводит к увеличению числа негидролизованных молекул.
Равновесия в растворах электролитов.
В растворах электролитов вещества находятся в диссоциированном состоянии. Между ионами продиссоциировавших веществ и ионами образовавшихся веществ устанавливается равновесие. Взаимодействие между веществами электролитов в растворе происходит по степени взаимодействия между ионами.
Смещение ионных равновесий в растворах электролитов возможно в следующих 4-х случаях:
-
Образование осадка
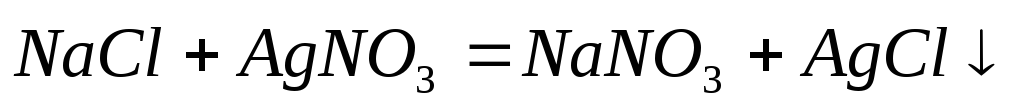
-
Выделение газа

-
Образование слабых электролитов
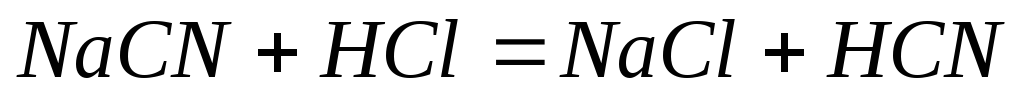
-
Образование комплекса

Произведение
растворимости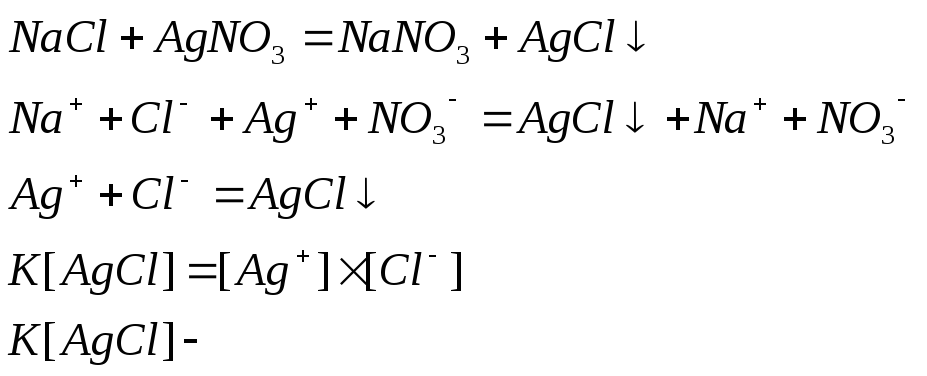
Произведение растворимости (ПР) – произведение концентраций ионов труднорастворимого соединения в насыщенном растворе.
Числовые ПР определены и находятся в таблицах, их используют для расчета концентраций ионов труднорастворимых соединений в растворе заданной концентрации, а также для определения возможности образования осадка при заданной концентрации. Для этого рассчитывают произведение концентрации и сравнивают с произведением растворимости.
![]()
