
Khimia / Химия / ХИМИЯ НОВЫЕ ЛАБЫ / лаба 11 / Конечный результат
.rtfМинистерство образования Российской Федерации
Владимирский Государственный Университет
Кафедра Химии
Лабораторная работа по химии №11
"Направление обменных ионных процессов"
Выполнил
Студент гр. Хб-108
Листвина А.А.
Проверил:
Проф. Орлин Н.А.
Владимир 2008
Теоретическая часть
Электролиты – это вещества, в процессе растворения диссоциирующие на ионы. Процесс диссоциации с количественной точки зрения характеризуется степенью диссоциации [] – она показывает, какая часть молекул в процессе растворения распалось на ионы.
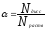
Nдисс – число диссоциированных молекул
Nраств – число растворённых молекул
По величине степени диссоциации электролиты делятся на три группы:
-
Сильные электролиты (NaOH, H2SO4, NaCl) > 0,33
-
Средние электролиты (HNO3, H3PO4) 0,03 < < 0,33
-
Слабые электролиты (H2S, HCN, NH4OH) < 0,33
Равновесие в растворах электролитов, как и всякое химическое равновесие, сохраняется неизменным, пока определяющие его условия не меняются; изменение условий влечет за собой нарушение равновесия.
Равновесие нарушается при изменении концентрации одного из участвующих в этом равновесии ионов: при ее увеличении происходит процесс, в ходе которого эти ионы связываются.
Введение в раствор слабого электролита одноименных ионов (т. е. ионов, одинаковых с одним из ионов электролита) уменьшает степень диссоциации этого электролита. Наоборот, уменьшение концентрации одного из ионов вызывает диссоциацию нового количества молекул.
Растворимость электролита уменьшается от введения в раствор одноименных ионов. Исключением являются те случаи, когда происходит связывание одного из находящихся в растворе ионов с вводимыми ионами в комплексные ионы.
По теории электролитической диссоциации взаимодействие между веществами в растворах электролитов происходит путем взаимодействия между их ионами.
Взаимодействие между ионами в растворах электролитов с образованием конечных продуктов возможно в следующих случаях:
1. образование осадка труднорастворимого соединения;
Если в результате реакции образуются несколько труднорастворимых соединений, то в первую очередь выпадает в осадок наименее растворимое соединение.
2. образование газообразного вещества;
3. образование слабодиссоциируемого соединения;
4. образование комплексов
Выполнение работы
Приборы и реактивы. Штатив с пробирками. Растворы: соляной кислоты - 2н. и 1н., серной кислоты - 2н., 4н. и 1:1, уксусной кислоты – 2н. и 1н., гидроксида натрия – 2н. и 4н., гидроксида аммония – 2н., сульфата меди(II) – 0,5н., хлорида бария – 0,5н., силиката натрия – 0,5н., ацетата натрия – 2н., хлорида аммония – 0,5н., карбоната натрия – 0,5н., Хлорида железа(III) – 0,5н.
Опыт №1. Образование малорастворимых веществ.
В три пробирки нальем по 3 капли следующих растворов: в первую – хлорида железа (III), во вторую – силиката натрия, в третью – разбавленной серной кислоты. Добавим в них по 3 капли растворов: в первую – гидроксида калия, во вторую – соляной кислоты, в третью – хлорида бария. Наблюдаем выпадение осадков во всех трех растворах.
-
FeCl3 + 3KOH → Fe(OH)3↓ + 3KCl
Осадок темного цвета
Fe+3 + 3Cl- + 3K+ + 3OH- → Fe(OH)3↓ + 3K+ + 3Cl-
Fe+3 + 3OH- → Fe(OH)3↓
-
Na2SiO3 + 2HCl → H2SiO3↓ + 2NaCl
Осадок белого цвета
2Na+ + SiO32- + 2H+ + 2Cl- → H2SiO3↓ + 2Na+ + 2Cl-
SiO32- + 2H+ - → H2SiO3↓
-
H2SO4 + BaCl2 → BaSO4↓ + 2HCl
Осадок белого цвета
2H+ + SO42- + Ba2+ + 2Cl- → BaSO4↓ + 2H+ + 2Cl-
SO42- + Ba2+ → BaSO4↓
Взаимодействие между веществами электролитов в растворах происходит по принципу взаимодействия между ионами.
Смещение ионных равновесий в растворах электролитов возможно в следующих четырех случаях: образование осадка, образование газообразных веществ, образование труднодиссоциирующих соединений, образование комплекса.
Вывод: реакции растворов электролитов проходят до конца потому, что в результате их протекания образуются не растворимые в воде вещества.
Опыт №2.Образование слабых кислот и оснований.
В первую пробирку налили 7 капель ацетата натрия (CH3COONa), затем добавили серной кислоты в соотношении 1:1. Содержимое пробирки перемешали стеклянной палочкой и слегка нагрели.
2CH3COONa+H2SO4=Na2SO4+2CH3COOH
2CH3COO-+2Na++2H++SO42-=2Na++SO42-+2CH3COO-+H+
2CH3COO-+2H+=2CH3COOH
В результате реакции образовалась слабая уксусная кислота, о чем свидетельствует запах уксуса.
Во вторую пробирку налили хлорид аммония (NH4Cl) и добавили несколько капель раствора гидроксида натрия. Содержимое пробирки нагрели.
NH4Cl+KOH=KCl+NH4OH
NH4++Cl-+K++ OH-=K++Cl-+NH4++OH-
NH4++ OH-= NH4OH
В результате реакции образовалось слабое основание гидроксида аммония, о чем свидетельствует запах аммиака.
В дальнейшем гидроксид аммония разлагается на аммиак и воду.
NH4OH=NH3+H2O
Вывод: Мы наблюдали смещение ионного равновесия вследствие образования слабых электролитов.
Опыт№3.Реакции нейтрализации.
В 2 пробирки было налито по 6 капель раствора гидроксида калия. Также было добавлено по капле фенолфталеина. Растворы окрасились в малиново-красный цвет под влиянием гидроксид-ионов.
В первую пробирку была добавлена соляная кислота, во вторую – уксусная. Через некоторый промежуток времени растворы щелочи обесцветились. Однако, в первой пробирке этот процесс произошел быстрее.
KOH + HCl → H2O + KCl
K+ + OH- + H+ + Cl- → H2O + K+ + Cl-
OH- + H+ → H2O
KOH + CH3COOH → CH3COOK + H2O
K+ + OH- + CH3COO- + H+ → H2O + K+ + CH3COO-
OH- + H+ → H2O
Исчезновение окраски объясняется тем, что ионы OH- уходят из раствора, соединяясь с ионами Н+ и образуя воду. При наличии в левой части малодиссоциированных молекул уксусной кислоты равновесие смещается в сторону образования воды, так как вода диссоциирует еще хуже, чем уксусная кислота.
Вывод: Реакции ионного обмена идут до конца, если в результате их протекания образуется малодиссоциируемое вещество, такое как вода.
Опыт №4. Образование летучих продуктов реакции.
В две пробирки было налито по 6 капель раствора карбоната натрия.
В первую был так же добавлен хлорид кальция, во вторую – серная кислота.
2Na+ + CO32- + Ca2+ + 2Cl- → 2Na+ + 2Cl- + CaCO3
Выпал белый осадок – карбонат кальция.
2Na+ + CO32- + 2H+ + SO42- → 2Na+ + SO42- + H2O + CO2
Произошло бурное выделение газа – СО2
При дальнейшем добавлении во вторую пробирку хлорида кальция выпадения осадка – карбоната кальция не происходит по причине отсутствия необходимых для его образования ионов CO32- , которые ушли из раствора, провзаимодействовав с ионами Н+ и образовав воду – малодиссоциируемое соединение и углекислый газ, выделение которого наблюдалось в процессе реакции.
Вывод: Реакции ионного обмена идут до конца, если в результате их протекания выделяется газ.
Опыт№5. Образование комплексного соединения.
В пробирку налить 3 капли раствора сульфата меди(II) и добавить по каплям раствор аммиака до растворения выпавшего сначала осадка гидроксида меди и образования комплекса – сульфата тетраамминмеди(II).
CuSO4 + NH4OH = [Cu(NH3)4]SO4
