
Metodichka_KhIMIYa
.pdf
Лабораторный практикум
Метод линейной интерполяции
(для лабораторной работы № 5)
Если измеренное значение плотности точно не соответствует ни одному из значений, приведенных в табл.4 (см лаб. раб. № 5), для расчета массовой доли необходимо использовать метод интерполяции. При этом предполагаем, что плотность раствора линейно зависит от массовой доли растворенного вещества.
Концентрация KCl, % |
0 |
2 |
4 |
6 |
8 |
10 |
Плотность KCl, г/мл |
1,000 |
1,011 |
1,024 |
1,037 |
1,050 |
1,063 |
Пусть измеренная плотность раствора хлорида калия составила 1,032 г/мл. Поскольку для данного значения плотности в таблице нет значения массовой доли, то выписываем интервал значений 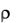 и С, в котором находится измеренное значение плотности:
и С, в котором находится измеренное значение плотности:
–6% |
–1,037 г/мл |
|
4% |
1,024 |
г/мл |
2% |
0,013 |
г/мл . |
Таким образом, при увеличении плотности на 0,013 г/мл массовая доля увеличивается на 2%. Плотность раствора, полученного нами, отличается от плотности 4%-ного раствора KCl на:
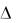 2 = 1,032 – 1,024 = 0,008 г/мл. Составляем пропорцию:
2 = 1,032 – 1,024 = 0,008 г/мл. Составляем пропорцию:
С1 |
|
|
1 |
|
С2 |
|
|
2 |
|
2% |
|
0,013 г/мл |
||
Х% |
|
0,008 г/мл |
||
отсюда Х |
0,008 |
2 |
1,23% . |
|
|
|
|||
0,013 |
||||
|
|
|||
Тогда точная массовая доля хлорида калия в растворе составит:
4 + 1,23 = 5,23% .
59

Химия
Таблица 3
Растворимость солей и оснований в воде
Катион |
|
|
|
|
|
|
|
|
|
Анион |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Li+ |
Na+ |
K+ |
NH4+ |
Ag+ |
Cu2+ |
Mg2+ |
Ca2+ |
Sr2+ |
Ba2+ |
Zn2+ |
Hg2+ |
Sn2+ |
Pb2+ |
Mn2+ |
Al3+ |
Bi3+ |
Cr3+ |
Fe2+ |
Fe3+ |
Cl- |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Н |
Р |
Р |
Р |
М |
Р |
Р |
- |
Р |
Р |
Р |
Br- |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
М |
Р |
Р |
- |
Р |
Р |
Р |
I- |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Н |
Н |
Р |
- |
Р |
Р |
- |
NO3- |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
- |
Р |
Р |
Р |
- |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
S2- |
Н |
Н |
Н |
Р |
Н |
Н |
М |
Н |
- |
Н |
Р |
- |
Н |
Н |
Н |
- |
Н |
- |
Н |
Н |
SO32- |
Р |
Р |
- |
Р |
Н |
Н |
Р |
- |
- |
Н |
Р |
Н |
- |
Н |
Н |
- |
Н |
- |
Н |
- |
SO42- |
Р |
Р |
Р |
Р |
- |
Н |
Р |
Н |
Н |
Н |
Р |
Н |
Р |
Н |
Р |
Р |
- |
Р |
Р |
Р |
CO32- |
Р |
Р |
Р |
Р |
Р |
Н |
М |
Н |
Н |
Н |
Р |
М |
- |
Н |
Н |
- |
Н |
- |
Н |
- |
SiO32- |
Р |
Р |
Р |
Р |
Р |
Н |
Н |
Н |
Н |
Н |
Р |
М |
- |
Н |
Н |
Н |
- |
- |
Н |
Н |
PO43- |
Р |
Р |
Р |
Р |
Р |
Н |
Н |
Н |
Н |
Н |
Р |
Р |
Н |
Н |
Н |
Н |
Н |
Н |
Н |
Н |
CH3COO- |
Р |
Р |
Р |
Р |
Н |
Н |
Р |
Н |
Н |
Н |
Р |
Н |
- |
Р |
Р |
Р |
- |
- |
Р |
- |
OH- |
Р |
М |
Н |
Р |
Н |
Н |
- |
- |
- |
Н |
Р |
- |
Н |
Н |
Н |
Н |
Н |
Н |
Н |
Н |
Обозначения: Р – растворимое вещество (более 1 г на 100 г воды); М – малорастворимое вещество (от 0,1 до 1 г на 100 г); Н – практически нерастворимое вещество (менее 0,1 г на 100 г); прочерк – вещество не существует или разлагается водой.
Таблица 4
Электрохимический ряд напряжений металлов
Элемент |
Li |
K |
Ca |
Na |
Mg |
Al |
Zn |
Fe |
Co |
Ni |
Sn |
Pb |
H2 |
Cu |
Ag |
Hg |
Е0, В |
-3,04 |
-2,92 |
-2,87 |
-2,71 |
-2,37 |
-1,66 |
-0,76 |
-0,44 |
-0,28 |
-0,25 |
-0,14 |
-0,13 |
0 |
0,34 |
0,80 |
0,86 |
|
|
|
|
Усиление восстановительной способности атомов металлов |
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Ион |
Li+ |
K+ |
Ca2+ |
Na+ |
Mg2+ |
Al3+ |
Zn2+ |
Fe2+ |
Co2+ |
Ni2+ |
Sn2+ |
Pb2+ |
2H+ |
Cu2+ |
Ag+ |
Hg2+ |
Усиление окислительной способности ионов металлов
60

Лабораторный практикум
ПЕРИОДИЧЕСКАЯ СИСТЕМА ЭЛЕМЕНТОВ Д.И. МЕНДЕЛЕЕВА (короткопериодный вариант)
период |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Группы элементов |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
I |
|
|
II |
|
|
|
|
III |
|
IV |
|
|
|
|
V |
|
|
VI |
|
|
|
VII |
|
|
|
|
|
|
VIII |
|
|
||||||||
1 |
|
|
|
H) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
1 |
He |
|
|
2 |
|
|
|
|
|
|
|
( |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1,007 |
|
|
|
|
4,0026 |
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
водород |
гелий |
|
|
|
|
||||||||
2 |
|
Li |
|
3 |
Be |
|
4 |
B |
|
|
5 |
C |
6 |
|
N |
7 |
|
|
O |
8 |
F |
|
|
|
9 |
Ne |
|
|
9 |
|
|
|
|
||||||||||
|
|
6,941 |
литий |
9,01бериллий |
10,811 |
|
бор |
12,01 углерод |
14,00 |
азот |
|
|
15,99 кислород |
18,99 |
|
|
фтор |
4,0026 |
гелий |
|
|
|
|
||||||||||||||||||||
3 |
|
Na |
|
11 |
Mg |
|
12 |
Al |
|
|
13 |
Si |
14 |
|
P |
15 |
|
S |
16 |
Cl |
|
|
|
17 |
Ar |
|
|
18 |
|
|
|
|
|||||||||||
|
|
22,98 натрий |
24,305 магний |
26,9алюминий |
28,08кремний |
30,97 фосфор |
|
|
32,06 |
сера |
35,45 |
|
|
хлор |
4,0026 |
гелий |
|
|
|
|
|||||||||||||||||||||||
|
|
K |
|
19 |
Ca |
|
20 |
21 |
|
|
|
Sc |
22 |
|
Ti |
|
23 |
V |
|
|
24 |
|
Cr |
25 |
|
|
Mn |
26 |
|
Fe |
27 |
Co |
28 |
Ni |
|||||||||
4 |
|
39,098 |
калий |
40,07 кальций |
скандий 44,95 |
титан 47,88 |
|
ванадий 50,94 |
|
|
хром |
51,99 |
марганец 54,93 |
железо 55,84 |
кобальт 58,83 |
никель 58,69 |
|||||||||||||||||||||||||||
|
|
29 |
Cu |
30 |
Zn |
Ga |
|
31 |
Ge |
32 |
|
As |
33 |
|
Se |
34 |
Br |
|
|
|
35 |
Kr |
|
|
36 |
|
|
|
|
||||||||||||||
|
|
медь |
63,546 |
цинк |
65,39 |
69,72 |
|
галлий |
72,6 германий |
|
74,92 мышьяк |
|
|
78,96 |
селен |
78,96 |
|
|
бром |
83,80 криптон |
|
|
|
|
|||||||||||||||||||
|
|
Rb |
|
37 |
Sr |
|
38 |
39 |
|
|
|
Y |
40 |
|
Zr |
|
41 |
Nb |
|
|
42 |
|
Mo |
43 |
|
|
Tc |
44 |
|
Ru |
45 |
Rh |
46 |
Pd |
|||||||||
5 |
|
85,46рубидий |
87,6стронций |
иттрий 88,90 |
цирконий 91,2 |
ниобий 92,90 |
|
|
молибден 95,94 |
технеций 97,9 |
рутений101,07 |
родий 102,90 |
палладий 106,4 |
||||||||||||||||||||||||||||||
|
|
47 |
Ag |
48 |
Cd |
In |
|
|
49 |
Sn |
50 |
|
Sb |
51 |
|
Te |
52 |
I |
|
|
|
53 |
Xe |
|
|
54 |
|
|
|
|
|||||||||||||
|
|
серебро107,8 |
кадмий112,41 |
114,82 |
индий |
118,71 |
|
олово |
|
121,75 |
сурьма |
|
|
127,60 теллур |
126,90 |
|
|
йод |
131,29 |
ксенон |
|
|
|
|
|||||||||||||||||||
|
|
Cs |
|
55 |
Ba |
|
56 |
57 |
|
|
|
La* |
72 |
|
Hf |
|
73 |
Ta |
|
|
74 |
|
W |
75 |
|
|
Re |
76 |
|
Os |
77 |
Ir |
78 |
Pt |
|||||||||
6 |
|
132,905 |
цезий |
137,33 барий |
лантан 138,90 |
гафний 178,49 |
|
тантал 180,947 |
|
|
вольфрам183,8 |
рений 186,20 |
осмий |
190,2 |
иридий 192,22 |
платина 195,08 |
|||||||||||||||||||||||||||
|
|
79 |
Au |
80 |
Hg |
Tl |
|
|
81 |
Pb |
82 |
|
Bi |
83 |
|
Po |
84 |
At |
85 |
Rn |
|
|
86 |
|
|
|
|
||||||||||||||||
|
|
золото196,96 |
ртуть |
200,59 |
204,38 |
талий |
207,2 |
|
свинец |
208,98 |
висмут |
|
|
208,98 полоний |
209,98 |
|
|
астат |
222,02 |
радон |
|
|
|
|
|||||||||||||||||||
7 |
|
Fr |
|
87 |
Ra |
|
88 |
89 |
|
|
|
As* |
104 |
|
Ku |
|
105 |
Ns |
|
|
106 (Unh) |
107 |
|
(Uns) |
108 |
(Uno) |
109 (Une) |
110 |
(Unn) |
||||||||||||||
|
|
223,0франций |
226,025 радий |
актиний 227,02 |
курчатовий261 |
нильсборий262 |
|
|
263,11 |
|
262,12 |
|
|
|
265,1 |
|
266,1 |
|
269 |
||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
лантаноиды |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
58 |
|
Pr140,9 |
59 |
|
60 |
|
Pm144,9 |
61 |
|
|
62 |
|
63 |
|
|
|
64 |
|
|
65 |
|
|
66 |
|
|
|
67 |
Er167,2 |
68 |
|
|
69 |
|
70 |
71 |
||||||||
Ce140 |
|
|
|
|
Nd144 |
|
|
|
|
Sm150 |
|
Eu151,9 |
|
|
|
Gd157,2 |
Tb158 |
|
Dy162,5 |
|
Ho164,9 |
|
|
Tm168 |
Yb173 |
Lu174,9 |
|||||||||||||||||
церий |
|
празеодим |
|
неодим |
прометий |
|
самарий |
|
европий |
гадолиний |
|
|
тербий |
|
диспрозий |
|
|
гольмий |
эрбий |
|
|
тулий |
иттербий |
лютеций |
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
актиноиды |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
Th232 |
90 |
|
Pa231,0 |
91 |
|
U238,092 |
Np237 |
93 |
|
Pu24494 |
Am24395 |
|
|
Cm24796 |
Bk247,197 |
|
Cf251 |
98 |
|
|
Es252 |
99 |
Fm257100 |
Md258101 |
No259102 |
Lr260103 |
|||||||||||||||||
торий |
|
протактиний |
уран |
|
|
нептуний |
|
плутоний |
америций |
|
|
|
кюрий |
|
|
берклий |
|
калифорний |
эйнштений |
фермий |
менделевий |
нобелий |
лоуренсий |
||||||||||||||||||||
61

Химия
ЛИТЕРАТУРА
1.Ахметов Н.С. Общая и неорганическая химия: Учебник для студ. хим.-технол. спец. вузов. – М.: Высш. шк., 1998. – 743 с.
2.Глинка Н.Л. Общая химия. Учеб. пособие для студ. нехимич. спец. вузов. – Л.: Химия, 1985. – 702 с.
3.Глинка Н.Л. Задачи и упражнения по общей химии. – Л.: Химия,
1983. – 264 с.
4.Задачи и упражнения по общей химии: Учебн. пособие / Под ред. Н.В. Коровина – М.: Высш. шк., 2004. – 255 с.
5.Коровин Н.В. Общая химия: Учебник для студ. вузов, обуч. по техн. спец.– М.: Высш. шк., 2000. – 558 с.
6.Левант Г.Е., Райцын Г.А. Практикум по общей химии. – М.:
Высш. шк., 1971. – 292 с.
7. Методические указания и контрольная работа по курсу «Химия»
/Сост. Г.Н. Бычок – Мозырь: МозГПИ им. Н.К. Крупской, 1998. – 24 с.
8.Некрасов Б.В. Основы общей химии в 2-х т. Т.1. – СПб.: Лань, 2003.
– 656 с.
9.Некрасов Б.В. Основы общей химии в 2-х т. Т.2. – СПб.: Лань, 2003.
– 688 с.
10.Михилев Л.А., Пассет Н.Ф., Федотова М.Н. Задачи и упражнения по неорганической химии. – СПб.: Химия, 1997. – 208 с.
11. Практикум по неорганической химии / Под ред. Л.В. Бабич, С.А. Балезина, Ф.Б. Гликиной и др.. – М.: Просвещение, 1991. – 312 с.
12.Романцева Л.М., Лещинская З.Л., Суханова В.А. Сборник задач и упражнений по общей химии. – М.: Высшая школа, 1991. – 288 с.
13.Свиридов В.В., Попкович Г.А., Васильева Г.И. Задачи, вопросы и упражнения по общей и неорганической химии. – Мн.: Изд-во БГУ, 1982. –
352 с.
14.Химия в строительстве: программа, методические указания и контрольная работа для студентов заочного отделения / сост. Г.Н.Некрасова, Д.В.Некрасов – Мозырь: МозГПИ им. Н.К. Крупской, 2002.
–40 с.
15.Химия в 3-х ч. Ч.1.: Общая химия: Учебн. пособ. для студ.-иностр. подг. факультетов / В.М. Бакунович и др. – Мн.: БГУ, 1998. – 225 с.
62

Лабораторный практикум
СОДЕРЖАНИЕ
Введение………………………………………………………………………. 3
Техника лабораторных работ………………………………………………… 4
Лабораторная работа № 1
Определение эквивалента металла методом вытеснения……………….. 6
Лабораторная работа № 2
Тепловые эффекты химических реакций………………………………… 11
Лабораторная работа № 3
Скорость химических реакций……………………………………………. 16
Лабораторная работа № 4
Химическое равновесие и его смещение…………………………………. 21
Лабораторная работа № 5
Концентрация и плотность растворов……………………………………. 25
Лабораторная работа № 6
Электролитическая диссоциация…………………………………………. 32
Лабораторная работа № 7
Гидролиз солей……………………………………………………………... 36
Лабораторная работа № 8
Окислительно-восстановительные реакции……………………………… 41
Лабораторная работа № 9
Получение полимеров и изучение их свойств…………………………… 46
Лабораторная работа № 10
Определение концентрации растворов методом титрования…………… 54
Приложение…………………………………………………………………… 58 Литература…………………………………………………………………….. 62
63

Химия
УДК 54(076.5) ББК 24.1я73
Х 46
Автор-составитель: Галина Николаевна Некрасова
Учебно-методическое издание
Лабораторный практикум по дисциплине "Химия"
Компьютерный набор Г.Н. Некрасова Технический редактор Е.В. Лис Корректор Липская Т.Н.
Рекомендовано к печати 2005. Подписано в печать 2005. Бумага офсетная. Формат 60х90 i/16.Усл.печ.л. Уч.-изд. л. Тираж 100 экз. Заказ №
Учреждение образования «Мозырский государственный педагогический университет»
Редакционно-издательский отдел 247760, Беларусь, Гомельская обл., г. Мозырь, ул.Студенческая,28
Отпечатано на множительной технике Мозырского государственного педагогического университета
247760, Беларусь, Гомельская обл., г. Мозырь, ул.Студенческая,28
64

Лабораторный практикум
65
