
MolBiol_sivolob
.pdf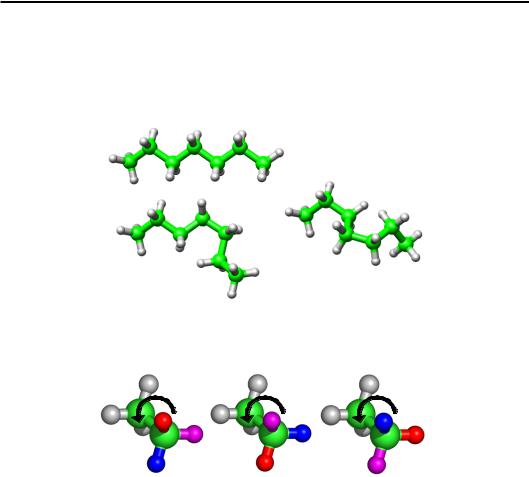
Розділ 1. Фізико-хімічні основи молекулярної біології
дити навіть коливання довжини. Щодо коливань валентних кутів, вони
єможливими за фізіологічної температури, але амплітуда цих коливань
єдосить невеликою (до 5°). Отже, головну роль у гнучкості полімерного ланцюга відіграє обертання навкруг ковалентних зв'язків (рис. 1.4). Власне, конформація часто й описується в термінах кутів обертання.
Рис. 1.4. Кілька конформацій вуглеводневого ланцюжка (зелений – С, сірий – Н), отримані шляхом зміни кутів обертання навкруг зв'язків С–С
Рис. 1.5. Три обертальні ізомери, що є переважними для молекули етану. Атоми гідрогену при одному з карбонів
забарвлені різними кольорами
Два важливі зауваження:
•Обертання є можливим лише навкруг одинарного зв'язку. Подвійний зв'язок, унаслідок особливостей будови задіяних у його утворенні молекулярних орбіталей, допускає лише дві обертальні конформації: із кутами обертання 0° і 180°. Хімічні групи, приєднані до атомів, з'єднаних таким зв'язком, містяться тоді відповідно у цис- і транс-орієнтаціях.
•Обертання навкруг одинарного зв'язку також не є абсолютно вільним. Взаємодія між суміжними хімічними групами приво-
21
Сиволоб А.В. Молекулярна біологія
дить до того, що певні кути обертання є переважними (вигіднішими енергетично). Інакше кажучи, практично реалізуються лише певні діапазони значень кута обертання – різні конформації являють собою так звані обертальні ізомери (рис. 1.5).
Перебудови системи ковалентних зв'язків у хімічних реакціях
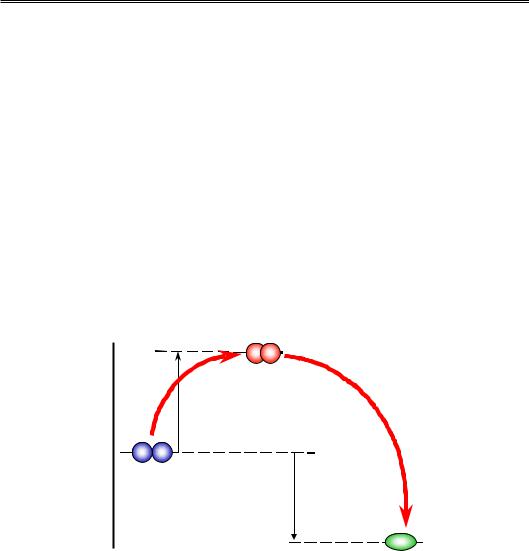
Хімічну реакцію можна визначити як процес перебудови системи ковалентних зв'язків у межах однієї молекули чи групи молекул (субстрати реакції) з утворенням нових молекул-продуктів. Варто зауважити, що ковалентний зв'язок практично ніколи не руйнується в хімічних реакціях (це дуже невигідно енергетично) – він просто замінюється на зв'язок з іншим атомом. Перший принцип, який уже було сформульовано в цьому розділі, полягає в тому, що реакція відбувається тоді й тільки тоді, коли вільна енергія продуктів реакції є нижчою, ніж вільна енергія субстратів (рис. 1.6).
 G
G
Інтермедіат
∆Ga
Енергія
активації
Субстрати |
∆G |
реакції |
Різниця |
|
вільних |
|
енергій |
|
Продукти |
Рис. 1.6. Енергетична схема процесу хімічної реакції
Ця умова є лише необхідною, але не достатньою. Оскільки кожна молекула вже існує в мінімумі вільної енергії (система ковалентних зв'язків є дуже стабільною), на шляху перебудови електронної щільності неодмінно має існувати перехідний стан (інтермедіат) з більш високою енергією. Це означає, що електронну систему субстратів необ-
22

Розділ 1. Фізико-хімічні основи молекулярної біології
хідно спочатку збудити, відхиливши її від рівноважного стабільного стану, після чого вона автоматично “впаде” в стан продуктів, оскільки цей стан знаходиться нижче на шкалі вільної енергії.
Отже, енергія інтермедіатного стану неодмінно є вищою за енергію субстратів: наявність інтермедіату створює на шляху кожної хімічної реакції енергетичний бар'єр, величина якого називається енергією активації (рис. 1.6). При цьому вільна енергія активації містить також ентропійну складову: реакція відбувається тільки тоді, коли субстрати стикаються в певній взаємній орієнтації – лише в одній із великої кількості орієнтацій при випадкових стиканнях. Тобто малоймовірна подія є передумовою утворення інтермедіату – різниця ентропії між інтермедіатом і субстратами (ентропія активації) є негативною величиною, тобто дає позитивний внесок у вільну енергію активації.
Енергія активації, згідно з принципом Больцмана (рівняння (1.1)), визначає імовірність переходу в інтермедіатний стан, тобто швидкість реакції. Великий (порівняно з тепловою енергією kBT) енергетичний бар'єр означає, що реакція уповільнюється настільки, що практично не відбувається. Найпростіший шлях прискорити реакцію – підвищити температуру (збільшити енергію теплового руху). Зрозуміло, що в живих системах таке рішення є неможливим. Кожна хімічна реакція, яка відбувається в клітині, потребує (для того, щоб вона могла відбуватися за розумний час) спеціального молекулярного пристрою – каталізатора, який прискорює реакцію за рахунок зниження енергії активації. Роль біокаталізаторів виконують у більшості випадків (але не завжди) білкові ферменти (ензими), механізми роботи яких розглядатимуться в розділі 2.
Нековалентні взаємодії між атомами й молекулами
Вандерваальсові взаємодії
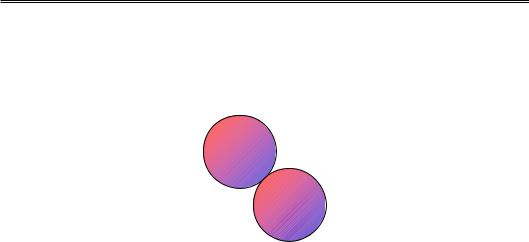
Навіть у межах неполяризованої молекули розподіл електронної щільності є рівномірним лише в разі його усереднення за часом. У кожний момент часу внаслідок флуктуацій щільності виникають локальні неоднорідності, тобто парціальні заряди різного знаку, і молекула являє собою тимчасовий диполь. При наближенні іншої молекули такий тимчасовий диполь першої молекули індукує диполь у межах другої молекули, унаслідок чого виникає притягання електричної природи (рис. 1.7). Квантова механіка свідчить, що енергія пари молекул, електронні сис-
23
Сиволоб А.В. Молекулярна біологія
теми яких поляризовані, є нижчою за енергію пари неполяризованих молекул. У результаті всі молекули та атоми на близьких відстанях притягуються один до одного. Взаємодії такого типу були описані Ван дер Ваальсом (Johannes Van der Waals) і носять його ім'я.
+
–
+
–
Рис. 1.7. Взаємодія між тимчасовими диполями двох молекул
Вандерваальсові взаємодії між неполяризованими молекулами називають дисперсійними; взаємодії між двома поляризованими молекулами (постійними диполями) – орієнтаційними (або дипольдипольними); між неполяризованою молекулою та постійним диполем – індукційними (або взаємодіями типу диполь-індукований диполь).
Основні властивості вандерваальсових взаємодій:
•Вандерваальсові взаємодії, які призводять до притягання на малих відстанях, реалізуються між будь-якими молекулами й атомами незалежно від їхньої природи.
•Вандерваальсові взаємодії є короткодіючими: енергія взаємодій швидко знижується з відстанню між молекулами чи атомами r (пропорційно до 1/r6). Тобто вандерваальсові взаємодії є суттєвими при безпосередньому контакті між молекулами (атомами, хімічними групами).
•Слова “безпосередній контакт” означають, що існує певна оп-
тимальна величина r0 – відстань, на якій енергія взаємодій є мінімальною. При зниженні r притягання між молекулами змінюється на відштовхування: електронні оболонки різних молекул (уже насичені валентними електронами) не можуть проникати одна в одну (відповідно до принципу заборони
Паулі). Величина r0 характеризує розмір кожного атома (вандерваальсів радіус), який використовується при побудові молекулярних моделей (як, наприклад, на рис. 1.3). Непроник-
24

Розділ 1. Фізико-хімічні основи молекулярної біології
ність атомів один для одного (стеричні обмеження) має велике значення для структури біополімерів: серед великої кількості конформацій можливими є лише ті, для яких не спостерігається проникнення однієї частини ланцюга в іншу (два атоми не можуть займати одну область простору).
•Вандерваальсові взаємодії є найслабшими серед усіх нековалентних взаємодій. Для порівняння: величина середньої кіне-
тичної енергії теплового руху RT при 27 °С становить 0,6 ккал/моль; типові значення енергії вандерваальсових взаємодій (на відстані r0) варіюють у межах 0,1–0,5 ккал/моль.
Останнє твердження потребує уточнення стосовно макромолекул. Коли взаємодіють досить великі поверхні, між якими реалізується велика кількість міжатомних контактів, вандерваальсові взаємодії стають суттєвим фактором стабілізації структури макромолекул і макромолекулярних комплексів. Для того, щоб таких контактів було справді багато (щоб не було пустот), дві поверхні повинні добре відповідати одна одній (як ключ до замка) – бути просторово комплементарними. Просторова комплементарність між поверхнями макромолекул є одним із важливих механізмів специфічної взаємодії між ними.
Електростатичні (іонні) взаємодії
Певні хімічні групи в біологічних макромолекулах здатні іонізуватися, тобто набувати постійного негативного чи позитивного заряду, втрачаючи чи набуваючи протон. Взаємодія між такими зарядами підпорядковується добре відомому закону Кулона (Charles de Coulomb), а саме, вільна енергія взаємодії двох зарядів q1 і q2 залежить від відстані між зарядами r як
U = qε1qr2 ,
де ε – діелектрична проникність середовища. При цьому слід звернути увагу на кілька досить важливих моментів.
Величина ε залежить від полярності середовища. Поляризованість молекул води призводить до досить великого значення проникності (ε ≈ 80 за кімнатної температури). У неполярному середовищі проникність є значно нижчою (наприклад, усередині молекули білка ε ≈ 3) і, відповідно, електростатична енергія зростає. Занурення зарядженої
25

Сиволоб А.В. Молекулярна біологія
групи або навіть пари наближених різнойменних зарядів у неполярне середовище є дуже невигідним енергетично: заряджені групи частіше залишаються на поверхні макромолекул, не занурюючись усередину.
Висока діелектрична проникність води свідчить про те, що електростатичні взаємодії у воді пов'язані в першу чергу з упорядкованістю диполів води навкруг зарядів і зміною цієї впорядкованості при наближенні чи віддаленні зарядів. Тобто електростатичні взаємодії мають ентропійну природу – при наближенні (взаємній нейтралізації) різнойменних зарядів ступінь упорядкованості диполів води знижується. Відповідно, зростає ентропія і знижується вільна енергія.
Найвагомішими електростатичні взаємодії є для макромолекул, на поверхні яких сконцентрована велика кількість заряджених груп. На перший погляд здається очевидним, що дві макромолекули з позитивно та негативно зарядженими поверхнями мають взаємодіяти за законом Кулона. Але крім води в живих системах завжди присутні неорганічні іони, які, за тим самим законом Кулона, мають зв'язуватись із зарядженими поверхнями макромолекул (рис. 1.8). Права частина рис. 1.8 енергетично краща за ліву лише одним, а саме звільненням неорганічних іонів у зовнішній розчин, тобто більш низькою впорядкованістю (вищою ентропією та нижчою вільною енергією). Таким чином, взаємодія двох заряджених макромолекул – цілком ентропійний ефект. Величина цього ефекту знижується зі зростанням концентрації неорганічних іонів (іонною силою): якщо іонів досить багато в зовнішньому розчині, ефект від їхнього звільнення є дуже незначний. Тоді взаємна спорідненість макромолекул знижується і комплекс дисоціює.
|
|
- |
+ |
|
|
- |
|
+ - |
+– |
+ - |
+ |
+ - |
+ – |
|
|
+ - |
+– |
+ |
|
++–––
Рис. 1.8. Ентропійна природа електростатичних взаємодій між високозарядженими макромолекулами
26

Розділ 1. Фізико-хімічні основи молекулярної біології
Водневий зв'язок
Розглянемо дві молекули води (рис. 1.9). Унаслідок високої електронегативності оксигену молекула води є полярною, тобто на її атомах присутні парціальні електричні заряди (приблизно –2/3 заряду електрона на оксигені, +1/3 на кожному гідрогені). Відповідно, дві молекули будуть взаємодіяти одна з одною електростатично. Але тут є ще дві важливі обставини: 1) атом гідрогену має лише один електрон, і цей електрон є відтягнутим на оксиген у молекулі води; 2) атом оксигену містить на зовнішньому шарі неподілену пару електронів (рис. 1.3), які не залучені до утворення ковалентного зв'язку. У результаті “слабка” електронна оболонка гідрогену “продавлюється” атомом оксигену другої молекули; його неподілена пара електронів частково узагальнюється з гідрогеном, електрон якого є відтягнутим “власним” оксигеном. Взаємодія такого типу й називається водневим зв'язком, який, являє собою дещо середнє між електростатичною взаємодією (притягання парціальних зарядів) і ковалентним зв'язком (часткове узагальнення пари електронів між двома атомами).
–2/3
O
HH
+1/3
Рис. 1.9. Дві молекули води, зв'язані водневим зв'язком
Типові пари хімічних груп, що утворюють водневі зв'язки в макромолекулах:
O–H•••••O O–H•••••N N–H•••••O N–H•••••N
Тобто водневий зв'язок утворюється між атомом гідрогену, приєднаним до електронегативного атома з частковим негативним зарядом δ– (ця група “віддає” протон і називається донором водневого зв'язку)
27

Сиволоб А.В. Молекулярна біологія
та електронегативним атомом іншої хімічної групи чи молекули (акцептором), який містить неподілену пару електронів:
Dδ––Hδ+ + :Aδ– → Dδ––Hδ+ ••••• :Aδ–. |
(1.7) |
Група С–Н, наприклад, не відповідає цим принципам (зв'язок С–Н неполярний, оскільки С не є електронегативним атомом) і не може бути залученою до утворення водневого зв'язку.
Дві властивості водневого зв'язку є наслідком його природи:
•Водневий зв'язок є дуже вигідним енергетично: його енергію (утворення водневого зв'язку супроводжується виділенням тепла, тобто він має ентальпійну природу) можна оцінити приблизно в 5 ккал/моль (порівняйте з енергією теплового руху RT = 0,6 ккал/моль).
•На відміну від електростатичних взаємодій, але так само, як ковалентний зв'язок, водневий зв'язок є чутливим до взаємної орієнтації донора й акцептора. Особливо це стосується напрямку донорної групи: ковалентний зв'язок D–H має бути спрямованим на акцепторний атом (припустиме відхилення
зв'язку від напрямку водневого зв'язку становить 20–30°). Друга властивість є дуже важливою. Вона означає, що водневі зв'яз-
ки між макромолекулами утворюються тільки тоді, коли між донорними та акцепторними групами є чітка просторова відповідність. Це робить водневий зв'язок найсуттєвішим фактором у визначенні специфічності міжмолекулярних взаємодій – міжмолекулярному впізнанні.
Перша властивість також потребує уточнень. Якщо взаємодія між донором і акцептором відбувається у водному середовищі, то рівняння (1.7) має бути переписане таким чином:
 H2O····H2O
H2O····H2O
DH····OH 2 + A····H2O
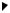 DH····A
DH····A
Як бачимо, кількість водневих зв'язків є однаковою ліворуч
іправоруч (ентальпія системи не змінюється), різною може бути лише ентропія лівого та правого станів. Якщо донор і акцептор – маленькі молекули, то переважним буде лівий стан (велика кількість молекул води робить його менш упорядкованим): маленькі полярні молекули розчиняються у воді, тому що добре з нею взаємодіють. Якщо донор
іакцептор належать макромолекулі, переважним може стати правий
28
Розділ 1. Фізико-хімічні основи молекулярної біології
стан: пара молекул води може вільніше рухатися, що збільшує ентропію системи. Отже, водневі зв'язки у водному середовищі мають ентропійну природу. Зрозуміло, що в неполярному середовищі (де немає конкуренції з водою) водневий зв'язок буде значно стабільнішим.
Гідрофобні взаємодії
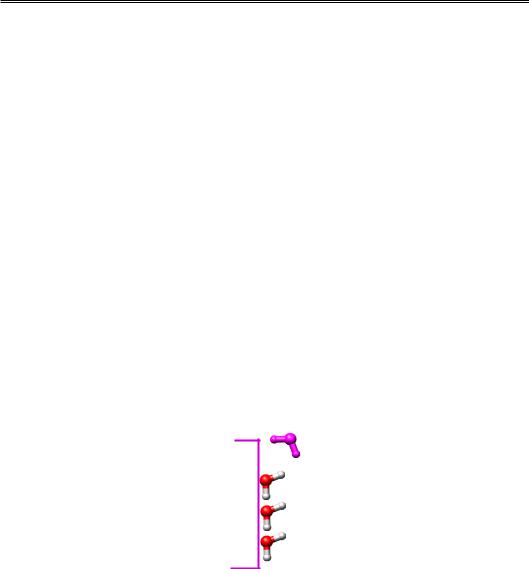
Сильна взаємодія молекул води за рахунок водневих зв'язків і те, що ці зв'язки можливі лише за певної взаємної орієнтації молекул, приводить до так званого гідрофобного ефекту при зануренні у воду неполярних молекул. Неполярність молекули означає, що вона не здатна утворювати водневі зв'язки. А молекули води не тільки здатні, а й прагнуть обов'язково їх утворити, оскільки енергія зв'язку є високою, втрачати його дуже невигідно. Єдиний вихід для молекул води – утворити зв'язки між собою. Проте неполярна поверхня створює перешкоди: як видно з рис. 1.10, група ОН верхньої молекули “дивиться” на неполярну (гідрофобну) поверхню і не може бути задіяною в утворенні водневого зв'язку. За збереження водневих зв'язків молекулам води доводиться платити зростанням упорядкованості – вони формують поблизу гідрофобної поверхні, як показано на рис. 1.10, упорядкований кригоподібний кластер. Таким чином, занурення гідрофобної молекули у водне оточення за рахунок зниження ентропії є дуже невигідним енергетично.
Рис. 1.10. Кластер молекул води біля гідрофобної поверхні. Верхня молекула
займає невигідну орієнтацію відносно поверхні
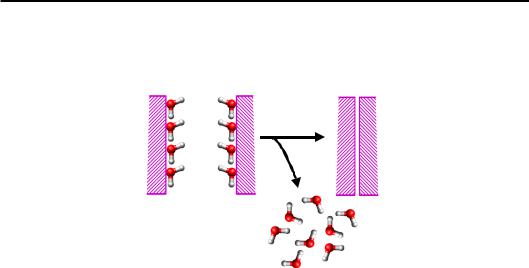
Якщо додати ще одну таку гідрофобну поверхню, у системи буде дуже простий вихід (рис. 1.11): злипання поверхонь супроводжується визволенням молекул води, тобто зростанням ентропії. Отже (знову!), гідрофобні взаємодії мають цілком ентропійну природу.
29
Сиволоб А.В. Молекулярна біологія
З рисунків 1.10 і 1.11 зрозуміло, що величина гідрофобного ефекту (енергетичний виграш від визволення води) є пропорційним площі гідрофобної поверхні.
Рис. 1.11. Гідрофобна взаємодія між двома неполярними поверхнями
Оскільки гідрофобний ефект має ентропійну природу, а ентропійний внесок у вільну енергію зростає з температурою (рівняння (1.2)), ефективність гідрофобних взаємодій збільшується при підвищенні температури (зростає ефект визволення води в середовище, де рух молекул води прискорюється). Саме цим зростанням гідрофобного ефекту пояснюється добре відоме зниження розчинності у воді неполярних молекул газів при підвищенні температури. Для біологічних систем це також має велике значення: підвищення температури, навіть не дуже значне (до 35–37 °С), змінює енергетичний баланс міжмолекулярних взаємодій і призводить у пойкілотермних організмів до так званого теплового шоку (див. розділ 8).
Гідрофобні взаємодії є надзвичайно важливими для живих систем. Достатньо сказати, що саме вони лежать в основі утворення клітинних мембран, без яких існування клітини було б неможливим. У наступних розділах буде показано, що гідрофобні взаємодії відіграють також провідну роль у підтриманні структури біологічних макромолекул.
30
