
MolBiol_sivolob
.pdf
Розділ 1. Фізико-хімічні основи молекулярної біології
КОНТРОЛЬНІ ЗАПИТАННЯ
1.Дайте визначення вільної енергії. Поясніть, як вона залежить від ентальпії та ентропії системи? В якому напрямку змінюється вільна енергія при переході системи до стану рівноваги?
2.Чи може при переході до стану рівноваги зрости ентальпія системи? За якої умови? Чи може зрости ступінь упорядкованості при переході до рівноважного стану?
3.Скориставшись рівнянням 1.6, розрахуйте відносну частку компонента А у складі комплексу С при концентраціях вільного компоненту В, що дорівнюють 10–6, 10–5, 10–4 моль/л. Вважайте, що К = 105 л/моль.
4.Що таке ковалентний зв'язок і які основні властивості йому притаманні? За рахунок чого полімерний ланцюг може змінити свою конформацію?
5.Назвіть дві умови, за яких буде відбуватися хімічна реакція. Якою величиною визначається швидкість реакції?
6.У чому полягає фізичний механізм вандерваальсових взаємодій?
7.Поясніть ентропійну природу іонних взаємодій між двома високозарядженими макромолекулами.
8.Які властивості мають бути притаманні двом хімічним групам, щоб між ними міг утворитися водневий зв'язок? Чи можливий водневий зв'язок між двома метильними групами? Між метильною та ОН-групою?
9.Чому водневий зв'язок часто буває важливим для специфічного міжмолекулярного впізнання?
10.Поясніть фізичну природу гідрофобного ефекту.
РЕКОМЕНДОВАНА ЛІТЕРАТУРА
Гросберг, А.Ю., Хохлов, А.Р. Физика в мире полимеров. – М. : Наука, 1989. Кантор, Ч., Шиммел, П. Биофизическая химия : в 3 т. – М. : Мир, 1984.
Ленинджер, А. Основы биохимии : в 3 т. – М. : Мир, 1985.
Полинг, Л. Полинг, П. Химия. – М. : Мир, 1978.
Тэнфорд, Ч. Физическая химия полимеров. – М. : Химия, 1965.
Финкельштейн, А.В. Птицын, О.Б. Физика белка. Курс лекций.
– М. : КДУ, 2005.
Шредингер, Э. Что такое жизнь? Физический аспект живой клетки.
– М. ; Ижевск: Регулярная и хаотическая динамика, 2002.
31

Розділ 2
БІЛКИ
Скорлупы-то золотые, Ядра – чистый изумруд...
А. Пушкин. Сказка о царе Салтане
Хімічна будова білків
Амінокислоти
Узагальнену хімічну формулу амінокислоти – мономерної одиниці молекули білка (протеїну, protein) – зображено на рис. 2.1.
Карбоксильна Аміногрупа група (С' атом)
+H3N H
H COO-
COO-
CСα атом
R Боковийзалишок
Рис. 2.1. Структурна формула амінокислоти
За нейтральних рН амінота карбоксильна групи, приєднані до спільного атома карбону (Сα), перебувають в іонізованому стані. Саме ці, стандартні для всіх амінокислот, групи (наявність яких і зумовила назву цих сполук) забезпечують утворення полімерної молекули білка. Розрізняються амінокислоти за типом бокового (амінокислотного) залишку. Усього у складі білків зустрічається 20 амінокислот (у дужках – загальноприйняті скорочення, трита однолітерні): аланін (Ala, A),
Сиволоб А.В. Молекулярна біологія
аргінін (Arg, R), аспарагін (Asn, N), аспарагінова кислота (Asp, D), ва-
лін (Val, V), гістидин (His, H), гліцин (Gly, G), глутамін (Gln, Q), глута-
мінова кислота (Glu, E), ізолейцин (Ile, I), лейцин (Leu, L), лізин (Lys, K),
метіонін (Met, M), пролін (Pro, P), серин (Ser, S), тирозин (Tyr, Y), треонін (Thr, T), триптофан (Trp, W), фенілаланін (Phe, P), цистеїн (Cys, C).
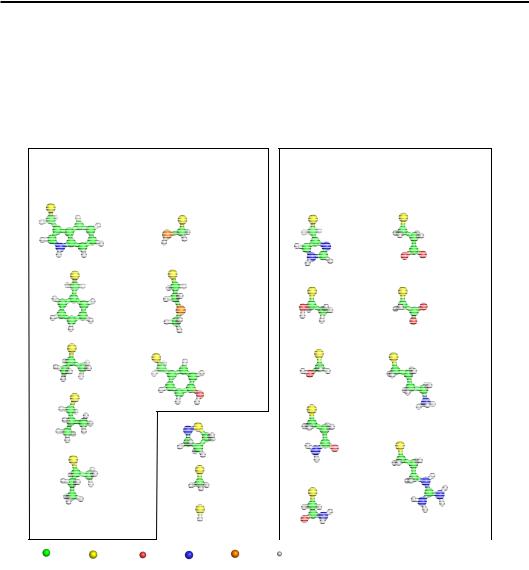
Їхні бокові залишки зображено на рис. 2.2.
Гідрофобні |
|
Полярні |
Trp |
Cys |
His |
|
|
Glu |
|
Phe |
|
|
|
|
|
– |
|
|
|
Met |
Thr |
Asp |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
– |
|
Val |
|
|
Tyr |
Ser |
Lys |
|
|
|
|
|
||||
|
Leu |
|
|
|
|
Gln |
+ |
|
|
|
|
|
|
||
|
|
|
|
Pro |
|
||
|
|
|
|
|
|
Arg |
|
|
Ile |
|
|
|
|
|
|
|
|
|
Ala |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Gly |
|
Asn |
+ |
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
C |
Cα |
O |
N |
S |
H |
|
|
Рис. 2.2. Бокові залишки амінокислот, приєднані до Сα атома, у стані іонізації, який вони мають при рН 7,0.
Кольоровий код (унизу) позначення хімічних елементів зберігається на всіх подальших рисунках
Два параметри амінокислотних залишків мають особливе значення для структури білка: розмір і здатність взаємодіяти з водою. За останньою ознакою залишки можна поділити дві групи: полярні й неполярні (гідрофобні). Три гідрофобні залишки (окрема група на
34

Розділ 2. Білки
рис. 2.2) – маленького розміру, тому їх можна вважати “нейтральними” щодо спорідненості до води (гідрофобний ефект залежить від розміру поверхні, див. розділ 1). У глобулярних водорозчинних білках співвідношення між гідрофобними та полярними залишками дорівнює в середньому 50 : 50. Унаслідок гідрофобного ефекту неполярні залишки прагнуть опинитися всередині структури білка, полярні залишаються на поверхні, зберігаючи взаємодії з водою. Це і є головна рушійна сила, яка змушує білковий ланцюг укладатися певним чином у просторі, формуючи компактну структуру – так звану глобулу.
Полярні амінокислоти тому так і називаються, що прагнуть взаємодіяти з водою за рахунок водневих зв'язків (містять донорні та акцепторні групи). Серед них є залишки, які мають постійний заряд при рН 7,0: негативний у Asp і Glu (за рахунок карбоксильних груп у складі бокового залишку), позитивний у Lys (аміногрупа) та Arg (гуанідинова група). His також може набувати позитивного заряду в структурі білка в певному мікрооточенні (у розчині він іонізується при рН < 6,5).
Пептидний зв'язок і поліпептидний ланцюг
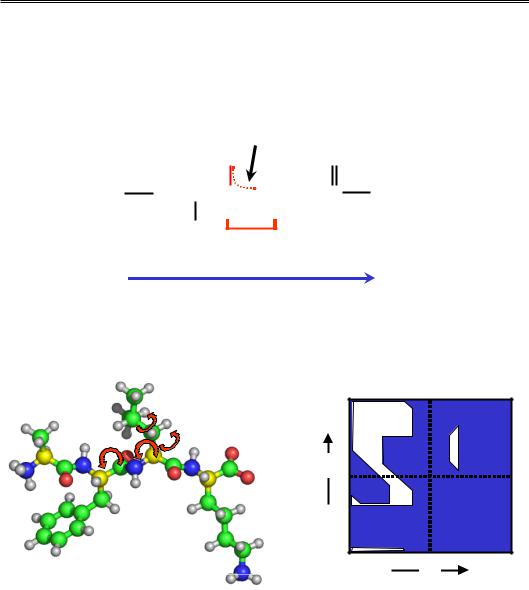
Карбоксильна група однієї амінокислоти та аміногрупа іншої, втрачаючи молекулу води, утворюють ковалентний зв'язок, який називається пептидним (рис. 2.3). Група атомів O–C'–N–H називається пептидною групою. Оскільки в утворенні зв'язку між мономерами беруть участь різні хімічні групи, поліпептидний ланцюг має напрям: його кінець, де залишається аміногрупа, називається N-кінцем, протилежний (карбоксильна група) – С-кінцем. Синтезуються поліпептидні ланцюги (розділ 8) у напрямку N → С, у цьому ж напрямку представляються за умовчанням амінокислотні послідовності білків.
Дві властивості пептидної групи відіграють ключову роль в утворенні просторової структури білка:
1) Пептидна група є полярною – виступає одночасно донором і акцептором водневих зв'язків. Таким чином, остов поліпептидного ланцюга (пептидні групи та Сα-атоми, що чергуються), від якого відгалужуються полярні та неполярні бокові залишки (див. рис. 2.4),
єполярним.
2)Одна з пар електронів, що відповідає зв'язку C'–О (зазвичай позначається як подвійний, як праворуч на рис. 2.3), насправді делокалізова-
на також між атомами C'–N: пептидний зв'язок є “напівподвійним”, що унеможливлює обертання навкруг нього. Для більшості амінокислот реалізується більш вигідна транс-конформація пептидного зв'язку: при-
35
Сиволоб А.В. Молекулярна біологія
єднані до пептидної групи Сα-атоми “дивляться” в різні боки (рис. 2.4; див. також розділ 1). Єдине виключення – пептидий зв'язок перед Pro, приблизно 10 % таких зв'язків знаходяться в цис-конформації.
Пептидний зв'язок
OR O
|
|
H |
|
|
|
N |
|
|
|
|
C |
N |
|
C |
|
C |
|
|
C |
|
|||
|
|
|
|
|
|||||||
H |
|
|
|
|
|
H |
|
H |
|
|
|
R |
Пептидна |
|
група |
N-кінець |
С-кінець |
Рис. 2.3. Фрагмент поліпептидного ланцюга
|
Leu |
|
|
|
Ala |
χ2 |
180° |
|
|
|
ψ |
β |
|
|
|
χ1 |
|
|
|
|
C' |
ψ |
|
|
|
φ |
|
|
|
|
Cα |
Lys |
α |
|
|
Cβ |
|
|
|
|
|
|
|
|
|
Phe |
–180° |
|
|
|
–180° |
φ |
180° |
|
|
|
|||
Рис. 2.4. Тетрапептид і приблизна діаграма Рамачандрана: синім кольором позначено заборонені, білим – дозволені для більшості
амінокислотних залишків зони. Літери α і β позначають зони, які відповідають певним регулярним конформаціям
36

Розділ 2. Білки
Оскільки обертання навкруг пептидного зв'язку є неможливим, конформація поліпептидного ланцюга може змінюватись тільки за рахунок обертання навкруг суміжних до пептидної групи одинарних зв'язків (обертальні кути φ і ψ, рис. 2.4), а також обертання навкруг зв'язків у межах бокових залишків (χ1, χ2 ...). Унаслідок стеричних обмежень не всі комбінації кутів обертання φ і ψ є можливими – для поліпептидного ланцюга реалізується обертально-ізомерний механізм гнучкості. Дозволені для більшості залишків зони конформаційного простору в координатах φ–ψ (діаграма Рамачандрана (Gopalasamudram Narayana Ramachandran)) показано на рис. 2.4. Діаграми Рама-
чандрана мають свої специфічні ознаки для окремих залишків. Особливо це проявляється, якщо ввести третю координату – вільну енергію для кожної пари обертальних кутів. Інакше кажучи, переважна
(найбільш імовірна) локальна конформація ланцюга залежить від амінокислотної послідовності.
Вторинна структура
Локальну конформацію амінокислотного ланцюга називають вторинною структурою білка. Певна частина (іноді значна) ланцюга міститься в нерегулярній конформації (кути φ і ψ варіюють від одного залишку до іншого). Але в глобулярних білках завжди зустрічаються також регулярні конформації, стабілізовані водневими зв'язками між пептидними групами, і термін “вторинна структура” іноді відносять саме до них. Загалом у глобулярних білках представлено всього два типи таких конформацій – α-спіраль (α-helix) і β-структура (β-structure), хоча є також інші.
α-Спіраль
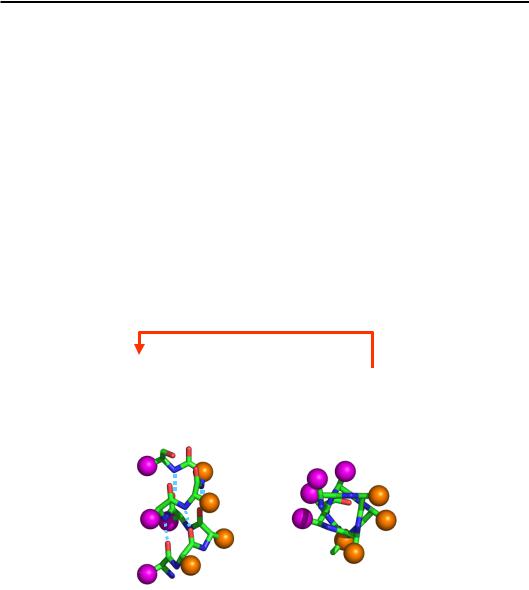
Одна з допустимих конформацій на карті Рамачандрана (φ = –60°, ψ = –45°, рис. 2.4) передбачає наближення оксигену пептидної групи і-го залишку до NH-групи і + 4. Перша група є акцептором водневого зв'язку, друга – донором. Система таких водневих зв'язків між кожним і та і + 4 залишком стабілізує регулярну конформацію, яка й називається α-спіраллю (рис. 2.5). Ця спіраль є правою (точка, що рухається вздовж ланцюга, обертається навкруг осі спіралі за годинниковою стрілкою й одночасно пересувається вздовж осі вперед), на один виток припадає 3,6 амінокислотного залишку, довжина
37
Сиволоб А.В. Молекулярна біологія
одного витка вздовж осі (крок спіралі) 5,4 Å. Водневий зв'язок між пептидними групами замикає в кільце 13 атомів чотирьох залишків: відповідно, α-спіраль позначається також як спіраль 413. α-Спіраль можна приблизно уявити як циліндр діаметром ≈ 10 Å, на поверхні якого розташовані амінокислотні залишки.
Оскільки найімовірніша локальна конформація ланцюга залежить від послідовності, різні амінокислоти та їхні комбінації мають різний потенціал щодо включення в α-спіраль (як і в будь-яку іншу вторинну структуру). Наприклад, Pro не може бути включеним до α-спіралі (немає донора водневого зв'язку). Gly також уникає регулярних структур, оскільки втратив би свою високу конформаційну свободу (ентропійна ціна була б надто високою). При цьому в глобулярних білках спостерігається закономірність: гідрофобні амінокислотні залишки згруповані на поверхні спіралі в більш-менш суцільний гідрофобний кластер (рис. 2.5). Тобто α-спіраль переважно утворюється на таких ділянках послідовності з високим спіральним потенціалом, які здатні сформувати гідрофобний кластер на поверхні спіралі.
|
|
|
|
|
|
O |
|
|
|
R |
|
|
|
|
|
|
|
|
|
O |
|
|
|
R |
|
|
|
|
|
O |
|
||||||||
|
|
H |
|
H |
|
|
|
|
|
|
|
|
|
|
H |
|
H |
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
H |
|
|
|
||||
|
|
N |
|
Cα |
|
C |
|
|
N |
|
Cα |
|
C |
|
|
N |
|
Cα |
|
C |
|
|
N |
|
Cα |
|
C |
|
|
N |
|
Cα |
|
C |
|
|
|||
|
|
|
|
|
|
|
|
|
H |
|
H |
|
|
|
|
|
|
|
|
|
|
|
|
H |
H |
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
R |
|
|
|
|
|
|
|
|
R |
|
|
|
|
|
|
|
|
O |
|
|
|
R |
|
||||||||||||
|
|
|
0 |
|
|
|
|
|
1 |
|
|
|
|
|
2 |
|
|
|
3 |
|
|
4 |
|
||||||||||||||||
|
|
|
7 |
|
|
|
|
|
|
6 |
|
|
0 |
4 |
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
5 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|||||||
|
|
|
4 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
|
|
|
|
5 |
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
0 |
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
Рис. 2.5. α-Спіраль. Червона стрілочка – водневий зв'язок.
Унизу: дві проекції α-спіралі, пунктирні лінії – водневі зв'язки між пептидними групами. Бокові залишки показані схематично, різне забарвлення символізує два типи залишків – полярні й неполярні
38

Розділ 2. Білки
Така закономірність пояснюється просто. Унаслідок конкуренції з молекулами води водневі зв'язки між пептидними групами (а отже, і спіраль) у водному оточенні не є дуже стабільними. Адже утворення спіралі коштує енергетичних витрат – зниження ентропії за рахунок обмеження конформаційної свободи. А водневі зв'язки у присутності води (тобто заміна зв'язку між пептидною групою та водою на зв'язок між пептидними групами) не здатні суттєво компенсувати ці витрати (див. розділ 1). Якщо ж на поверхні спіралі є гідрофобний кластер, він прагне адсорбувати іншу гідрофобну поверхню (спіралі чи інших елементів вторинної структури). Тоді частина пептидних груп і водневих зв'язків між ним опиняється в неполярному оточенні, що суттєво стабілізує і ці зв'язки, і α-спіраль. У результаті у глобулі залишаються лише α-спіралі з гідрофобним кластером на поверхні. Це вказує, що формування регулярної вторинної структури та укладання в глобулу – єдиний процес. Нижче при обговоренні глобулярної структури буде розглянуто питання про те, чому взагалі утворюється регулярна вторинна структура в глобулярних білках.
β-Структура
Інший тип регулярної вторинної структури, який часто зустрічається в білках, – це β-структура. Вона складається з витягнутих фрагментів поліпептидного ланцюга: кілька таких фрагментів – β-тяжів (β-strands) – утворюють β-структурний шар, у площині якого розташовані водневі зв'язки між пептидними групами тяжів, а від обох поверхонь відходять амінокислотні залишки (рис. 2.6).
Рис. 2.6. Антипаралельна β-структурна шпилька (амінокислотні залишки зображено кульками, як на рис. 2.5). Унизу: та сама шпилька в загальноприйнятому схематичному зображенні
39

Сиволоб А.В. Молекулярна біологія
Половина пептидних груп β-тяжів, які містяться на межах шару, залишаються ненасиченими водневими зв'язками. Тому чим більше тяжів входить до складу шару, тим більш стабільним він є. β-Шар може бути антипаралельним (сусідні тяжі спрямовані у протилежні один щодо одного напрямки, як на рис. 2.6) або паралельним (звичайно, якщо тяжі не розташовані один за одним по ланцюгу).
Як видно з рис. 2.6, β-шар завжди є дещо скрученим через те, що окремі тяжі не є абсолютно прямими.
Сусідні по ланцюгу амінокислотні залишки розташовані по різні боки β-структурного шару. І знову спостерігається вже зрозуміла закономірність: принаймні одна поверхня шару є переважно гідрофобною.
Спіраль 310
Права спіраль 310 (водневий зв'язок між і та і + 3 залишками) зустрічається не дуже часто у вигляді коротких (три-чотири залишки) фрагментів.
β-Поворот
β-Поворот або β-вигин (β-turn) – невеликий елемент ланцюга із чотирьох залишків, стабілізований водневим зв'язком між пептидними групами першого та четвертого. β-Поворот забезпечує поворот ланцюга на 180° і часто знаходиться між двома сусідніми β-тяжами в антипаралельних β-шпильках.
Глобулярна структура
Поліпептидний ланцюг глобулярного білка довжиною 50–150 (максимально 250) амінокислотних залишків укладається в єдину щільну глобулу розміром 25–40 Å. Усередині такої глобули утворюється гідрофобне ядро з неполярних залишків, заекрановане від води полярною поверхнею глобули. Довші ланцюги утворюють кілька субглобул із власним гідрофобним ядром кожна – структурних доменів. Просторову структуру будь-якого поліпептидного ланцюга називають третинною структурою. Досить часто молекула білка складається з кількох поліпептидних ланцюгів, які можуть укладатися в єдину щільну глобулу або формувати окремі глобули, що взаємодіють між собою. В обох випадках кажуть про четвертинну (субодиничну) структуру білка.
40
Розділ 2. Білки
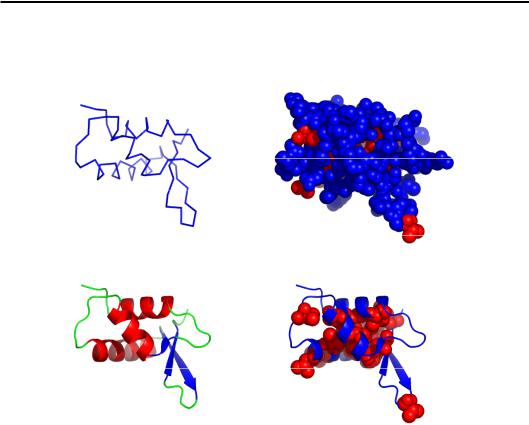
Різні варіанти зображення просторової структури білка показані на рис. 2.7. На частинах (б) і (г) добре видно утворення всередині глобули щільного гідрофобного ядра.
а |
б |
в |
г |
Рис. 2.7. Різні варіанти зображення структури глобулярного білка (глобулярний домен гістону Н5, код PDB 1HST): (а) – остов ланцюга
(з'єднані між собою Сα-атоми); (б) – атомна модель, червоні – атоми неполярних, сині – полярних залишків; (в) – схема будови, де показані вторинні структури; (г) – до попередньої схеми додано атоми неполярних залишків.
Усі рисунки мають однакові проекції та масштаб
Роль вторинної структури в утворенні глобули
Розглядаючи структури глобулярних білків (на сьогодні їх установлено понад 40 тис.), можна сформулювати кілька загальних правил.
Правило 1. Каркас глобули завжди складається з ділянок вторинної структури (α-спіралей та/або β-структурних шарів), гідрофобні поверхні яких, взаємодіючи між собою, утворюють гідрофобне ядро.
Чому саме з ділянок регулярної вторинної структури? Це стає зрозумілим, якщо брати до уваги полярність / неполярність елементів поліпептидного ланцюга. Неполярні амінокислотні залишки прагнуть опинитися
41
