
- •Модуль № 2 Частина 2. Мкт агрегатних станів речовини
- •Тема 1. Газоподібний стан речовини. Властивості пари
- •3. Випаровування рідини у герметично закритій посудині
- •4. Вимірювання вологості
- •Тема 2. Рідкий стан речовини
- •1. Характеристика рідкого стану речовини
- •2. Поверхневий шар рідини
- •5. Спостереження явища поверхневого натягу
- •6. Способи визначення коефіцієнта поверхневого натягу
- •3. Внутрішній шар рідини. Поняття про в’язкість середовища
- •Тема 3. Твердий стан речовини
- •2. Ізотропія та анізотропія
- •3. Механічні властивості.
- •2. Класифікація твердих тіл і їх властивості
- •5. Типи кристалів
- •9. Деформація твердих тіл
- •3. Кількісна характеристика деформації.
- •10. Закон пружних деформацій
- •13. Плавлення і кристалізація
- •16. Теплове розширення тіл
13. Плавлення і кристалізація
Плавлення – процес переходу речовини з твердого стану в газоподібний.
Кристалізація (тверднення) – зворотній процес переходу речовини з рідкого стану у твердий.
Властивості плавлення і кристалізації
Властиві тільки кристалічним тілам.
Відбуваються при однаковій температурі, яка не змінюється, поки разом існують тверда і рідка фаза речовини. Ця температура називається температурою плавлення tпл.
У процесі плавлення і кристалізації речовини завжди існує різка межа між твердою і рідкою фазами.
У процесі плавлення об’єм значної більшості речовин збільшується, а в процесі кристалізації – зменшується, а їх густина при цьому змінюється навпаки. Це має велике значення у ливарній справі.
Якщо V речовини при плавленні зростає, збільшення зовнішнього тиску веде до підвищення tпл, якщо V↓, – tпл↓. Але лише велике підвищення тиску помітно змінює tпл.
Сублімація – випаровування твердих тіл. Зворотній процес переходу речовини з газового стану у твердий, минаючи рідкий стан, називається десублімацією.
 Теплота
плавлення Qпл
– кількість теплоти, яка необхідна для
перетворення твердого тіла на рідину
при сталій температурі tпл
Теплота
плавлення Qпл
– кількість теплоти, яка необхідна для
перетворення твердого тіла на рідину
при сталій температурі tпл
![]() ,
(31)
,
(31)
д е
е![]() (32)
(32)
– питома теплота плавлення – характеризує залежність зміни внутрішньої енергії речовини в процесі її плавлення або кристалізації від роду речовини та зовнішніх умов, і вимірюється кількістю теплоти, яку необхідно затрати для плавлення одиниці маси цієї речовини при температурі плавлення.
[λ] = Дж/кг.
*
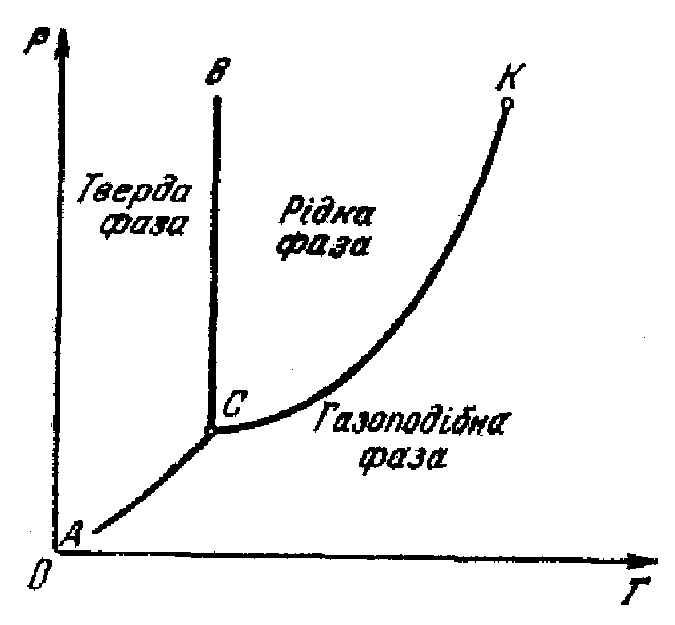
Кожна точка на діаграмі відповідає рівноважному стану речовини (тобто: в ньому речовина може перебувати як завгодно довго). При незмінних зовнішніх умовах (р і Т), які відповідають точкам на лініях ВС, КС, АС дві фази можуть перебувати у стані динамічної рівноваги (при якій з однієї фазу в іншу переходить однакова кількість молекул). Ця рівновага може зберігатися як завгодно довго, якщо енергію не підводять до речовини і не відбирають від неї.
КС – залежність тиску насиченої пари взятої речовини від температури і відповідає рівновазі рідкої і газової фаз;
АС – залежність від температури тиску насиченої пари, що перебуває над поверхнею твердого тіла і відповідає рівновазі твердої і газової фаз;
ВС – залежність температури плавлення від тиску і відповідає рівновазі рідкої і твердої фаз.
ВС, КС, АС – лінії фазових переходів:
через ВС відбувається плавлення або кристалізація;
через К – випаровування або конденсація;
через АС – сублімація або десублімація.
К – критична точка, при якій відсутня різниця між рідиною і її парою;
С – потрійна точка, яка зображує рівновагу між усіма трьома фазами цієї речовини.
