
- •Лекция 3
- •3.1 Закон действующих масс. Константа химического равновесия.
- •3.2 Условия равновесия для химической реакции.
- •Стандартные условия протекания реакции.
- •3.3 Изотерма химической реакции.
- •3.4 Связь между kр и kс.
- •3.5 Равновесие в гетерогенных реакциях.
- •3.6 Принцип Ле-Шателье.
- •3.7 Влияние температуры на константу химического равновесия. Уравнение изобары Вант-Гоффа.
3.7 Влияние температуры на константу химического равновесия. Уравнение изобары Вант-Гоффа.
Количественно влияние температуры на константу равновесия выражается с помощью уравнения изобары Вант-Гоффа (р = const) или уравнения изохоры Вант-Гоффа (V = const). Для вывода уравнения изобары Вант-Гоффаз из уравнения
![]() (23)
(23)
найдем
частную производную от G
по Т при р = const:![]() (24)
(24)
Это получено, исходя из того, что начальная активность веществ не зависит от температуры, тогда:
(![]() )
то
)
то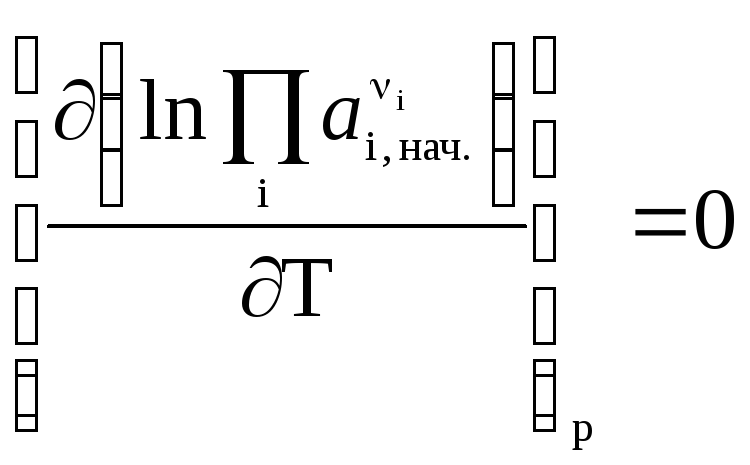 . (25)
. (25)
Подставляем
в уравнение Гиббса-Гемгольца
![]()
значения
G
и
![]() из
(23) и (25) соответственно
из
(23) и (25) соответственно
После преобразований имеем
![]() .
(26)
.
(26)
После преобразований имеем
![]() (27)
(27)
Здесь Н – тепловой эффект реакции при p = const.
Уравнение (27)– это уравнение изобары Вант-Гоффа в дифференциальной форме. Это уравнение показывает, как константа равновесия ka зависит от температуры.
Аналогичным способом, рассматривая F вместо G в соответствующих уравнениях типа (23) и (24), можно получить выражение для уравнения изохоры Вант-Гоффа в дифференциальной форме.
![]()
Здесь U – изменение внутренней энергии (т.е. тепловой эффект реакции при V = const).
Если
рассматривать газофазную реакцию, то
для идеальных газов можно записать
![]() и тогда
и тогда
![]() (28)
(28)
Рассмотрим случай, когда реакция проводится в стандартном состоянии при р = 1 атм, тогда уравнение (28) примет следующий вид:
![]() (29)
(29)
Рассмотрим, как изменяется kp с изменением температуры. Проанализируем соотношение (29) (здесь H0 – тепловой эффект соответствующей химической реакции в стандартном состоянии.
Возможны три случая.
1) H0 > 0
– эндотермическая реакция, протекающая
с поглощением теплоты. Так как R > 0;
T2 > 0,
тогда,
![]() .
Известно,
что если производная функции (у)
.
Известно,
что если производная функции (у)
![]() ,
то у – возрастающая функция (т.е. с
возрастанием аргумента ее значение
увеличивается, а с уменьшением –
уменьшается), тогда при увеличении
температуры (dT > 0) величина lnkp,
а, следовательно, и kp,
возрастает, а при уменьшении температуры
kp
уменьшается.
,
то у – возрастающая функция (т.е. с
возрастанием аргумента ее значение
увеличивается, а с уменьшением –
уменьшается), тогда при увеличении
температуры (dT > 0) величина lnkp,
а, следовательно, и kp,
возрастает, а при уменьшении температуры
kp
уменьшается.
2) H0 < 0 – экзотермическая реакция, протекающая с выделением теплоты.
![]() ;
тогда
;
тогда
![]() ,
следовательно, функция lnkp
убывающая,
то есть с ростом аргумента -температуры
величина lnkp
а, значит, и kp,
уменьшается.
,
следовательно, функция lnkp
убывающая,
то есть с ростом аргумента -температуры
величина lnkp
а, значит, и kp,
уменьшается.
3) H0 = 0;
![]() .
Функция lnkp
(а также и kp)
не зависит от температуры, то есть
kp –
постоянная при Т сonst.
.
Функция lnkp
(а также и kp)
не зависит от температуры, то есть
kp –
постоянная при Т сonst.
Зависимость kp (или kp) от температуры может иметь следующий вид:
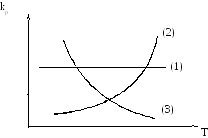
1. H01 = 0
2. H02 > 0
3. H03 < 0
Для получения интегральной формы уравнения изобары Вант-Гоффа нужно соответствующую дифференциальную форму проинтегрировать, для чего в уравнении (29) разделим переменные:
![]() .
(30)
.
(30)
Вычислим неопределенный интеграл:
![]() .
(31)
.
(31)
Если H0 не зависит от температуры, то
![]() (32)
(32)
(где А – некоторая константа).
Возьмем теперь определенный интеграл:
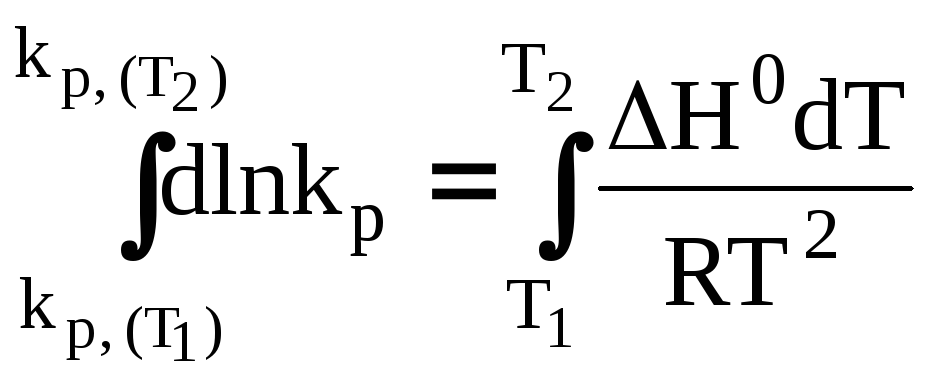 (33)
(33)
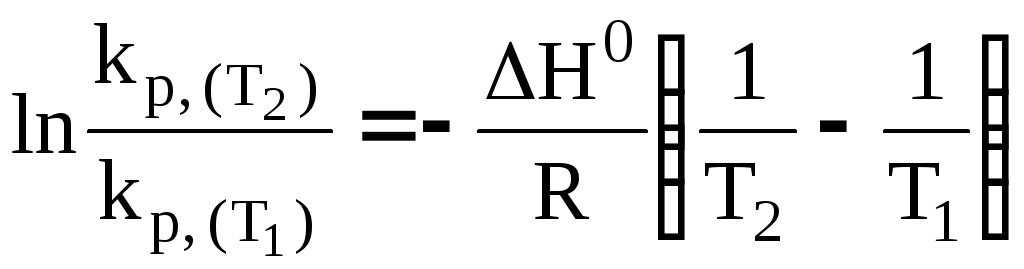 или
или
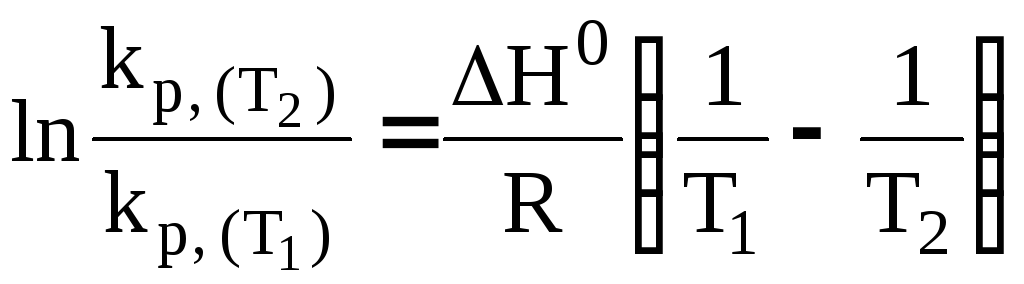 (34)
(34)
Таким
образом,
зная значения константы равновесия (![]() и
и![]() )
при двух температурах (Т1
и Т2),
можно рассчитать величину теплового
эффекта реакции
H0
или же, зная величину H0
и значение константы равновесия при
какой-либо температуре Т1,
можно определить kp
при другой температуре Т2.
)
при двух температурах (Т1
и Т2),
можно рассчитать величину теплового
эффекта реакции
H0
или же, зная величину H0
и значение константы равновесия при
какой-либо температуре Т1,
можно определить kp
при другой температуре Т2.
Из
уравнения (32) видно, что, зная зависимость
kp
от Т, можно графически определить
величину теплового эффекта химической
реакции. Надо провести линеаризацию
соответствующего уравнения (т.е.
осуществить выбор соответствующих
координат, чтобы получить прямую линию:
y = lnkp;
x
=![]() ).
).

10 < 0 (c ростом Т величина lnkp убывает);
20 = 0;
30 > 0 ( c ростом Т величина lnkp возрастает).
Из графика можно рассчитать величину теплового эффекта реакции:
![]() и
и ![]() .
.
![]()
