
- •Лекция 3
- •3.1 Закон действующих масс. Константа химического равновесия.
- •3.2 Условия равновесия для химической реакции.
- •Стандартные условия протекания реакции.
- •3.3 Изотерма химической реакции.
- •3.4 Связь между kр и kс.
- •3.5 Равновесие в гетерогенных реакциях.
- •3.6 Принцип Ле-Шателье.
- •3.7 Влияние температуры на константу химического равновесия. Уравнение изобары Вант-Гоффа.
3.2 Условия равновесия для химической реакции.
Рассмотрим
реакцию: N2
газ + 3 Н2
газ
![]() 2 NН3 газ
протекающую при р, Т = const. Изменения
количеств веществ в результате химической
реакции связаны между собой. Пусть
изменение числа молей N2
будет –0,2 моль; тогда изменение чисел
молей (
2 NН3 газ
протекающую при р, Т = const. Изменения
количеств веществ в результате химической
реакции связаны между собой. Пусть
изменение числа молей N2
будет –0,2 моль; тогда изменение чисел
молей (![]() n
) Н2
и NH3,
будет, соответственно
–30,2-0,6
и 20,2=0,4моль.
Таким образом
видно, что
n
) Н2
и NH3,
будет, соответственно
–30,2-0,6
и 20,2=0,4моль.
Таким образом
видно, что
![]()
Но
отношения
![]() будут одинаковыми для всех участников
реакции.
будут одинаковыми для всех участников
реакции.
![]() =
=
![]() =
=![]() =
=![]() = 0,2
= 0,2
При этом принято, что i 0 – для продуктов реакции, i 0 – для исходных веществ.
Величина
![]() называется
степенью полноты протекания реакции,
химической переменной или числом
пробегов реакции.
называется
степенью полноты протекания реакции,
химической переменной или числом
пробегов реакции.
Для любой химической реакции:
![]() ,(1)
,(1)
где
![]() (ξ– химическая переменная).
(ξ– химическая переменная).
Можно показать, что если i = сonst (т.е. если состав системы не меняется), то после интегрирования уравнения (1) получается
![]()
(i 0 – для продуктов, i 0 – для исходных веществ).
Для одного пробега реакции, т.е. в случае, когда ξ = 1 (когда прореагировали вещества в количествах, равных их стехиометрическим коэффициентам: ni = i), в условиях постоянного состава системы (в условиях бесконечно большого количества всех компонентов, когда химический потенциал i = сonst) изменение энергии Гиббса равно:
![]() или
или
![]()
Проанализируем последнее выражение.
Если G 0, то
![]() (2)
(2)
В этом случае реакция может протекать самопроизвольно слева направо при постоянных температуре и давлении.
Пусть G 0, тогда
![]() (3)
(3)
В этом случае реакция может протекать самопроизвольно справа налево при постоянных температуре и давлении.
Пусть G = 0, тогда
![]() (4)
(4)
Система находится в состоянии равновесия.
Условия (2–4) – условия направленности и равновесия процессов для любой химической реакции.
Стандартные условия протекания реакции.
В термодинамике под стандартными условиями понимают, что начальные активности всех компонентов ai равны единице, т.е. все ai = 1 (в случае идеальных газов это будет, когда все рi = 1 атм), причем начальные количества веществ будут настолько велики (бесконечно большие), что их изменение в результате протекания 1 пробега химической реакции не скажется на изменении состава исходной смеси, т.е. на протяжении реакции активности всех компонентов останутся постоянными и равными единице.
Тогда i = i0 (поскольку i = i0 + RT lnai). В результате получим:
![]() (5)
(5)
(i 0 – для продуктов, i 0 – для исходных веществ).
При равновесии будем иметь:
![]() ,
(6)
,
(6)
G0 – стандартное изменение энергии Гиббса в результате одного пробега химической реакции, протекающей при описанных выше стандартных условиях, (причем не тогда, когда робщ. = 1 атм, а когда рi всех участников реакции равны 1 атм и постоянны).
3.3 Изотерма химической реакции.
Уравнение изотермы (или просто изотерма) химической реакции позволяет связать возможное направление химической реакции с исходным составом реагирующих веществ. Уравнение изотермы химической реакции легко получить, используя следующие соотношения:
![]()
i = i0 + RTlnai, (7)
где аi – начальная активность i-ого компонента.
![]() (8)
(8)
Но
![]() ;
;
поэтому ![]() .
.
В
уравнении изотермы химической реакции
единицы измерения R = 8,314
![]() , [G]
= [G0]
= Дж.
, [G]
= [G0]
= Дж.
Здесь G – изменение энергии Гиббса для одного пробега реакции при заданных температуре и давлении и постоянном составе системы (когда количества всех веществ взяты бесконечно большими и их начальные активности заданы равными ai)
G0 – стандартное изменение энергии Гиббса для одного пробега той же реакции, если начальные активности равны единице.
Если задать начальные активности каждого из участников реакции равными их соответствующим равновесным активностям, то система (реакция) будет находиться в состоянии равновесия, поэтому G = 0, и из уравнения изотермы получим:
![]() (9)
(9)
где ![]() (10)
(10)
или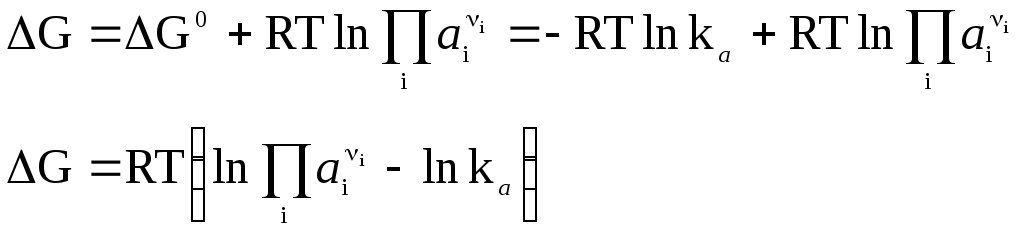 (11)
(11)
(здесь i 0 – для продуктов, i 0 – для исходных веществ).
G0 = –RT lnka (12)

тогда
![]() (13)
(13)
Для процессов, протекающих при постоянных объеме и температуре, можно получить аналогичное выражение для энергии Гельмгольца, подставив вместо ai концентрацию сi:
![]() (14)
(14)
где ![]() (15)
(15)
По уравнению изотермы химической реакции (11) с учетом соотношения (13) можно определить направление протекания химической реакции при заданных начальных концентрациях (парциальных давлениях) участников реакции и, например, при постоянных давлении и температуре.
Рассмотрим уравнение изотермы химической реакции в виде:
![]() ,
(16)
,
(16)
Может быть три случая:
1) ![]() .
СледовательноG < 0.
В системе термодинамически возможно
самопроизвольное протекание прямой
реакции при указанных выше условиях.
.
СледовательноG < 0.
В системе термодинамически возможно
самопроизвольное протекание прямой
реакции при указанных выше условиях.
2) ![]() .
СледовательноG > 0.
В этом случае термодинамически возможно
самопроизвольное протекание обратной
реакции.
.
СледовательноG > 0.
В этом случае термодинамически возможно
самопроизвольное протекание обратной
реакции.
3) ![]() .
СледовательноG = 0.
Данная система будет находиться в
состоянии химического равновесия.
.
СледовательноG = 0.
Данная система будет находиться в
состоянии химического равновесия.
Из анализа уравнения изотермы химической реакции видно, что, меняя начальные концентрации (парциальные давления) веществ, в принципе, можно менять и направление протекания реакции.
Иногда в качестве критерия приближенной оценки возможности протекания реакции используют не величину G, а величину G0, которую можно рассчитать на основании термодинамических характеристик участников реакции:
G0Т = 0Т – ТS0T;
0T = 0298 + С0р, 298 (Т – 298); (17)
S0T
= S0298
+ С0р, 298
ln![]() .
(18)
.
(18)
