
физика лекц / Лекция 8
.DOCЛекция 8.
ПЕРВОЕ НАЧАЛО ТЕРМОДИНАМИКИ И ИЗОПРОЦЕССЫ.
АДИАБАТИЧЕСКИЙ ПРОЦЕСС. ВТОРОЕ НАЧАЛО
ТЕРМОДИНАМИКИ. ЭНТРОПИЯ.
8.1. Применение первого начала термодинамики к изопроцессам.
Изопроцессами называют такие процессы, при которых один из параметров состояния ( P,V,T ) сохраняется постоянным.
Рассмотрим изобарный процесс, т.е. происходящий при постоянном давлении. Общая формула работы dA = p dV, проинтегрируем и получим
![]() A
= или A
= p(V2
- V1).
A
= или A
= p(V2
- V1).
Применим первое начало термодинамики
![]() .Тепло
расходуется на совершение работы и на
увеличение внутренней энергии
.Тепло
расходуется на совершение работы и на
увеличение внутренней энергии ![]() (8.1)
(8.1)
При изотермическом процессе, т.е. когда
T = const, dA = p dV.
Из уравнения Клапейрона - Менделеева
для одного моля
![]() .
Тогда
.
Тогда
 или
или
![]() .
.
Если для любого числа молей, то, применив первое начало термодинамики ,
получим
![]() (8.2)
(8.2)
При этом процессе все количество теплоты расходуется на совершение работы.
При изохорном процессе все количество теплоты идет на увеличение внутренней энергии системы, т.к. dV = 0, то и A = 0. Следовательно
![]() (8.3)
(8.3)
Графически работа при изопроцессах изображается площадью фигур на рис.8.1.
а) изобарический б) изотермический в) изохорный
Рис.8.1
8.2. Адиабатический процесс.
Процесс, протекающий без теплообмена с окружающей средой, называется адиабатическим.
Уравнение первого начала термодинамики, имеет вид: dQ = dU + dA. В случае адиабатического процесса dQ = 0 и dA = -dU.
Следовательно, при адиабатическом процессе работа совершается только за счет изменения внутренней энергии газа. При адиабатическом расширении газа совершает работу, а его внутренняя энергия и температура уменьшаются. При адиабатическом сжатии работа газа отрицательна, внутренняя энергия газа и температура возрастают.
Близкими к адиабатическому процессу могут быть быстропротекающие процессы, при реализации которых не происходит существенного теплообмена с окружающей средой.
Для адиабатического процесса первое начало термодинамики запишется: dU + pdV = 0 (8.4)
Для одного моля газа dU
=CVdT
(по известной формуле
![]() ),
a
),
a
![]() .
.
Подставив эти выражения в (8.4) и разделив все равенство на Т, получим
![]()
Интегрируя равенство в пределах от V1
до V2 и,
соответственно, от Т1 до
Т2, получим:
 ,
откуда
,
откуда
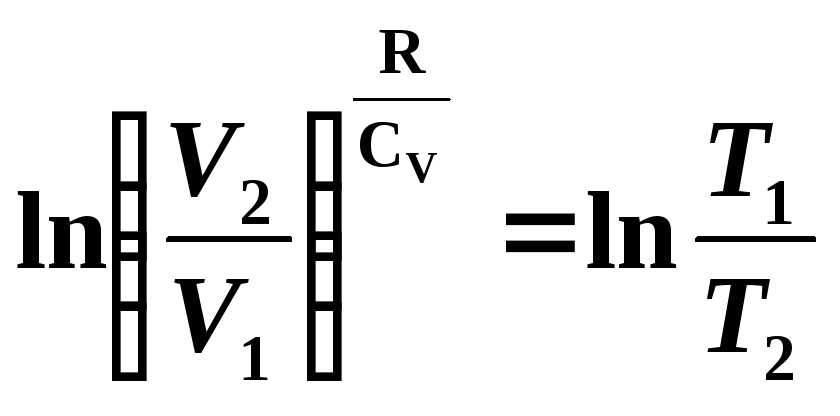 .
Потенцируя последнее равенство и
учитывая, что
.
Потенцируя последнее равенство и
учитывая, что
![]() ,
оно запишется в виде:
,
оно запишется в виде:
![]() или
или
![]()
Окончательно: TVγ-1=Const (8.5)
Применяя уравнение состояния PV=RT можно получить: PVγ=Const (8.6)
Уравнение (8.6) как и (8.5), называют уравнением Пуассона, оно описывает адиабатические процессы в идеальном газе.
Объединяя формулы dA=-dU и dU=CVdT, можно вывести элементарную работу совершаемую газом при адиабатическом процессе: dA=-CVdT (8.7)
В уравнении (8.5) γ>1, поэтому адиабата, изображаемая этим уравнением идет круче изотермы (рис 8.2).
Рис. 8.2 Рис. 8.3
При адиабатическом расширении из точки. А, адиабата опускается ниже изотермы, т.к. на этом участке уменьшается не только объем газа, но и его температура, а при адиабатическом сжатии адиабата поднимается выше изотермы, т.е. газ, нагревается. Если в уравнении (8.3) = n, то процесс называется политропным. Все изопроцессы и адиабатический процесс являются его частными случаями. В этом можно убедиться, взяв n = 1, n = 0, n = и
n = . Эти процессы имеют общую особенность - они происходят при постоянной теплоемкости газа.
8.3. Круговые процессы. Цикл Карно. Второе начало
термодинамики.
Круговым процессом или циклом называется процесс, при котором система, пройдя ряд состояний, возвращается в исходное. Круговой процесс изображен на рис. 8.3 замкнутой кривой линией.
Цикл разбивается на процесс расширения и сжатия газа. Работа расширения - это площадь 1a 2V2 V1 1 - положительна. Работа сжатия, площадь 2 b 1 V1 V2 2 - отрицательна. Общая работа А = А1 - А2.Если в результате цикла совершается работа, то система, периодически повторяющая цикл - машина (тепловая или холодильная). С. Карно в 1824 г. теоретически рассмотрел работу идеальной тепловой машины из одного моля идеального газа (рабочее вещество) заключенного в цилиндре под поршнем. Цикл Карно изображен на рис. 8.4 и состоит из двух изотерм и двух адиабат.
Рис. 8.4 Рис. 8.5
В точке 1 подключался нагреватель (тепло Q1). В точке 2 нагреватель отключен. При адиабатическом расширении 2-3 теплообмен с окружающей средой отсутствует. В точке 3 подключался холодильник, иначе площади цикла, т.е. работы за цикл, не получиь. За счет полученного тепла совершалась работа А1 (изотермическое расширение), A`1(адиабатическое расширение), А2(изотермическое сжатие), А`2 (адиабатическое сжатие). При этом А1=А2; А1-А2=А. На участке 3-4 от системы отнималось тепло Q2, Таким образом, QQ2=А. Работа получена при условии отдачи тепла холодильнику. Следовательно, невозможен механизм, который все полученное от нагревателя тепло переводил бы в работу, часть тепла должна быть отдана холодильнику. Это второе начало термодинамики. Иногда формулируется: вечный двигатель второго рода невозможен. Второе начало термодинамики характеризуется схемой (рис. 8.5).
Найдем коэффициент полезного действия
идеальной тепловой машины. Из известных
формул для к.п.д.
![]()
можно записать

Применяя
 ;
;
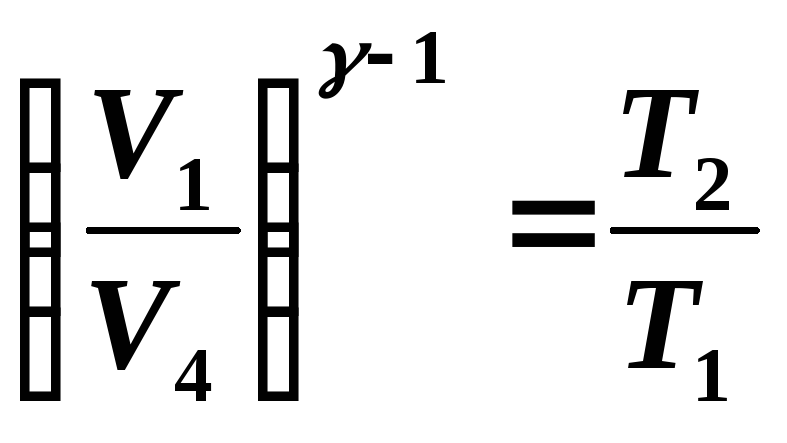 ,
получим
,
получим
![]() или
или
![]() (8.8)
(8.8)
Коэффициент полезного действия идеальной тепловой машины всегда<1. Учитывая ещё и трение <<1. например, к.п.д. паровой машины не более 20%.
8.4. Понятие об энтропии
Из формул коэффициента полезного
действия тепловой машины
![]() можно получить, что
можно получить, что
![]() .
Величина
.
Величина
![]() называется приведенной теплотой.
Следовательно, для любого цикла Карно
сумма приведенных теплот равна нулю.
называется приведенной теплотой.
Следовательно, для любого цикла Карно
сумма приведенных теплот равна нулю.
Это положение распространяется с помощью несложных рассуждений на любой обратимый круговой процесс и в конечном счете записывается:
![]()
Подынтегральное выражение
![]() есть полный дифференциал некоторой
функции S, т.е. dS
, которая зависит от состояния системы
и не зависит от пути, которым система
пришла в это состояние. Таким образом:
есть полный дифференциал некоторой
функции S, т.е. dS
, которая зависит от состояния системы
и не зависит от пути, которым система
пришла в это состояние. Таким образом:
![]() (8.9)
(8.9)
Эта функция была введена в 1865 г. Клаузиусом и названа им энтропией. Как и энергия она является важной характеристикой состояния системы. Клаузисом были получены следующие важные положения, которые приведем без доказательств.
Энтропия системы, состоящей из нескольких тел, равна сумме энтропий этих тел.
Если в изолированной системе проходят обратимые процессы, то её энтропия остается неизменной. Если в изолированной системе происходят необратимые процессы, то её энтропия возрастает. Энтропия изолированной системы не может уменьшаться ни при каких процессах. Математически эти положения можно записать в виде неравенства
∆S > 0 , (8.10)
называемого неравенством Клаузиуса.
Ранее отмечалось, что все реальные процессы являются необратимыми. Поэтому, можно утверждать, что все процессы в конечной изолированной системе ведут к увеличению её энтропии. Это положение называется принципом возрастания энтропии. Вместе с тем оно представляет собой еще одну формулировку второго начала термодинамики, указывающую направление реальных процессов: возможны лишь такие процессы, которые ведут к увеличению энтропии изолированной системы.
