Desktop / Лабораторная работа №5
.docxФедеральное агентство по образованию
Государственное образовательное учреждение высшего профессионального
Образования (ГОУ ВПО)
Уфимский государственный нефтяной технический университет
Филиал УГНТУ в г. Салавате
Общая неорганическая химия
Отчет по лабораторной работе №5
ГИДРОЛИЗ
ХТП -140610.65-01.04.00 ЛР
Исполнил:
ст.гр. АП-08-21 Д. С. Андреев
Руководитель
ассистент: Р. Р. Вахидов
Салават 2008
Цель: Исследование явления гидролиза растворов.
Ход работы.
Дегидратация медного купороса и гидратация сульфата меди.
Выполнение опыта: в сухую пробирку поместить 2-3 лопаточки медного купороса. Закрепите пробирку в штативе, так чтобы дно ее было чуть выше, чем отверстие. Нагрейте соль, находящуюся в пробирке (в начале нагревают всю пробирку, а потом дно, т.е. саму соль). Соль посветлела. Когда вся соль посветлеет, прекратите нагревание, дайте пробирке остыть. Затем к остывшей соли добавьте несколько капель воды. Соль снова приобрела прежний цвет (синий).
CuSO4 * 5 H2O → CuSO4 + 5 H2O ↑
Синий Бесцветный
CuSO4 + 5 H2O → CuSO4 * 5 H2O
Бесцветный Синий
Окраска некоторых кислотно-основных индикаторов в кислой, нейтральной и щелочной среде.
Выполнение опыта: налейте в 6 пробирок по 10 капель дистиллированной воды. В две крайние левые добавьте 2 капли 2н. раствора НСl, в две крайние правые 3 капли 2н. раствора NaOH, а в две средние ничего не добавляйте. Теперь в три пробирки внесите по 1 капле фенолфталеина, в другие три по 1 капле метил - оранжевого. Отметьте окраску индикаторов в каждой из пробирок.
Запись данных опыта: результат опыта записан в виде таблицы:
Таблица 1
|
Индикатор |
Интервал |
Окраска индикатора в различных средах |
||
|
кислая |
щелочная |
нейтральная |
||
|
Фенолфталеин |
8,0-9,8 |
Бесцветный (pH<8.0) |
Малиновый (pH>9.8) |
Бледно- малиновый (8.0<pH<9.8) |
|
Метилоранжевый |
3,1-4,4 |
Малиновый) (pH<3.1) |
Желтый (pH>4.4) |
Оранжевый (3.1<pH<4.4) |
Смещение ионного равновесия
Выполнение опыта: б) в две пробирки внесите по одной капле фенолфталеина. В одну из пробирок внесите 1- 2 лопаточки сухой соли хлорида аммония.
Запись данных опыта:
-
Сl - + NH4 + + H2O + Митилоранж → Малиновый (Н++Cl-+NH4OH)
Сильная Слабое
кислота основание
В этом опыте наблюдается гидролиз хлорида аммония. Так как соляная кислота является сильной кислотой а, гидроксид аммония слабым основанием то, их соль будит иметь кислую реакцию.
Реакция с образованием слабого электролита.
Выполнение опыта: а) внести в пробирку по 2-3 капли хлорида железа и такое же количество едкого натра.
FeCl3+3
NaOH= Fe(OH)3
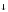 +3NaCl
+3NaCl
Fe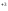 +3Cl
+3Cl +3Na
+3Na
 +3OH
=Fe(OH)3
+3OH
=Fe(OH)3 +3Cl
+3Cl
 +3Na
+3Na
Fe
 +3OH
+3OH = Fe(OH)3
= Fe(OH)3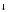
Во вторую пробирку внести несколько капель ацетата натрия и несколько капель серной кислоты (1:1), перемешать раствор стеклянной палочкой и слегка нагреть. Определите по запаху, что образовалась уксусная кислота.
2CHC3OONa+ H2SO4=2CHC3OOH+ Na2SO4
2H +2CHC3OO
+2CHC3OO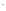 +2Na
+2Na
 +SO4
+SO4
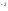 =2CHC3OOH+
2Na
=2CHC3OOH+
2Na +SO4
+SO4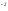
CHC3OO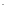 +H
+H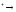 CHC3OOH
CHC3OOH
б) в третью и четвертую внесите по 5-7 капель раствора карбоната натрия. Проверьте наличие в растворе иона СО3, для чего в одну пробирку добавьте несколько капель хлорида кальция.
CaCl2 + Na2CO3 = CaCO3↓ +2NaCl
Ca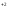 +2Cl
+2Cl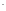 +2Na
+2Na + CO3
+ CO3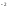 =
CaCO3↓
+2Na
=
CaCO3↓
+2Na + CO3
+ CO3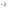
Ca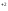 + CO3
+ CO3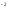 = CaCO3
↓
= CaCO3
↓
В другую пробирку добавьте несколько капель серной кислоты (1:1) и наблюдайте выделение газа. Пробирку слегка подогрейте, дождитесь конца реакции и добавьте несколько капель раствора хлорида кальция, осадок не выпадает.
Na2CO3 + H2SO4 = Na2SO4 + H2O + CO2↑
2H +
SO4
+
SO4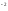 +Na
+Na
 +
CO3
+
CO3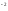 =
H2O +CO2↑ +2Na
=
H2O +CO2↑ +2Na + SO4
+ SO4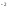
2H + CO3
+ CO3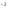 = H2O
+CO2↑
= H2O
+CO2↑
Условия выпадения и растворения осадков. Произведение растворимости.
Выполнение опыта: а) в две пробирки поместить по 15-20 капель 0,005н раствора нитрата свинца. В одну из них добавить такой же объем 0,05н раствора иодида калия, выпадет бурый осадок, в другую такой же объем 0,05н раствора хлорида калия.
1).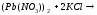
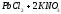
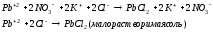
2).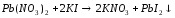
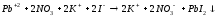
Pb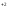 +2
I
+2
I
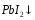
Концентрация ионов:
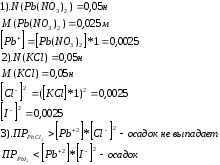
Запись данных опыта: Зная ПР хлорида свинца, иодида свинца, вычислите в каждом отдельном случае концентрацию ионов. Результаты расчетов оформите в таблице:
Таблица 2
|
Малорастворимое соединение |
ПР |
Концентрация ионов |
Произведение концентрации ионов |
|
PbCl2
PbI2 |
1,6·10ˉˉ
1,1·10ˉˉ |
[Pb
[
Pb
|
[
Pb
[
Pb
|
Выполнение опыта: б) налейте в пробирку 2-3 капли раствора хромата калия и добавьте 1-2 капли нитрата серебра. Образовался коричневатый осадок хромата серебра.
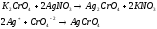
После чего добавили к содержимому пробирки 2 - 3 капли раствора хлорида натрия. Раствор пожелтел.
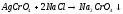
Добавьте 3-4 капли сероводородной воды, раствор потемнел.
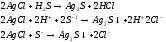
Запись данных опыта: Зная ПР хромата серебра, хлорида серебра, сульфата серебра, вычислите в каждом отдельном случае концентрацию ионов серебра. Результаты расчетов оформите в таблице:
Таблица 3
|
Малорастворимое соединение |
ПР |
Концентрация
ионов Ag |
|
Ag2CrO4
AgCl
Ag2S
|
1·10ˉˉ
1,8·10ˉˉ
6,3·10ˉˉ |
1,2*10
1,34*10
5*10 |
-
ПР(Ag

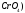 =
=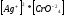
Обозначим р-римость
Ag
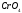 через S(
через S(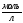 ),
тогда
),
тогда
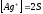
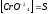
ПР=4S S=0,6*10
S=0,6*10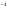
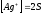 =1,2*10
=1,2*10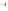 (
(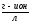 )
)
-
ПР(AgCl)=
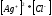 =S
=S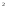
-
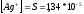 (
(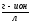 )
)
-
ПР(Ag
 S)
)=
S)
)=
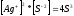
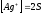 =5*10
=5*10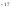 (
(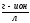 )
)

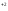 ]
=[Cl
]
=[Cl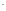 ]=0,0025
]=0,0025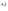 ]=
[I
]=
[I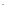 ]
=0,0025
]
=0,0025
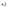 ]
[Cl
]
[Cl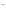 ]
]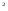 =0,625*10
=0,625*10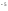
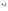 ]
[I
]
[I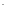 ]
]
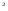 = 0,625*10
= 0,625*10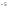
 (
(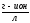 )
)