- •Введение
- •1. Растворы электролитов
- •1.1. Основные положения теории электролитической диссоциации с.Аррениуса
- •1.2. Механизмы образования растворов электролитов
- •1.3. Электропроводность растворов электролита
- •1.4. Электродный потенциал и его возникновение
- •Контрольные вопросы
- •Примеры решения задач
- •Задачи для самостоятельной работы:
- •2. Гальванический элемент
- •2.1. Общие понятия о работе гальванического элемента
- •2.2. Стандартный электродный потенциал
- •2.3. Ряд стандартных электродных потенциалов металлов
- •2.4. Поляризация и перенапряжение
- •2.5. Термодинамика обратимых электрохимических систем
- •2.6. Классификация электродов
- •2.7. Электрохимические цепи
- •Контрольные вопросы
- •Примеры решения задач
- •Задачи для самостоятельной работы:
- •3. Электролиз
- •3.1. Сущность электролиза
- •3.2. Электрохимическая система (ячейка)
- •3.3. Электролиз водных растворов
- •3.4. Поляризация электродов в процессе электролиза
- •3.5. Напряжение разложения. Явление перенапряжения
- •3.6. Электролиз органических соединений
- •3.7. Законы электролиза. Выход по току
- •3.8. Применение электролиза
- •Контрольные вопросы
- •Примеры решения задач
- •Задачи для самостоятельной работы:
- •4. Коррозия металлов
- •4.1. Классификации коррозионных процессов
- •4.2. Химическая коррозия
- •4.2.1. Взаимодействие с кислородом
- •4.2.2. Факторы, влияющие на скорость химической коррозии
- •4.2.3. Коррозия металлов в жидкостях – неэлектролитах
- •4.2.4. Сероводородная коррозия
- •Водородное охрупчивание металла
- •4.3. Электрохимическая коррозия (микрогальванокоррозия)
- •4.3.1. Условия протекания электрохимической коррозии
- •4.3.2. Диаграмма Пурбэ
- •4.3.3. Атмосферная коррозия металлов
- •4.3.4. Коррозия в морской воде
- •4.3.5. Подземная коррозия трубопроводов
- •4.4. Биохимическая коррозия
- •4.5. Коррозия блуждающими токами
- •4.6. Поляризация электродных процессов при коррозии
- •4.7. Защита металлов от коррозии
- •4.7.1. Легирование
- •4.7.2. Защитные покрытия
- •Методы борьбы с подземной коррозией
- •4.7.3. Металлические защитные покрытия
- •4.7.4. Электрохимическая защита
- •Методы борьбы с блуждающими токами
- •4.7.5. Ингибиторы коррозии металлов
- •4.7.6. Способы защиты от коррозии в морской воде
- •Контрольные вопросы
- •Примеры решения задач
- •Задачи для самостоятельной работы:
- •Тесты для самостоятельного решения
- •Перенапряжение катодного восстановления водорода и некоторых металлов из водных растворов при 25 0с
- •Значения фактора Пиллинга-Бэдвордса для некоторых металлов
2.2. Стандартный электродный потенциал
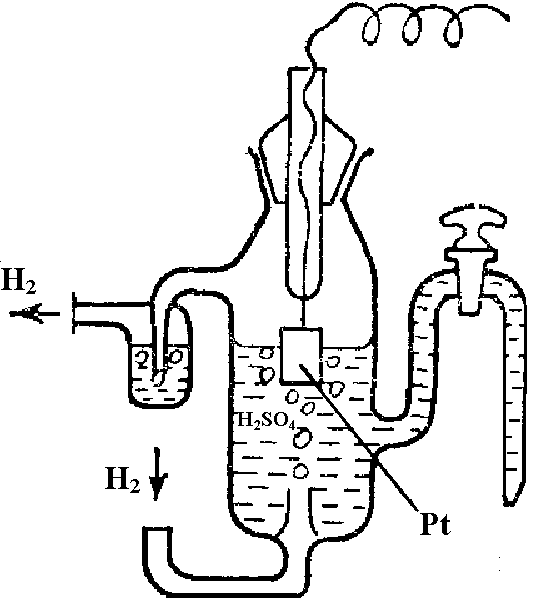
Скачок потенциала на границе металл – раствор, как и разности потенциалов между двумя точками, находящимися в различных фазах, экспериментально измерить невозможно. Поскольку экспериментально можно измерить лишь величину ЭДС электрохимической цепи, то опытным путем можно определить только относительные величины так называемых электродных потенциалов, т.е. ЭДС цепи, составленной из данного электрода и некоторого стандартного электрода, потенциал которого условно принимают равным нулю. Таким стандартным электродом, или электродом сравнения, является обратимый водородный электрод – стеклянный сосуд, наполненный раствором сильной кислоты (HCl или H2SO4) с концентрацией ионов водорода [Н+] = 1 моль/л, в который частично погружена платиновая пластинка, покрытая платиновой чернью (порошкообразная платина), способная адсорбировать подаваемый газообразный водород при давлении 1 атм (рис. 7).
|
|
|
Рис. 7. Стандартный водородный электрод |
Этому электроду отвечает обратимый процесс, который можно записать в виде
2Н+
+2ē ↔ Н2,
![]() .
.
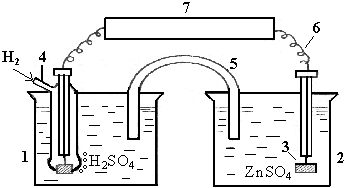
Соединив с водородным электродом в гальванический элемент другой полуэлемент, можно определить ЭДС этого гальваноэлемента, а по ней – относительный стандартный электродный потенциал данной гальванопары (приложение 1). Например, в гальваноэлементе Zn0|Zn2+||2H+|H2ЭДС, определяемая вольтметром равна 0,76B (см. рис. 8).
Знак «+» электродного потенциала отвечает движению ионов от раствора к электроду в элементе, где рассматриваемый электрод соединен с водородным электродом, и движению электронов по внешней цепи от водородного электрода. Знак «–» ставится перед значением электродного потенциала при движении ионов и электронов в обратном направлении.
|
|
|
Рис. 8. Схема прибора для определения стандартного потенциала пары Zn/Zn2+:1, 2 – стаканы с электролитами; 3 – цинковая пластина; 4-стандартный водородный электрод; 5- внутренняя цепь; 6-внешняя цепь; 7-потенциометр |
Поскольку в нашем примере опытным путем установлено повышение концентрации ионов Zn2+ и уменьшение концентрации ионов H+, то значения электродного потенциала цинкового электрода следует приводить со знаком «–».
Относительно стандартного водородного электрода можно определить потенциалы не только пар Ме/Меn+, но и пар, составленных из любого восстановителя и его окисленной формы и любого окислителя и его восстановленной формы.
2.3. Ряд стандартных электродных потенциалов металлов
Если расположить
все металлы по возрастанию величины
стандартного электродного потенциала,
получают ряд стандартных электродных
потенциалов металлов,
который представляет собой электрохимическую
характеристику металлов. В этом ряду,
чем ниже алгебраическая величина
электродного потенциала, тем с большей
легкостью данный металл отдает электроны
(окисляется) и тем самым проявляет более
высокую восстановительную способность.
Например, Ca
(![]() =
–2,8 В)
является лучшим восстановителем, чем
железо (
=
–2,8 В)
является лучшим восстановителем, чем
железо (![]() =
–0,44 В).Чем больше алгебраическая величина
электродного потенциала, тем тяжелее
данный металл отдает электроны, а катион,
соответствующий данному металлу,
является более активным акцептором
электронов. Например, катионCu2+более сильный окислитель, чемZn2+,
а тем болееCu2+. Таким
образом, в электрохимическом ряду
стандартных электродных потенциалов
с возрастанием величины стандартного
электродного потенциала металлов
увеличивается окислительная способность
катионов, соответствующих этим металлам,
восстановительная же способность атомов
металлов в этом ряду уменьшается. С
уменьшением стандартного электродного
потенциала наблюдается зависимость,
противоположная рассмотренной выше.
=
–0,44 В).Чем больше алгебраическая величина
электродного потенциала, тем тяжелее
данный металл отдает электроны, а катион,
соответствующий данному металлу,
является более активным акцептором
электронов. Например, катионCu2+более сильный окислитель, чемZn2+,
а тем болееCu2+. Таким
образом, в электрохимическом ряду
стандартных электродных потенциалов
с возрастанием величины стандартного
электродного потенциала металлов
увеличивается окислительная способность
катионов, соответствующих этим металлам,
восстановительная же способность атомов
металлов в этом ряду уменьшается. С
уменьшением стандартного электродного
потенциала наблюдается зависимость,
противоположная рассмотренной выше.
Все металлы, расположенные в электрохимическом ряду стандартных электродных потенциалов до водорода, имеют более отрицательный потенциал, чем у водорода, а следовательно, в стандартных условиях могут быть окислены Н+. По этой причине эти металлы могут вытеснять водород из растворов разбавленных сильных минеральных кислот. Металлы, расположенные после водорода, не вытесняют водород из растворов разбавленных кислот.
Потенциал водородного электрода зависит от концентрации катионов Н+в растворе
|
φ = φ0 + 0,059lg [H+], (t = 250C), |
(2.8) |
где φ0– стандартный потенциал водородного электрода, равный нулю;
|
тогда φ=0,059lg[H+] |
(2.9) |
или, учитывая, что lg [H+] = – pH, получаем
|
φ = –0,059pH. |
(2.10) |
Подставляя значения
водородных показателей, получаем, что
в нейтральной среде (рН = 7)
![]() = –0,41 В, в кислой среде (рН = 0)
= –0,41 В, в кислой среде (рН = 0)![]() = 0 В и в щелочной среде
= 0 В и в щелочной среде![]() принимает значение, равное –0,82 В.
принимает значение, равное –0,82 В.
Из этого следует, что металлы, имеющие более отрицательный потенциал, чем –0,41 В, могут восстанавливать водород из воды. К ним относятся металлы, включая кадмий. Однако на практике не все металлы, расположенные до кадмия, вытесняют водород из воды, а металлы, расположенные до водорода, – водород из растворов кислот. Это происходит потому, что при окислении некоторых металлов на их поверхности образуются нерастворимые пленки, препятствующие дальнейшему взаимодействию. Примером этому может служить пассивирование свинца в серной кислоте из-за нерастворимости соли PbSO4. Металлы в электрохимическом ряду до магния взаимодействуют с водой, магний вытесняет водород из горячей воды, а все последующие металлы, включая кадмий, образуют на поверхности нерастворимые гидроксиды и не взаимодействуют с водой.
Таким образом, ряд стандартных электродных потенциалов металлов нужно использовать с учетом особенностей данного химического процесса.