- •Введение
- •1. Растворы электролитов
- •1.1. Основные положения теории электролитической диссоциации с.Аррениуса
- •1.2. Механизмы образования растворов электролитов
- •1.3. Электропроводность растворов электролита
- •1.4. Электродный потенциал и его возникновение
- •Контрольные вопросы
- •Примеры решения задач
- •Задачи для самостоятельной работы:
- •2. Гальванический элемент
- •2.1. Общие понятия о работе гальванического элемента
- •2.2. Стандартный электродный потенциал
- •2.3. Ряд стандартных электродных потенциалов металлов
- •2.4. Поляризация и перенапряжение
- •2.5. Термодинамика обратимых электрохимических систем
- •2.6. Классификация электродов
- •2.7. Электрохимические цепи
- •Контрольные вопросы
- •Примеры решения задач
- •Задачи для самостоятельной работы:
- •3. Электролиз
- •3.1. Сущность электролиза
- •3.2. Электрохимическая система (ячейка)
- •3.3. Электролиз водных растворов
- •3.4. Поляризация электродов в процессе электролиза
- •3.5. Напряжение разложения. Явление перенапряжения
- •3.6. Электролиз органических соединений
- •3.7. Законы электролиза. Выход по току
- •3.8. Применение электролиза
- •Контрольные вопросы
- •Примеры решения задач
- •Задачи для самостоятельной работы:
- •4. Коррозия металлов
- •4.1. Классификации коррозионных процессов
- •4.2. Химическая коррозия
- •4.2.1. Взаимодействие с кислородом
- •4.2.2. Факторы, влияющие на скорость химической коррозии
- •4.2.3. Коррозия металлов в жидкостях – неэлектролитах
- •4.2.4. Сероводородная коррозия
- •Водородное охрупчивание металла
- •4.3. Электрохимическая коррозия (микрогальванокоррозия)
- •4.3.1. Условия протекания электрохимической коррозии
- •4.3.2. Диаграмма Пурбэ
- •4.3.3. Атмосферная коррозия металлов
- •4.3.4. Коррозия в морской воде
- •4.3.5. Подземная коррозия трубопроводов
- •4.4. Биохимическая коррозия
- •4.5. Коррозия блуждающими токами
- •4.6. Поляризация электродных процессов при коррозии
- •4.7. Защита металлов от коррозии
- •4.7.1. Легирование
- •4.7.2. Защитные покрытия
- •Методы борьбы с подземной коррозией
- •4.7.3. Металлические защитные покрытия
- •4.7.4. Электрохимическая защита
- •Методы борьбы с блуждающими токами
- •4.7.5. Ингибиторы коррозии металлов
- •4.7.6. Способы защиты от коррозии в морской воде
- •Контрольные вопросы
- •Примеры решения задач
- •Задачи для самостоятельной работы:
- •Тесты для самостоятельного решения
- •Перенапряжение катодного восстановления водорода и некоторых металлов из водных растворов при 25 0с
- •Значения фактора Пиллинга-Бэдвордса для некоторых металлов
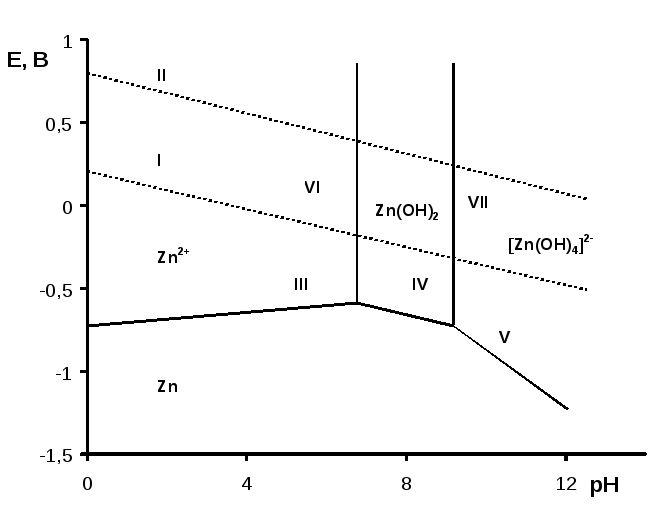
4.3.2. Диаграмма Пурбэ
Форма существования катионов металлов в водном растворе зависит от рН и присутствия каких-либо компонентов коррозионной среды, способных связывать катионы металлов. Гидратированные катионы металлов (Меz+) могут превращаться в оксокатионыMeO+(z-2), гидроксокатионыMeOH+(z-1), гидроксидыMe(OH)n, комплексные соединения, плохорастворимые соли.
Равновесие между металлом, раствором, содержащим его ионы, и твердыми кислородными соединениями этого металла удобно рассматривать на диаграмме Пурбэ, по осям которой откладываются равновесный потенциал Е и значение рН. На рис. 12 изображена диаграмма Пурбэ (Е – рН) системы Zn–H2Oс учетом образованияZn2+–ионов в кислой, [Zn(OH)4]2-–ионов в щелочной и твердогоZn(OH)2в нейтральных средах.
Приведенные на диаграмме горизонтальные и наклонные прямые линии отображают равновесные потенциалы электрохимических систем как функцию от рН.
|
Zn↔Zn2++ 2ē |
(линия III) |
|
Zn+ 2OH–↔Zn(OH)2+ 2ē |
(линия IV) |
|
Zn + 4OH– ↔ [Zn(OH)4]2– + 2ē |
(линия V) |
Вертикальные линии соответствуют значениям рН, при которых устанавливаются равновесия:
|
Zn2++ 2OH–↔Zn(OH)2 |
(линия VI) |
|
Zn(OH)2 + 2H2O ↔ [Zn(OH)4]2– + 2H+ |
(линия VII) |
Заштрихованная полоса разделяет области рН, при которых в растворе преобладают ионы Zn2+или [Zn(OH)4]2–. На диаграмме нанесены также прямые, показывающие влияние рН на потенциалы водородного (линияI) и кислородного (линияII) электродов соответственно.
На приведенной диаграмме Пурбэ областям, ограниченным линиями, соответствует одно термодинамически устойчивое состояние. Так, например, в области, ниже линий III–IV–V, устойчив металлZnи коррозии он не подвергается, а в области, ограниченной линиямиVI–IV–VII, устойчивым является гидроксидZn(OH)2.
|
|
|
Рис. 12. Диаграмма Пурбэ (Е – рН) для системы Zn–Н2О |
4.3.3. Атмосферная коррозия металлов
Атмосферная коррозия металлов – наиболее распространенный вид коррозии, которая зависит от степени увлажненности поверхности металлов. И по этому признаку ее подразделяют на три типа:
1) мокрая атмосферная коррозия (при относительной влажности воздуха 100%) при наличии видимой пленки влаги на поверхности металла;
2) влажная атмосферная коррозия при наличии на поверхности металла невидимой пленки влаги, которая образуется при капиллярной, адсорбционной или химической конденсации;
3) сухая атмосферная коррозия при полном отсутствии влаги на поверхности металла.
В реальных условиях все эти типы коррозии взаимно переходят друг в друга. Механизм атмосферной коррозии включает электрохимическую и химическую коррозию. На скорость атмосферной коррозии металлов влияют следующие факторы:
1) влажность воздуха;
2) примеси воздуха (газы SO2,SO3,H2S,NH3,Cl2,HClи др. в контакте с водой);
3) характер атмосферы;
4) географическая зона;
5) состояние поверхности корродирующего металла;
6) наличие инородных включений в металле;
7) температура.