
- •Введение
- •1. Растворы электролитов
- •1.1. Основные положения теории электролитической диссоциации с.Аррениуса
- •1.2. Механизмы образования растворов электролитов
- •1.3. Электропроводность растворов электролита
- •1.4. Электродный потенциал и его возникновение
- •Контрольные вопросы
- •Примеры решения задач
- •Задачи для самостоятельной работы:
- •2. Гальванический элемент
- •2.1. Общие понятия о работе гальванического элемента
- •2.2. Стандартный электродный потенциал
- •2.3. Ряд стандартных электродных потенциалов металлов
- •2.4. Поляризация и перенапряжение
- •2.5. Термодинамика обратимых электрохимических систем
- •2.6. Классификация электродов
- •2.7. Электрохимические цепи
- •Контрольные вопросы
- •Примеры решения задач
- •Задачи для самостоятельной работы:
- •3. Электролиз
- •3.1. Сущность электролиза
- •3.2. Электрохимическая система (ячейка)
- •3.3. Электролиз водных растворов
- •3.4. Поляризация электродов в процессе электролиза
- •3.5. Напряжение разложения. Явление перенапряжения
- •3.6. Электролиз органических соединений
- •3.7. Законы электролиза. Выход по току
- •3.8. Применение электролиза
- •Контрольные вопросы
- •Примеры решения задач
- •Задачи для самостоятельной работы:
- •4. Коррозия металлов
- •4.1. Классификации коррозионных процессов
- •4.2. Химическая коррозия
- •4.2.1. Взаимодействие с кислородом
- •4.2.2. Факторы, влияющие на скорость химической коррозии
- •4.2.3. Коррозия металлов в жидкостях – неэлектролитах
- •4.2.4. Сероводородная коррозия
- •Водородное охрупчивание металла
- •4.3. Электрохимическая коррозия (микрогальванокоррозия)
- •4.3.1. Условия протекания электрохимической коррозии
- •4.3.2. Диаграмма Пурбэ
- •4.3.3. Атмосферная коррозия металлов
- •4.3.4. Коррозия в морской воде
- •4.3.5. Подземная коррозия трубопроводов
- •4.4. Биохимическая коррозия
- •4.5. Коррозия блуждающими токами
- •4.6. Поляризация электродных процессов при коррозии
- •4.7. Защита металлов от коррозии
- •4.7.1. Легирование
- •4.7.2. Защитные покрытия
- •Методы борьбы с подземной коррозией
- •4.7.3. Металлические защитные покрытия
- •4.7.4. Электрохимическая защита
- •Методы борьбы с блуждающими токами
- •4.7.5. Ингибиторы коррозии металлов
- •4.7.6. Способы защиты от коррозии в морской воде
- •Контрольные вопросы
- •Примеры решения задач
- •Задачи для самостоятельной работы:
- •Тесты для самостоятельного решения
- •Перенапряжение катодного восстановления водорода и некоторых металлов из водных растворов при 25 0с
- •Значения фактора Пиллинга-Бэдвордса для некоторых металлов
2.7. Электрохимические цепи
Из обратимых электродов (полуэлементов) могут быть составлены обратимые электрохимические системы, так называемые электрохимические системы, называемые электрохимическими цепями. Различают три вида электрохимических цепей – физические, химические и концентрационные.
В физических цепях источником энергии служит различие в физическом состоянии двух одинаковых по своему химическому составу электродов. Эти электроды погружены в один и тот же раствор и при работе цепи электрод, находящийся в менее устойчивом состоянии, переходит в более устойчивое состояние. Разновидностью физических цепей являются аллотропные цепи, в которых менее устойчивое состояние одного электрода обусловлено тем, что он изготовлен из метастабильной модификации данного металла и обладает более высоким запасом энергии. В этой цепи ЭДС возникает за счет реакции превращения метастабильной модификации в более стабильную. Другая разновидность физических цепей – это гравитационные цепи. Работа гальванического элемента гравитационного типа основана на различии потенциальной энергии двух электродов, расположенных на различной высоте. В результате электрохимических процессов происходит растворение металла электрода с более высоким уровнем и восстановление ионов металла на другом электроде.
Химические цепи состоят из электродов, потенциалопределяющие реакции которых различны. Электрическая энергия возникает за счет энергии химической реакции, протекающей в цепи. Химические цепи разнообразны по природе и свойствам электродов, из которых они состоят. Химические цепи имеют большое практическое значение. Разнообразные химические источники тока – первичные (гальванические элементы) и вторичные (аккумуляторы) – представляют собой химические цепи. Рассмотрим пример водородно-кислородной цепи топливного гальванического элемента.
–Pt, H2 |H+, OH¯|O2, Pt+
При работе такого элемента на водородном электроде идет реакция окисления водорода
2H2 – 4ē ↔ 4H+.
на кислородном – восстановление кислорода до гидроксид-иона:
O2 + 2H2O + 4ē ↔ 4OH¯.
Cуммарная реакция в элементе:
2H2 + O2 + 2H2O ↔ 4OH¯ + 4H+
или 2H2 + O2 ↔ 2H2O.
ЭДС цепи элемента рассчитывается в соответствии с уравнением Нернста:
|
|
(2.25) |
где PО2, PН2– относительные парциальные давления кислорода и водорода на электродах.
Примером вторичного химического источника тока служит свинцовый (кислотный) аккумулятор:
–Pt|H2SO4|PbO2, Pb+
на электродах которого протекает токообразующая реакция:
Pb + SO2-4 – 2ē ↔ PbSO4
PbO2 + 4H+ + SO2-4 + 2ē ↔ PbSO4 + 2H2O.
Суммарная реакция в аккумуляторе
Pb + PbO2 + H2SO4 ↔ 2PbSO4 + 2H2O.
Когда система работает как источник тока, реакция идет слева направо, на электродах образуется PbSO4. При пропускании тока в обратном направлении от внешнего источника система приводится в исходное состояние, аккумулятор заряжается.
Концентрационными называются цепи, в которых работа электрического тока получается в результате самопроизвольного выравнивания концентраций между двумя электролитами – растворами одного и того же вещества или двумя металлическими растворами – электродами, или в результате выравнивания давлений двух газовых электродов. В концентрационном элементе суммарный химический процесс отсутствует. В концентрационных цепях оба электрода идентичны как по физическому состоянию, так и по химической природе участников окислительно-восстановительных процессов. Они отличаются только концентрацией компонентов Ox или Red. Обычный концентрационный элемент состоит из одинаковых металлических или газовых электродов, опущенных в электролиты различной концентрации (активности), содержащие какую-либо соль металла, из которого изготовлены электроды. Процессы, протекающие в концентрационных электрохимических цепях, удобно рассмотреть на примере цепи, в состав которой входят два электролита с различной активностью ионов
M| MA|| MA| M.
a1 a2
Потенциалопределяющие реакции на обоих электродах одинаковы
M+z + zē ↔ M,
но вследствие различия в активностях ионов в растворах электродные потенциалы различны. Если а1 < а2, то согласно уравнению Нернста левый электрод будет иметь потенциал более отрицательный, чем правый. При отборе тока от концентрационной цепи на левом электроде идет растворение, а на правом – выделение металла. При этом изменяются активности ионов в растворах: а1 возрастает, а2 уменьшается. В соответствии с этим ЭДС цепи будет
|
|
(2.26) |
В рассмотренном примере отсутствует непосредственный контакт между растворами – растворы соединены через солевой мостик. Такие цепи называют концентрационными цепями без переноса ионов. Но если эти два раствора привести в соприкосновение, то на границе их раздела происходит перенос ионов из одного раствора в другой, что влияет на величину ЭДС. Такие системы называются концентрационными цепями с переносом ионов.
Примером может служить элемент (а' < a”):
|
→¦→ H+ –Pt, H2| HCl ¦ HCl| H2, Pt+ p1 a' ←¦←Cl¯ a” p1 ¦ |
При работе концентрационного элемента оба электрода в совокупности не испытывают термодинамического изменения, так как равные количества водорода переходят в раствор на левом электроде и выделяются из раствора на правом. Одновременно в левом электролите количество HCl растет, а в правом – уменьшается. Единственным результатом суммарного процесса является перенос растворенного вещества (HCl) из правого раствора в левый, т.е. из более концентрированного в более разбавленный. В соответствии с этим ЭДС цепи будет рассчитываться как
|
|
(2.27) |
где Δφдиф– диффузионный потенциал, который можно рассчитать по формуле
|
|
(2.28) |
где λ– молярная электрическая проводимость, См.м2/моль.

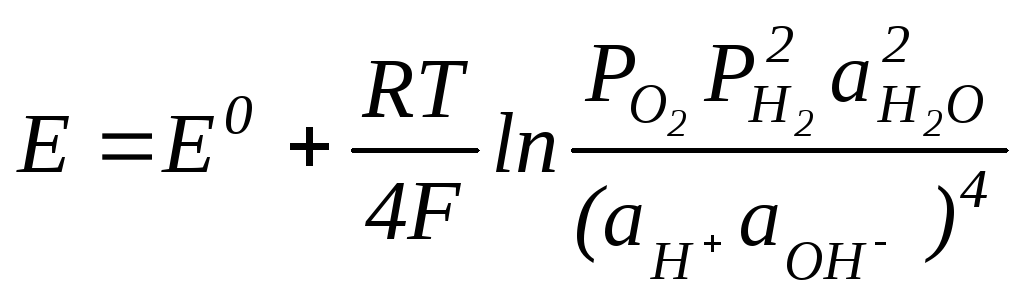 ,
,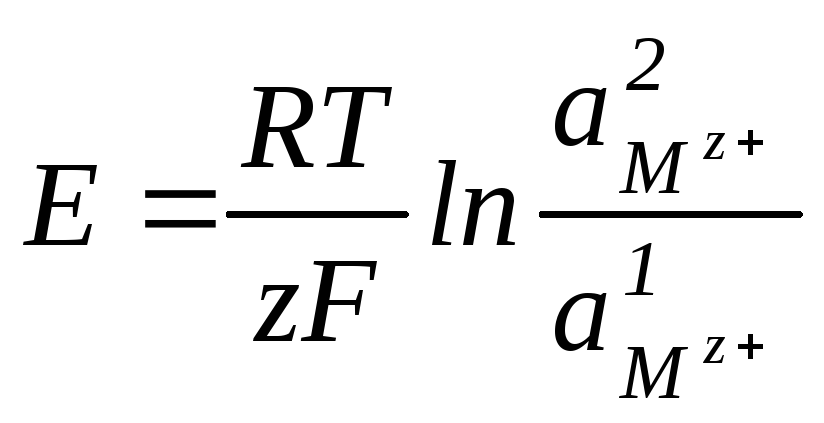 .
.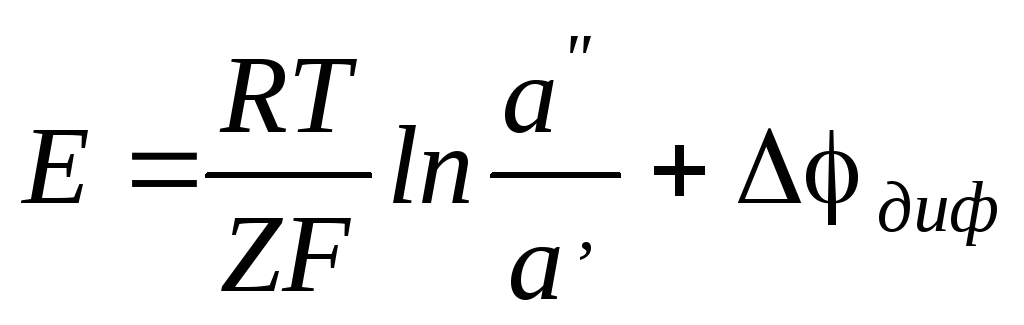 ,
,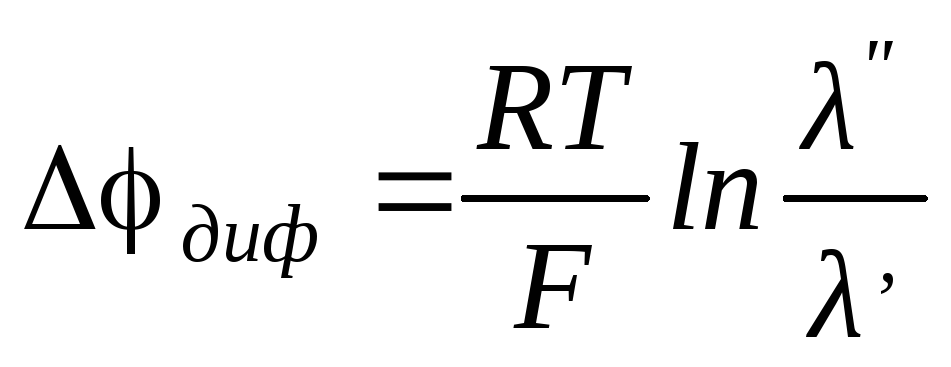 ,
,