
Гнозия экз 2
.pdf
Производные хинолина - хинин из хинной коры, эхинопсин из плодов мордовника.
Производные изохинолина - сальсолин из солянки Рихтера, морфин и папаверин из коробочекмака, алкалоиды чистотела, барбариса, мачка желтого.
Производные индола - алкалоиды спорыньи, барвинков, резерпин из корня раувольфии,стрихнин из семян чилибухи, катарантус розовый.

производные пурина - кофеин из листьев чая и семян колы.
Стероидные алкалоиды - соласонин паслена дольчатого, алкалоиды чемерицы и др.
Физико-химические свойства.
Большинство алкалоидов, содержащих кислород - бесцветные, оптически активные, кристаллические или аморфные вещества со щелочной реакцией; некоторые алкалоиды окрашены (например, алкалоид берберин из барбариса желтого цвета), без запаха, горького вкуса.
Бескислородные алкалоиды - летучие жидкости с неприятным запахом (например, алкалоидникотин из табака, кониин из болиголова).
Алкалоиды-основания, в воде почти нерастворимы; растворяются в спирте, эфире, хлороформе и других органических растворителях. Соли алкалоидов растворимы в воде и спирте, но нерастворимы в органических растворителях. Алкалоиды в растениях находятся в виде солей, связаны с органическими кислотами: щавелевой, лимонной, яблочной, винной. Для мака снотворного характерна меконовая кислота, а для хинной коры - хинная кислота.
24.Гликозиды, их строение, распространение в природе. Физико-химические свойства. Классификация.
Гликозиды - группа природных соединений, в молекуле которых сахарный остаток (гликон) соединен с несахарной частью (агликоном, или генином) через гетероатомы кислорода, азота,серы или углерода.
Классификация. Существует несколько классификаций гликозидов: по типу связи, по структуре сахарного компонента и по структуре агликона.
. 1По типу связи выделяют О-гликозиды, N-гликозиды, S-гликозиды и С- 21 гликозиды.
По структуре углеводного компонента. По количеству остатков моносахаридов выделяютмонозиды, или моногликозиды (один остаток сахара);
биозиды или дигликозиды (два остатка сахара)
триозиды, или тригликозиды (три остатка сахара) и олигозиды.
Гликозиды с двумя остатками моносахаридов, которые соединены между собой цепочкой, называют биозидами, а в дигликозиде два сахара присоединены к агликону в разных положениях.
По строению агликона. В зависимости от природы агликона гликозиды делятся на четырегруппы:
-алифатические гликозиды — гликозиды жирных кислот, жирных спиртов и глицерина; ---
алициклические гликозиды — карденолиды и буфадиенолиды, тритерпеновые и стероидные сапонины, моно-, ди- и сесквитерпеновые гликозиды, гликозиды иридоидов, гликоалкалоиды;
-ароматические гликозиды — антрагликозиды, фенологликозиды, гликозиды кумаринов, флавоноидов и ряд других;
-гетероциклические гликозиды — нуклеотиды, нуклеозиды и др.
Физико-химические свойства.
Гликозиды - бесцветные или окрашенные кристаллические вещества, некоторые флавоноиды и антраценопроизводные гликозиды, легко растворимые в воде, труднее в спирте, почти не растворимы в эфире, некоторые из них хорошо растворимы в хлороформе и дихлорэтане.
Агликоны в воде не растворяются, но растворимы в органических растворителях. Обладаютгорьким вкусом (за исключением рутина).
Распространение.
. Среди однодольных растений особенно богаты семейства ароидных, мятликовых. Наиболее часто гликозиды встречаются у двудольных в семействах лилейных, норичниковых, бобовых,лютиковых, кутровых, астровых, гречишных, розоцветных, крушиновых. Гликозиды могут находиться во всех органах растений
Роль гликозидов.
Гликозиды играют важную роль в жизнедеятельности растительного организма:
Участвуют в окислительно-восстановительных реакциях в растительной клетке;
Являются переносчиками сахара;
Многие группы химических веществ в период интенсивного роста и развития растениянаходятся в виде гликозидов;
В большинстве случаев биологическое значение гликозидов обеспечивается структуройагликона.
25.Кардиотонические гликозиды. Строение и классификация. Биологические и химические методы стандартизации лекарственного растительного сырья, содержащего кардиостероиды.
Сердечными гликозидами называется группа природных биологически активных веществ, оказывающих избирательное кардиотоническое действие на сердечную мышцу.Агликоном этих соединений являются производные циклопентанпергидрофенантрена, содержащие в 17-м положении ненасыщенное пятичленное или шестичленное лактонноекольцо.
Распространение.
Растения этой группы распространены широко. Они встречаются во флоре всех континентов мира в растениях, принадлежащих к семействам норичниковых (различныевиды наперстянок), лилейных (ландыш), разных видов капустных (желтушники), кутровых (олеандр, кендырь, строфант), лютиковых (адонисы, морозники) и др
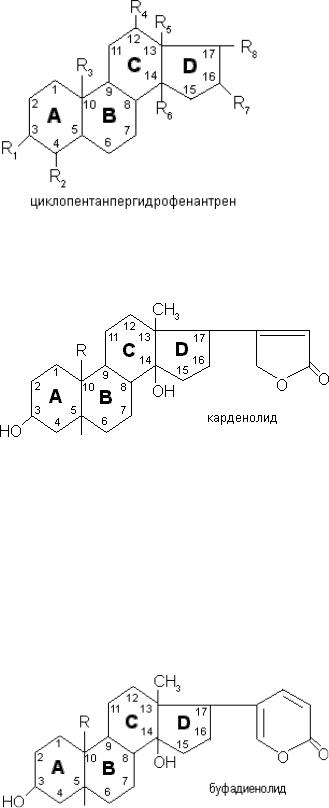
Классификация.
В зависимости от строения ненасыщенной: лактонного кольца все сердечные гликозиды делятся на две группы с пятичленным - карденолиды (гликозиды наперстянки, строфанта,ландыша, горицвета) и шестичленным - буфадиенолиды (гликозиды морозника) лактонным кольцом. В формуле карденолидов встречаются заместители: -СН3, -С-OH; в формуле буфадиенолидов заместителями могут быть -СН3, -С-OH, -СН2OН.

В зависимости от заместителя в положении C10 карденолиды подразделяются на триподгруппы.
Подгруппа наперстянки включает гликозиды, агликоны которых в положении С10 имеютметильную группу - СН3. Гликозиды этой подгруппы медленно всасываются и медленно выводятся из организма, обладают кумулятивным действием, например гликозид гитоксигенин.
Подгруппа строфанта - агликон имеет в положении 10 альдегидную группу -С-OH. Этигликозиды быстро всасываются, быстро выводятся из организма и не обладают кумулятивным действием, например строфантидин.
Подгруппа объединяет сердечные гликозиды, имеющие в положении 10 спиртовуюгруппу (-
OН2OН):

Физико-химические свойства.
Сердечные гликозиды чаще кристаллические вещества, бесцветные или кремоватые, беззапаха, горького вкуса; характеризуются определенной точкой плавления и углом вращения. Многие гликозиды обладают флюоресценцией в УФ-свете (ланатозиды наперстянки шерстистой). Сердечные гликозиды в основном мало растворимы в воде, хлороформе, но хорошо растворимы в водных растворах метанола и этанола. Агликонысердечных гликозидов лучше растворимы в органических растворителях
Способы получения.
Для выделения сердечных гликозидов используют этанол и метанол, которые не вызывают гидролиза сердечных гликозидов. Качественные реакции. Проводятся с индивидуальными веществами или очищенным извлечением из растительного сырья: на углеводную часть молекулы (реакция Келлер-Килиани); на стероидное ядро; на лактонноененасыщенное кольцо (реакция Балье) - с пикриновой кислотой в щелочной среде. В полевых условиях пользуются пикратной бумагой, в которую завертывают свежее растение и надавливают плоскогубцами; появление красного окрашивания на бумаге характеризует присутствие сердечных гликозидов.
Применение.
Гликозиды кардиотонического действия обладают избирательным действием насердечную мышцу.
Основные фармакодинамические эффекты.
Положительный инотропный эффект – усиливается систола; увеличивается ударныйи минутный объем кровообращения. На кардиограмме повышается зубец R, суживается комплекс QRS.
Отрицательный хронотропный эффект – замедление ЧСС, удлинение диастолы.
Отрицательный дромотропный эффект – снижение скорости проведения импульса впроводящей ткани сердца, особенно в артрико-вентрикулярном узле и в других отделах.
Положительный батмотропный эффект – увеличение возбудимости кардиомиоцитов, в результате увеличения чувствительности сердца к гуморальнымфакторам.

26. Биогенез, физико-химические свойства кардиостероидов. Основные фармакологические эффекты. Методы анализа. Применение кардиотонических гликозидов в медицине. Методы анализа.
Физико-химические свойства
Кардиотонические гликозиды в основном кристаллические вещества, бесцветные или кремоватые, без запаха, горького вкуса; характеризуются определенной точкой плавления и углом вращения плоскости поляризации. Обладают способностью флуоресцировать в УФ-свете оттенками желтого, зеленого и голубого цветов. Кардиотонические гликозиды растворяются в спиртах этиловом и метиловом, в воде, хлороформе и не растворяются в органических растворителях (петролейном и диэтиловом эфире). Агликоны кардиотонических гликозидов растворяются в органических растворителях. В зависимости от растворимости в воде и липидах, кардиотонические гликозиды делятся на две группы:
1.Гидрофильные (полярные) кардиотонические гликозиды.
2.Липофильные (неполярные) кардиотонические гликозиды. Гидрофильные кардиотонические гликозиды хорошо растворяются в воде, мало растворимы в липидах. Полярность этих соединений обусловлена наличием альдегидной (-СНО) группы в С10 положении агликона, а также присутствием дополнительных гидроксильных (-ОН) групп в структуре агликона. Гидрофильными свойствами обладают карденолиды подгруппы строфанта.
Липофильные кардиотонические гликозиды легко растворяются в липидах, плохо - в воде.
Липофильность этих кардиотонических гликозидов обусловлена наличием в С10 положении агликона метильной (-СН3) группы. Липофильными свойствами обладают карденолиды подгруппы наперстянки. Наличие ацетилированных моносахаридов в углеводной цепи (ацетилдигитоксоза) приводит к повышению гидрофильности гликозидов этой подгруппы. В организме кардиотонические гликозиды взаимодействуют с белками плазмы крови. Прочность связи прямо пропорциональна растворимости в липидах и обратно пропорциональна степени полярности сердечных гликозидов. Прочные связи затрудняют ресорбцию кардиотонических гликозидов из крови белками органов. В миокарде фиксируется до 10 % поступивших в организм кардиотонических гликозидов, что в 20 раз больше, чем в других органах. При этом действие сердечных гликозидов проявляется на каждое мышечное волокно миокарда. Химические свойства обусловлены особенностями строения кардиотонических гликозидов - наличием стероидного ядра, лактонного кольца, углеводной цепи и присутствием гликозидной связи. Самыми нестойкими в молекулах сердечных гликозидов являются лактонное кольцо и гликозидная связь. Лактонное кольцо легко изомеризуется под действием щелочей.
Благодаря наличию гликозидной связи кардиотонические гликозиды легко подвергаются ферментативному гидролизу в присутствии воды. Гидролитическое расщепление углеводной цепи происходит постепенно, что обусловливает ступенчатый распад сердечных гликозидов. При гидролизе монозидов (адонитоксин, конваллотоксин, эризимин) образуются соответствующие агликон и сахар. Кардиотонические гликозиды гидролизуются также кислотами и щелочами, а некоторые из них даже при кипячении с водой. При кислотном и щелочном гидролизе сразу происходит глубокое расщепление сердечных гликозидов до агликона и сахарных компонентов
Качественные реакции
Качественные реакции на кардиотонические гликозиды проводятся с индивидуальными веществами или очищенными спиртовыми извлечениями из растительного сырья. На кардиотонические гликозиды выделяют три группы химических реакций на различные части молекулы:
1. Реакции на стероидное ядро. Основаны на способности стероидного ядра кардиотонических гликозидов подвергаться дегидратации под действием кислотных реагентов (уксусный ангидрид, кислота серная концентрированная, кислота трихлоруксусная и др.) с образованием окрашенных комплексных соединений. Для кардиотонических гликозидов обычно проводят реакции:
Реакция Либермана–Бурхарда. При взаимодействии кардиотонических гликозидов со смесью уксусного ангидрида и кислоты серной концентрированной (50:1) появляется розовое окрашивание, переходящее в зеленое, а затем в синее.
Реакция Розенгейма. При взаимодействии кардиотонических гликозидов с 90 % водным раствором кислоты трихлоруксусной появляется розовое окрашивание, переходящее в лиловое, а затем в синее. Реакция с хлоридом сурьмы (III). Кардиотонические гликозиды при взаимодействии с раствором сурьмы треххлористой в среде уксусного ангидрида образуют лиловое окрашивание.
2. Реакции на ненасыщенное пятичленное лактонпое кольцо.Основаны на способности ненасыщенного лактонного кольца легко окисляться полинитросоединениями в щелочной среде с образованием окрашенных продуктов реакции. Для кардиотонических гликозидов обычно проводят реакции:
Реакция Балье. При взаимодействии с кислотой пикриновой в щелочной среде кардиотонические гликозиды образуют комплексы, окрашенные в оранжевый цвет.
Реакция Кедде. При взаимодействии с кислотой 3,5-динитробензойной кардиотонические гликозиды образуют комплексы, окрашенные в фиолетово-красный цвет.
Реакция Легаля. При взаимодействии c натрия нитропруссидом в щелочной среде кардиотонические гликозиды образуют комплексы, окрашенные в красный цвет. Реакция Раймонда. При взаимодействии с мета-динитробензолом кардиотонические гликозиды образуют комплексы, окрашенные в краснофиолетовый цвет.
3. Реакции на углеводную часть молекулы. Основаны на способности моносахаридов углеводной цепи образовывать окрашенные комплексы с различными реактивами. Моносахара, входящие в состав кардиотоническихгликозидов, после предварительного гидролиза вступают во все цветные реакции, свойственные углеводам (Фелинга, серебряного зеркала и др.). Для дезоксисахаров предложена реакция Келлера–Килиани.
Дезоксисахара в присутствии железа сульфата (III) с кислотой уксусной ледяной и кислотой серной концентрированной образуют комплексы, окрашенные в синий или сине-зеленый цвет. Необходимым условием для проведения этой реакции является отсутствие на конце углеводной цепи обычных сахаров (глюкозы). Достоверное заключение о присутствии в лекарственном растительном сырье кардиотонических гликозидов можно сделать только при положительном результате всех трех групп качественных реакций на различные части молекулы. Кроме того, кардиотонические гликозиды образуют нерастворимые комплексы с растворами дубильных веществ, что используется при отравлении препаратами сердечных гликозидов. Для идентификации буфадиенолидов обязательно снятие их УФ-спектров, где они имеют характерную полосу поглощения при 300 нм.
Количественное определение
Количественную оценку качества сырья, содержащего кардиотонические гликозиды, проводят методом биологической стандартизации. Метод основан на способности кардиотонических гликозидов вызывать в токсических дозах остановку сердца животных в стадию систолы. В качестве подопытных животных используют лягушек. Чувствительность животных к кардиотоническим гликозидам определяют в сравнении со стандартными образцами: индивидуальными веществами или очищенными экстрактами, которые вырабатывают в специальных научно-исследовательских институтах.
Активность лекарственного сырья и препаратов кардиотонических гликозидов выражают в единицах действия (ЕД): ЛЕД - «лягушачьи» ЕД. 1 ЛЕД соответствует наименьшей дозе стандартного препарата, вызывающей остановку сердца стандартной лягушки (самец травяной лягушки массой 28-33 г). Сырье и препараты видов наперстянок, ландыша и горицвета весеннего должны вызывать остановку сердца лягушки в течение 1 часа, a видов строфанта и желтушника седеющего - в течение 2 часов. В нормативной документации на лекарственное сырье, содержащее кардиотонические гликозиды, обязательно в разделе «Числовые показатели» указывается количество ЕД в 1 г сырья. Недостатками метода биологической стандартизации являются его трудоемкость, высокая стоимость, большая ошибка опыта (до 25 %). Поэтому нормативная документация на некоторые виды сырья (листья наперстянки шерстистой – Folia Digitalis lanatae) и препараты кардиотонических гликозидов требует определять их количественное содержание физикохимическими (хроматофотоэлектроколориметрическим или хроматоспектрофотометрическим) методами. Они основаны на предварительном хроматографическом разделении кардиотонических гликозидов с последующим фотоэлектроколориметрическим или спектрофотометрическим определением.
27.Сапонины, их классификация и физико-химические свойства. Лекарственные растения и сырье, содержащие сапонины. Их культивирование и нахождение в природе. Медицинское и промышленное использование сапонинов.
·Стероидные сапонины, химическое строение и свойства. Биосинтез стероидных сапонинов, их распространение в растениях и значение. Растения, содержащие стероидные сапонины: диоскорея ниппонская, якорцы стелющиеся.
·Тритерпеновые сапонины, их строение и свойства, биосинтез тритерпеновых сапонинов, их распространение в растениях и значение. Стандартизация ЛРС, содержащего тритерпеновые сапонины
Классификация
Сапонины по строению их агликона (сапогенина) делятся на две группы: стероидные и тритерпеновые. Стероидные сапонины.
Сапогенины этих сапонинов являются производными циклопентанпергидрофенантрена, как и агликоны кардиотонических гликозидов. Однако стероидные сапонины не оказывают кардиотонического действия, так как не имеют лактонного кольца при С17 и ряда других функциональных групп. Сапогенины всех стероидных сапонинов имеют:
уС3 кольца А – гидроксильную (-ОН) группу;
вположении 16-17 - спирокетальную группировку за счет окисления боковой цепи;
вположении 5-6 - двойную связь (-CH=CH-);

в положениях С10 и C13 - метильные (-СН3) группы.
Углеводная часть молекулы
стероидных сапонинов присоединяется в положении С3агликона и может содержать от 1 до 9 моносахаридов (глюкоза, галактоза, рамноза, галактуроновая кислота и др.). Моносахариды могут образовывать как линейные, так и разветвленные цепи. Например, стероидный сапонин диосцин (диоскорея ниппонская – Dioscorea nipponica, якорцы стелющиеся – Tribulus terrestris) состоит из агликона диосгенина, к которому присоединяется разветвленная триоза. Стероидные сапонины встречаются редко, преимущественно в растениях тропического климата. В семействах диоскорейных, норичниковых, спаржевых, амариллисовых стероидные сапонины часто встречаются совместно с кардиотоническими гликозидами (наперстянка, ландыш и др.).
Тритерпеновые сапонины имеют общую формулу (С5Н8)6 и, в зависимости от количества колец в структуре агликона, делятся на пентациклические и тетрациклические.
а) Тетрациклические - содержат в структуре агликона 4 кольца и подразделяются на производные даммарана (даммарандиол), циклоартана (циклоартенол), зуфана. Соединения подобного строения обнаружены в женьшене (Panax ginseng), заманихе высокой (Oplopanax elatus), березе (Betula spp.).
б) Пентациклические - содержат в структуре агликона 5 колец. Среди этой группы выделяют производные урсана (альфа-амирин), олеанана (бетаамирин), лупана (лупеол), гопана. С медицинской точки зрения, наиболее важными являются производные урсана и олеанана, которые отличаются друг от друга расположением заместителей – метильных (-СН3) групп в положениях 19
и20 кольца Е. Тритерпеновые сапонины могут быть нейтральными и кислыми. Кислотные свойства обусловлены наличием карбоксильных групп сапогенина и углеводной части молекулы. Гидроксильные группы могут быть ацилированы уксусной, тиглиновой, пропионовой, ангеликовой
идругими кислотами. Углеводная часть тритерпеновых сапонизидов может содержать от 1 до 11 моносахаридов (глюкоза, галактоза, рамноза, арабиноза, фруктоза, глюкуроновая и галактуроновая кислоты). Она может быть линейной и разветвленной (например, у аралозидов - сапонинов аралии высокой).
Способы получения.
Для выделения сапонинов из растительного сырья пользуются водой или разбавленнымиспиртами. Агликоны сапонинов хорошо растворяются в органических растворителях.
Растворимость в воде зависит от количества моносахаридов и увеличивается с ихвозрастанием.
