
- •6.9. Теории химической кинетики
- •6.9.1. Теория активных соударений
- •6.9.2. Теория активированного комплекса (переходного состояния или абсолютных скоростей реакций)
- •6.10. Кинетика реакций в растворах
- •6.10.1. Применение теории активированного комплекса к кинетике реакций в растворах
- •6.10.2. Влияние среды на скорость гомолитических реакций
- •6.10.3. Влияние среды на скорость гетеролитических реакций
6.10.1. Применение теории активированного комплекса к кинетике реакций в растворах
Для применения этой теории к жидкости необходимо учесть межмолекулярные взаимодействия исходных частиц и активированного комплекса с молекулами окружающей среды.
Рассмотрим уравнение переходного состояния:
![]() .
.
Раствор нельзя считать идеальным, так как имеется межмолекулярное взаимодействие, поэтому необходимо вместо KcввестиKa:
![]() ;
;
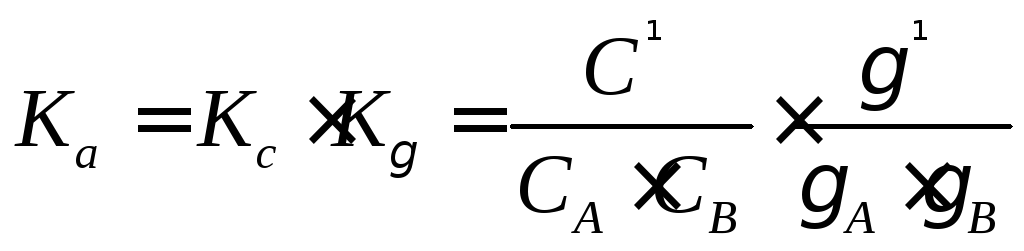 ,
,
 ,
,
![]() .
.
При = 1 система идеальная.
Если перейти к изобарному потенциалу, то
![]() ,
,
где
![]() – изобарный потенциал при активности,
равной единице.
– изобарный потенциал при активности,
равной единице.
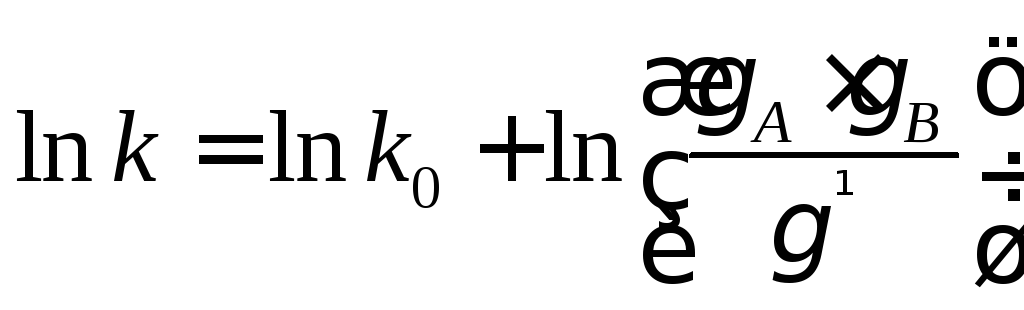 ,
,
k0– константа скорости в среде, для которой коэффициенты активности исходных частиц и активированного комплекса приняты равными единице.
Это соотношение называется уравнением Бренстеда-Бьеррума. Данное уравнение в принципе решает вопрос о влиянии среды на скорость элементарной химической реакции, сводя задачу к определению коэффициента активности исходных веществ и активированного комплекса. Однако в то время как существует ряд методов, позволяющих измерить коэффициент активности исходных веществ, величину не удается экспериментально измерить из независимых данных. Поэтому уравнение Бренстеда-Бьеррума имеет лишь теоретическое значение.
6.10.2. Влияние среды на скорость гомолитических реакций
В гомолитических реакциях образование активированного комплекса не сопряжено с существенным перераспределением электрических зарядов между реагирующими атомами. Поэтому оно не должно сопровождаться сильным изменением межмолекулярных взаимодействий. В связи с этим можно ожидать, что переход от газовой фазы к жидкой не должен сильно сказываться на величине константы скорости гомолитической реакции. Как правило, изменение kлежит в пределах одного порядка.
Наиболее заметно влияние среды в гомолитических процессах реализуется при наличии клеточного эффекта. В общем случае, явление клеточного эффекта состоит в том, что две частицы растворенного вещества, оказавшись вблизи друг друга, как бы попадают в клетку из молекул растворителя и не могут сразу разойтись на значительное расстояние. Пока частицы находятся в клетке, существует повышенная вероятность их столкновения, и, следовательно, взаимодействия между ними. Особенно это проявляется в том случае, если частицы образуются в одной клетке.
Наиболее яркий пример – реакции гомолитического распада:
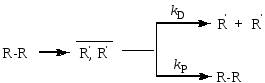
Вероятность выхода радикалов в объем (e)равна:
![]() ;
;
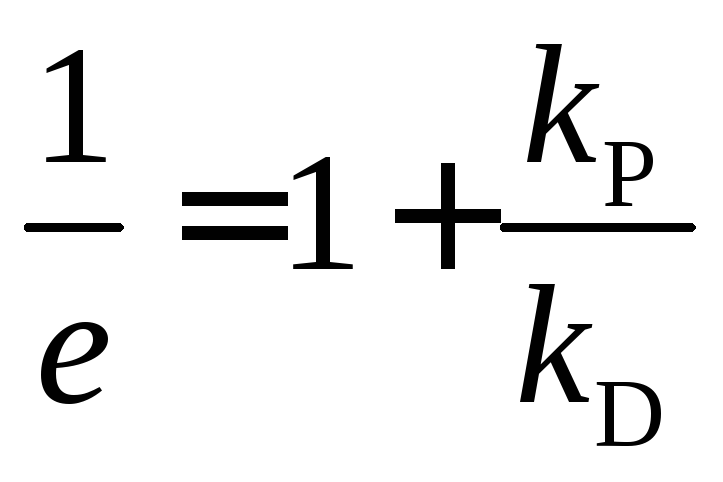 .
.
6.10.3. Влияние среды на скорость гетеролитических реакций
В разбавленных растворах зависимость коэффициента активности иона от ионной силы описывается уравнением Дебая-Гюккеля:
![]() ,
,
где zi– заряд иона.
Если реагируют zAиzB, тоz = zA + zB.
![]() ,
,
![]() ,
,
![]() ,
,
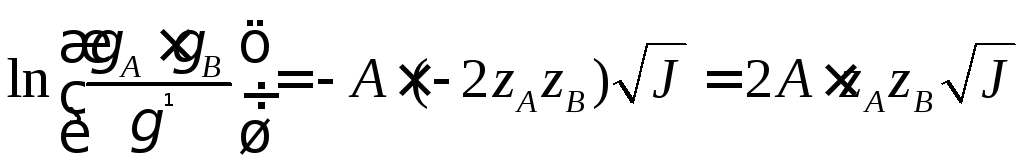 .
.
Это влияние ионной силы называют первичным солевым эффектом.
![]()
Уравнение Дебая-Гюккеля является приближением и верно лишь для разбавленных растворов. Изменение ионной силы приводит к изменению степени диссоциации слабого электролита.
![]() ,
,
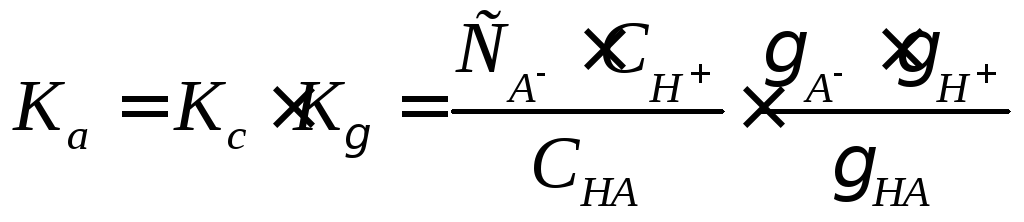 .
.
С ростом ионной силы величины AиHубывают, так какKпадает,Ka = Const. В результатеKcрастет и константа скорости реакции увеличивается. Это явление называютвторичным солевым эффектом
