
- •2. Особенности адсорбции на поверхности твердого адсорбента. Уравнение Фрейндлиха, его анализ и определение констант уравнения.
- •3. Что понимается под поверхностным слоем, поверхностной энергией и поверхностными явлениями. Какие параметры относятся к количественным характеристикам дисперсности? Дайте их полную характеристику.
- •4. Представьте, что Вам необходимо сделать доклад по теме: “Суспензия”. Напишите план доклада и в соответствии с ним составьте тезисы доклада.
- •5. Что понимается под поверхностным натяжением и как оно зависит от природы веществ, образующих поверхность раздела фаз?
- •6. Что такое капиллярное давление? Каковы причины его возникновения? Вывод и анализ уравнения Лапласа.
- •8. Поверхностное натяжение: причины возникновения, его физический смысл с термодинамической и силовой точек зрения, определение и методы измерения.
- •9. Что такое агрегативная устойчивость? Факторы, обеспечивающие агрегативную устойчивость лиофобных золей.
- •10. Характеристика порошков как дисперсных систем. Какие порошки обладают более высокой текучестью – грубодисперсные или высокодисперсные? Какие порошки легче распылять гидрофильные или гидрофобные?
- •11. Влияние температуры на термодинамические параметры поверхностного слоя – Us , qs , σ, Ss. (Вывод и анализ уравнения Гиббса-Гельмгольца для поверхностного слоя).
- •12. Адгезия и когезия. Какими силами они обусловлены? Что понимается под работой адгезии и когезии? Вывод уравнений, используемых для вычисления работы адгезии (Дюпре) и работы когезии.
- •13. Что такое аэрозоли? Приведите примеры аэрозолей бытовых, атмосферных и промышленных.
- •14. Рассмотрите процесс смачивания в зависимости от соотношения работы адгезии и когезии (вывод и анализ уравнения Юнга-Дюпре).
- •15. Теория кинетики быстрой коагуляции м. Смолуховского: основные положения; вывод и анализ уравнения, представляющего кинетику изменения общего числа частиц в процессе коагуляции? (Схож с 74)
- •16. Каковы условия поднятия жидкостей в капиллярах? Какова роль этого явления в природе и технике?
- •19. Рассмотрите возможные механизмы возникновения двойного электрического слоя (дэс) на границе раздела твердое тело – раствор.
- •21. В чем заключается инверсия смачивания? Какое практическое значение имеет это явление?
- •22. Какие величины используют для количественного описания адсорбции? Дайте определение этих величин и покажите, как их можно вычислить в общем виде.
- •23. Почему в случае смачивания капилляра жидкость в нем поднимается, а при несмачивании, наоборот, опускается?
- •25. Какие поверхностные явления сопровождают технологические процессы? Перечислите и дайте их краткую характеристику.
- •26. Теория мономолекулярной адсорбции Ленгмюра: основные положения теории, вывод уравнения изотермы адсорбции и ее анализ.
- •29. Смачивание: покажите взаимосвязь между адгезией и способностью жидкости смачивать твердую поверхность. В чем состоит различие между явлениями адгезии и смачивания?
- •30. Чем объяснить, что концентрация кислорода в воздухе земной атмосферы уменьшается в два раза при удалении от поверхности Земли на 5 км, а суспензии гуммигута на высоте 30 мкм?
- •31. По каким признакам классифицируют дисперсные системы? Привести их классификацию по всем классификационным признакам.
- •32. В чем заключается сущность ионообменной адсорбции? Какое состояние называется ионообменным равновесием? Какая величина его характеризует?
- •33. Что такое расклинивающее давление и каковы причины его возникновения? Назовите составляющие расклинивающего давления и охарактеризуйте их.
- •34. Адсорбция на границе раздела раствор – газ (воздух). Вывод и анализ уравнения адсорбции Гиббса для разбавленных растворов бинарной системы.
- •35. Зависимость термодинамической реакционной способности от дисперсности.
- •37. Кинетическая устойчивость. Связь между кинетической устойчивостью и гипсометрическим законом.
- •38. Как, используя уравнение Шишковского, можно определить константы уравнения Ленгмюра (к и а).
- •40. Свойства поверхностей жидких и твердых тел. Каковы особенности адсорбции пав из растворов на поверхности твердого тела?
- •41. Дайте сравнительную характеристику мономолекулярной и полимолекулярной адсорбции. Приведите основные типы изотерм для полимолекулярной адсорбции.
- •42. Дайте характеристику двойного электрического слоя на границе раздела фаз твердое тело – раствор. Как изменяется потенциал в этом слое с расстоянием от поверхности твердой фазы?
- •43. Что понимается под термином “разрушение дисперсной системы”, какая устойчивость при этом теряется? Правила электролитной коагуляции лиофобных золей.
- •44. Капиллярные явления. Поднятия и опускания жидкости в капиллярах: уравнение Жюрена, его вывод и анализ.
- •46. Поверхностная энергия и равновесная форма тела: правило Гиббса-Кюри для твердых и жидких тел.
- •47. Электрокинетические явления 1-го рода, история их открытия и практическое приложение. Как по скорости электрофореза и электроосмоса можно вычислить электрокинетический потенциал?
- •48. Как объяснить зависимость, установленную правилом Дюкло-Траубе?
- •50. Дайте полную характеристику дисперсной системы. Классификационная характеристика этих систем по агрегатному состоянию дисперсной фазы и дисперсионной среды, по виду дисперсной фазы.
- •51. Представьте, что Вам необходимо сделать доклад по теме “Эмульсии”. Напишите план доклада и составьте к нему тезисы.
- •55. Каковы возможные механизмы образования на поверхности раздела фаз двойного электрического слоя.
- •57. Составьте задачу, для решения которой нужно использовать правило Панета-Фаянса.
- •58. Чем обусловлено светорассеяние в дисперсных системах и истинных растворах? Какими параметрами характеризуют рассеяние света в системе?
- •59. Электрокинетические явления 2-го рода: история их открытия, характеристика и практическое приложение.
- •61. Какова взаимосвязь давления насыщенного пара с кривизной поверхности: вывод и анализ уравнения Томсона-Кельвина.
- •63. Каков физический смысл термина “поверхностная активность”? к каким веществам применяется этот термин? Дайте их характеристику и приведите полную классификацию по всем классификационным признакам.
- •64. Дайте характеристику коллоидных растворов (золей) по всем классификационным признакам. Чем они отличаются от суспензий. Приведите примеры таких систем.
- •65. Что представляет собой релаксационный эффект, электрофоретическое торможение и поверхностная проводимость? Как их нужно учитывать при определении величины -потенциала?
- •70. Какая связь существует между уравнениями Гиббса и Ленгмюра? Напишите уравнение, выражающее эту взаимосвязь, и поясните физико-химический смысл входящих в него величин.
- •72. Что представляют собой потенциальные кривые взаимодействия между коллоидными частицами? Как на их основе объясняют явление коагуляции?
- •75. Что понимается под работой адсорбции? Как, используя это понятие, можно объяснить связь поверхностной активности пав с длиной углеводородного радикала в молекуле пав (правило Дюкло-Траубе).
4. Представьте, что Вам необходимо сделать доклад по теме: “Суспензия”. Напишите план доклада и в соответствии с ним составьте тезисы доклада.
Суспензия является представителем дисперсной системы. Под дисперсной системой понимается гетерофазная система, в которой 1 вещество раздроблено в другом. Совокупность раздробленных частиц получила название дисперсной фазы, а среда, в которой распределены эти частицы – дисперсионной средой. Система может существовать только при отсутствии взаимной растворимости образующих её веществ.
Существует много классификаций дисперсных систем по тем или иным признакам. Один из признаков классификации по агрегатному состоянию дисперсной фазы и дисперсионной среды
Суспензия это система типа т/ж, они относятся к лиозолям.
По природной устойчивости:
Лиофобная — частицы дисперсной фазы не взаимодействуют с дисперсионной средой.
По виду дисперсной фазы: трехмерная (напишите пожалуйста, у меня нет лекций с собой)
Микрогетерогенная (от 10^-7 до 10^-5), свободнодисперсная (В таких системах частицы дисперсной фазы могут свободно перемещаться по всему объему), полидисперсная (частицы дисперсной фазы имеют разный размер).
Это надо как-то выучить и красиво ей рассказать
Размеры частиц дисперсной фазы: грубодисперсные
Молекулярно-кинетические свойства: проявляются слабо
Кинетической устойчивостью не обладают
Электрокинетические явления проявляются частично
Суспензии не рассеивают свет
Адсорбция и образование ДЭС возможно
Связнодисперсные системы: пасты
5. Что понимается под поверхностным натяжением и как оно зависит от природы веществ, образующих поверхность раздела фаз?
Поверхностное натяжение - наиболее важное свойство поверхностного слоя, представляющее собой основную т/д характеристику поверхности раздела между фазами, образующимися между в системах типа тв.т-ж, ж-ж, ж-газ. (оно обусловлено нескомпенсированностью межмолекулярных сил у границы раздела фаз, вследствие чего свободная энергия в поверхностном слое больше, чем в объемах соприкасающихся фаз. Оно является мерой нескомпенсированности.)
Поверхностное натяжение зависит от природы, т.е. от сил притяжения между молекулами. Чем сильнее межмолекулярные связи, тем больше поверхностное натяжение. Поверхностное натяжение меньше у неполярных жидкостей, имеющих слабые межмолекулярные связи, и больше у полярных жидкостей. Большим поверхностным натяжением обладают вещества с водородными связями. У твердых веществ больше поверхностное натяжение из-за большей силы межмолекулярного взаимодействия.
6. Что такое капиллярное давление? Каковы причины его возникновения? Вывод и анализ уравнения Лапласа.
Важным свойством дисперсной системы, связанным с раздробленностью, является увеличение кривизны поверхности по сравнению с плоскостью. Кривизна поверхности жидкости является следствием явления смачивания и обусловлена поверхностным натяжением на границе раздела фаз ж-пар,газ или ж-ж. При изменении кривизны под действием поверхностного натяжения может изменяться внутреннее давление в телах.
Капиллярное
давление ( разность внутренних давлений по обе
стороны искривленной поверхности
раздела фаз ж-пар,газ или ж-ж.
разность внутренних давлений по обе
стороны искривленной поверхности
раздела фаз ж-пар,газ или ж-ж.
Влияние кривизны поверхности на изменение внутреннего давления выражено в уравнении Лапласа
Вывод уравнения Лапласа
Рассмотрим результат влияния кривизны поверхности раздела фаз на их внутреннее давление. Для этого рассмотрим закрытую систему, состоящую из двух фаз и находящуюся при t=const.
 Кривизна
поверхности пузырька отрицательная.
Она будет положительной в том случае,
если центр радиуса кривизны будет
находиться в жидкости.
Кривизна
поверхности пузырька отрицательная.
Она будет положительной в том случае,
если центр радиуса кривизны будет
находиться в жидкости.

Кривизна
поверхности возникает в результате
того, что под действием поверхностного
натяжения площадь поверхности пузырька
изменяется на некоторую величину dS, что
приводит к изменению поверхностного
натяжения

Изменение
поверхности газовой фазы приводит к
изменению объемов контактирующих фаз
на некоторую величину dV. Объем газовой
фазы на эту величину уменьшается, а
жидкости-увеличивается.
 . Все это приводит к изменению внутренней
энергии в фазах, соответственно знак
величин
. Все это приводит к изменению внутренней
энергии в фазах, соответственно знак
величин
 и
и
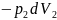 .
Изменение энергии Гельмгольца всей
системы будет равно:
.
Изменение энергии Гельмгольца всей
системы будет равно:


,

В случае, если искривленная поверхность имеет неправильную форму, то
 уравнение
Юнга-Лапласа
уравнение
Юнга-Лапласа
где r1 и r2 - главные радиусы кривизны поверхности
Анализ уравнения Лапласа
Кривизна
поверхности отрицательная,
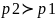 ,
,
 т.е.
давление фаз ж-г увеличивается на
величину
т.е.
давление фаз ж-г увеличивается на
величину
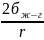 ,
значит жидкость будет испытывать при
отрицательной кривизне поверхности
со стороны поверхностного слоя меньшее
давление, чем при плоской поверхности
на величину
.
Pпл - Pисх =
,
значит жидкость будет испытывать при
отрицательной кривизне поверхности
со стороны поверхностного слоя меньшее
давление, чем при плоской поверхности
на величину
.
Pпл - Pисх =
Кривизна
поверхности положительная,
 ,
,
 т.е.
давление в жидкой фазе по отношению к
газовой фазе при наличии кривизны
поверхности раздела фаз будет увеличиваться
на величину
,
значит при положительной кривизне
поверхности жидкость будет испытывать
большее давление со стороны поверхностного
слоя по сравнению с давлением при плоской
поверхности. Pисх - Pпл =
т.е.
давление в жидкой фазе по отношению к
газовой фазе при наличии кривизны
поверхности раздела фаз будет увеличиваться
на величину
,
значит при положительной кривизне
поверхности жидкость будет испытывать
большее давление со стороны поверхностного
слоя по сравнению с давлением при плоской
поверхности. Pисх - Pпл =
Поверхность
границы раздела фаз плоская,
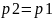 ,
,
 .
Таким образом капиллярное давление
следует рассматривать как добавку,
которая в зависимости от значения
кривизны поверхности увеличивает или
уменьшает внутримолекулярное давление
по уравнению с молекулярным давлением
при наличии плоской поверхности.
.
Таким образом капиллярное давление
следует рассматривать как добавку,
которая в зависимости от значения
кривизны поверхности увеличивает или
уменьшает внутримолекулярное давление
по уравнению с молекулярным давлением
при наличии плоской поверхности.
Капиллярное давление всегда направлено к участку кривизны. Примером проявления капиллярного давления является движение жидкостей в капиллярах.
7. Как классифицируют суспензии по размеру частиц? Какие из перечисленных суспензий: крахмал в воде; взвесь Ca(OH)2, приготовленная для побелки стен и потолков; глина в воде и речной песок в воде относятся к грубым, тонким или мутям?
Суспензии -- это дисперсные системы, в которых дисперсной фазой являются частицы твердого вещества размером более 10-7 м, а дисперсионной средой -- жидкость.
Условно суспензии обозначают в виде дроби: Т/Ж, в числителе которой указывается агрегатное состояние фазы, а в знаменателе - агрегатное состояние среды.
Грубые 10^2 мкм (речной песок, взвесь Са(ОН)2)
Тонкие от 10^2 до 0,5 мкм (глина в воде-у глины размер частиц обычно примерно 4 мкм, крахмал в воде-размер частиц крахмала обычно от 10 до 50 мкм)
Мути от 0,5 мкм до 100 нм ()
