
- •2. Особенности адсорбции на поверхности твердого адсорбента. Уравнение Фрейндлиха, его анализ и определение констант уравнения.
- •3. Что понимается под поверхностным слоем, поверхностной энергией и поверхностными явлениями. Какие параметры относятся к количественным характеристикам дисперсности? Дайте их полную характеристику.
- •4. Представьте, что Вам необходимо сделать доклад по теме: “Суспензия”. Напишите план доклада и в соответствии с ним составьте тезисы доклада.
- •5. Что понимается под поверхностным натяжением и как оно зависит от природы веществ, образующих поверхность раздела фаз?
- •6. Что такое капиллярное давление? Каковы причины его возникновения? Вывод и анализ уравнения Лапласа.
- •8. Поверхностное натяжение: причины возникновения, его физический смысл с термодинамической и силовой точек зрения, определение и методы измерения.
- •9. Что такое агрегативная устойчивость? Факторы, обеспечивающие агрегативную устойчивость лиофобных золей.
- •10. Характеристика порошков как дисперсных систем. Какие порошки обладают более высокой текучестью – грубодисперсные или высокодисперсные? Какие порошки легче распылять гидрофильные или гидрофобные?
- •11. Влияние температуры на термодинамические параметры поверхностного слоя – Us , qs , σ, Ss. (Вывод и анализ уравнения Гиббса-Гельмгольца для поверхностного слоя).
- •12. Адгезия и когезия. Какими силами они обусловлены? Что понимается под работой адгезии и когезии? Вывод уравнений, используемых для вычисления работы адгезии (Дюпре) и работы когезии.
- •13. Что такое аэрозоли? Приведите примеры аэрозолей бытовых, атмосферных и промышленных.
- •14. Рассмотрите процесс смачивания в зависимости от соотношения работы адгезии и когезии (вывод и анализ уравнения Юнга-Дюпре).
- •15. Теория кинетики быстрой коагуляции м. Смолуховского: основные положения; вывод и анализ уравнения, представляющего кинетику изменения общего числа частиц в процессе коагуляции? (Схож с 74)
- •16. Каковы условия поднятия жидкостей в капиллярах? Какова роль этого явления в природе и технике?
- •19. Рассмотрите возможные механизмы возникновения двойного электрического слоя (дэс) на границе раздела твердое тело – раствор.
- •21. В чем заключается инверсия смачивания? Какое практическое значение имеет это явление?
- •22. Какие величины используют для количественного описания адсорбции? Дайте определение этих величин и покажите, как их можно вычислить в общем виде.
- •23. Почему в случае смачивания капилляра жидкость в нем поднимается, а при несмачивании, наоборот, опускается?
- •25. Какие поверхностные явления сопровождают технологические процессы? Перечислите и дайте их краткую характеристику.
- •26. Теория мономолекулярной адсорбции Ленгмюра: основные положения теории, вывод уравнения изотермы адсорбции и ее анализ.
- •29. Смачивание: покажите взаимосвязь между адгезией и способностью жидкости смачивать твердую поверхность. В чем состоит различие между явлениями адгезии и смачивания?
- •30. Чем объяснить, что концентрация кислорода в воздухе земной атмосферы уменьшается в два раза при удалении от поверхности Земли на 5 км, а суспензии гуммигута на высоте 30 мкм?
- •31. По каким признакам классифицируют дисперсные системы? Привести их классификацию по всем классификационным признакам.
- •32. В чем заключается сущность ионообменной адсорбции? Какое состояние называется ионообменным равновесием? Какая величина его характеризует?
- •33. Что такое расклинивающее давление и каковы причины его возникновения? Назовите составляющие расклинивающего давления и охарактеризуйте их.
- •34. Адсорбция на границе раздела раствор – газ (воздух). Вывод и анализ уравнения адсорбции Гиббса для разбавленных растворов бинарной системы.
- •35. Зависимость термодинамической реакционной способности от дисперсности.
- •37. Кинетическая устойчивость. Связь между кинетической устойчивостью и гипсометрическим законом.
- •38. Как, используя уравнение Шишковского, можно определить константы уравнения Ленгмюра (к и а).
- •40. Свойства поверхностей жидких и твердых тел. Каковы особенности адсорбции пав из растворов на поверхности твердого тела?
- •41. Дайте сравнительную характеристику мономолекулярной и полимолекулярной адсорбции. Приведите основные типы изотерм для полимолекулярной адсорбции.
- •42. Дайте характеристику двойного электрического слоя на границе раздела фаз твердое тело – раствор. Как изменяется потенциал в этом слое с расстоянием от поверхности твердой фазы?
- •43. Что понимается под термином “разрушение дисперсной системы”, какая устойчивость при этом теряется? Правила электролитной коагуляции лиофобных золей.
- •44. Капиллярные явления. Поднятия и опускания жидкости в капиллярах: уравнение Жюрена, его вывод и анализ.
- •46. Поверхностная энергия и равновесная форма тела: правило Гиббса-Кюри для твердых и жидких тел.
- •47. Электрокинетические явления 1-го рода, история их открытия и практическое приложение. Как по скорости электрофореза и электроосмоса можно вычислить электрокинетический потенциал?
- •48. Как объяснить зависимость, установленную правилом Дюкло-Траубе?
- •50. Дайте полную характеристику дисперсной системы. Классификационная характеристика этих систем по агрегатному состоянию дисперсной фазы и дисперсионной среды, по виду дисперсной фазы.
- •51. Представьте, что Вам необходимо сделать доклад по теме “Эмульсии”. Напишите план доклада и составьте к нему тезисы.
- •55. Каковы возможные механизмы образования на поверхности раздела фаз двойного электрического слоя.
- •57. Составьте задачу, для решения которой нужно использовать правило Панета-Фаянса.
- •58. Чем обусловлено светорассеяние в дисперсных системах и истинных растворах? Какими параметрами характеризуют рассеяние света в системе?
- •59. Электрокинетические явления 2-го рода: история их открытия, характеристика и практическое приложение.
- •61. Какова взаимосвязь давления насыщенного пара с кривизной поверхности: вывод и анализ уравнения Томсона-Кельвина.
- •63. Каков физический смысл термина “поверхностная активность”? к каким веществам применяется этот термин? Дайте их характеристику и приведите полную классификацию по всем классификационным признакам.
- •64. Дайте характеристику коллоидных растворов (золей) по всем классификационным признакам. Чем они отличаются от суспензий. Приведите примеры таких систем.
- •65. Что представляет собой релаксационный эффект, электрофоретическое торможение и поверхностная проводимость? Как их нужно учитывать при определении величины -потенциала?
- •70. Какая связь существует между уравнениями Гиббса и Ленгмюра? Напишите уравнение, выражающее эту взаимосвязь, и поясните физико-химический смысл входящих в него величин.
- •72. Что представляют собой потенциальные кривые взаимодействия между коллоидными частицами? Как на их основе объясняют явление коагуляции?
- •75. Что понимается под работой адсорбции? Как, используя это понятие, можно объяснить связь поверхностной активности пав с длиной углеводородного радикала в молекуле пав (правило Дюкло-Траубе).
70. Какая связь существует между уравнениями Гиббса и Ленгмюра? Напишите уравнение, выражающее эту взаимосвязь, и поясните физико-химический смысл входящих в него величин.
Уравнение
Гиббса:
 ,
где
,
где
 – поверхностное натяжение раствора,
H/м, Дж/м2;
– поверхностное натяжение раствора,
H/м, Дж/м2;
 – гиббсовская (избыточная) адсорбция,
моль/м2;
– гиббсовская (избыточная) адсорбция,
моль/м2;
 – химический потенциал компонента в
растворе.
– химический потенциал компонента в
растворе.
Уравнение
Гиббса для разбавленных двухкомпонентных
растворов:
 ,
где
,
где
 – равновесная концентрация растворенного
вещества в объеме раствора;
– равновесная концентрация растворенного
вещества в объеме раствора;
 – температура, при которой происходит
адсорбция;
– температура, при которой происходит
адсорбция;
 – универсальная газовая постоянная;
– универсальная газовая постоянная;
 – изменение поверхностного натяжения
раствора при изменении концентрации.
– изменение поверхностного натяжения
раствора при изменении концентрации.
Наиболее
распространенным выражением изотермы
адсорбции Ленгмюра являются уравнения:
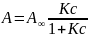 и
и
 ,
где
,
где
 и
и
 – концентрация и давление адсорбата
соответственно;
– концентрация и давление адсорбата
соответственно;
 – константа адсорбционного равновесия,
выраженная через отношение констант
скоростей процессов адсорбции и десорбции
(она характеризует сродство адсорбата
к адсорбенту, т.е. их энергию взаимодействия.
Чем сильнее это взаимодействие, тем
больше константа адсорбционного
равновесия. Константа
увеличивается в 3 – 3,5 раза при удлинении
цепи на одно звено -CH2).
– константа адсорбционного равновесия,
выраженная через отношение констант
скоростей процессов адсорбции и десорбции
(она характеризует сродство адсорбата
к адсорбенту, т.е. их энергию взаимодействия.
Чем сильнее это взаимодействие, тем
больше константа адсорбционного
равновесия. Константа
увеличивается в 3 – 3,5 раза при удлинении
цепи на одно звено -CH2).
 – предельная адсорбция или емкость
монослоя, т.е. количество адсорбированного
вещества, покрывающее поверхность
адсорбента плотным монослоем.
– предельная адсорбция или емкость
монослоя, т.е. количество адсорбированного
вещества, покрывающее поверхность
адсорбента плотным монослоем.
Совместное
решение уравнения Гиббса (
)
с уравнением Ленгмюра (
)
для ПАВ дает уравнение Шишковского,
связывающее изменение поверхностного
натяжения раствора с концентрацией
растворенного ПАВ в объеме:
 ,
где
,
где
 – поверхностное натяжение растворителя
(воды).
– поверхностное натяжение растворителя
(воды).
71. Адсорбция: определение и термодинамическая интерпретация ее возникновения, количественные способы ее характеристики, физическая и химическая адсорбция. Виды зависимости адсорбции. Основные изотермы адсорбции и область их применения.
Адсорбция- самопроизвольное изменение концентрации компонента в поверхностном слое по сравнению с объёмной фазой, отнесенное к единице площади поверхности или единице массы адсорбента.
Количественные характеристики адсорбции: -избыточная или гиббсовская адсорбция Гi [моль/м^2]- избыток i-го компонента в поверхностном слое по сравнению с объемной фазой, приходящийся на единицу площади поверхности. -абсолютная адсорбция Аi [моль/м^2, моль/кг]- количество вещества i-го компонента в поверхностном слое, отнесенное к площади поверхности или массе адсорбента. -удельная адсорбция аi [моль/кг, кг/кг]- количество или масса i-го компонента, отнесенная к массе адсорбента. При физической адсорбции между молекулами адсорбата и адсорбента действуют в основном межмолекулярные (ван-дер-ваальсовые) силы, имеющие дисперсионный, ориентационный или индукционный характер. Особенностью является то, что эти силы действуют между молекулами или атомами, находящимися в разных фазах. Физическая адсорбция обратима. Состояние системы, когда скорости адсорбции и десорбции равны, называют адсорбционным равновесием. Хемосорбцию можно рассматривать как двумерную химическую реакцию, протекающую в поверхностном слое. Особенности хемосорбции: - необратимость процесса; - специфичность и избирательность взаимодействия; - изменение структуры не только адсорбата, но и адсорбента. Изотерма Ленгмюра
1 участок - характерен для низких концентраций или давлений адсорбата.
![]()
3
участок - область больших концентраций.
![]()
2
участок описывается полным уравнением
Ленгмюра
![]() Используется
для описания мономолекулярной химической
и физической адсорбции на границе
раздела тв. тело- газ, тв. тело-
раствор.
Изотерма Генри
Используется
для описания мономолекулярной химической
и физической адсорбции на границе
раздела тв. тело- газ, тв. тело-
раствор.
Изотерма Генри

![]()
kг
зависит от температуры и характеризует
взаимодействие адсорбат-адсорбент.
Применяется в физической адсорбции
газа или растворенного вещества на
однородной поверхности адсорбента при
низкой концентрации растворенного
вещества.
Изотерма Фрейндлиха
![]()

3 участок 1/n=0
Хемосорбция и физич. адсорбция на неоднородной твердой поверхности газа или растворенного вещества.
Изотерма
полимолекулярной адсорбции БЭТ


При изучении адсорбции газов и паров на твердых адсорбентах при Т<Ткр
