
- •2. Особенности адсорбции на поверхности твердого адсорбента. Уравнение Фрейндлиха, его анализ и определение констант уравнения.
- •3. Что понимается под поверхностным слоем, поверхностной энергией и поверхностными явлениями. Какие параметры относятся к количественным характеристикам дисперсности? Дайте их полную характеристику.
- •4. Представьте, что Вам необходимо сделать доклад по теме: “Суспензия”. Напишите план доклада и в соответствии с ним составьте тезисы доклада.
- •5. Что понимается под поверхностным натяжением и как оно зависит от природы веществ, образующих поверхность раздела фаз?
- •6. Что такое капиллярное давление? Каковы причины его возникновения? Вывод и анализ уравнения Лапласа.
- •8. Поверхностное натяжение: причины возникновения, его физический смысл с термодинамической и силовой точек зрения, определение и методы измерения.
- •9. Что такое агрегативная устойчивость? Факторы, обеспечивающие агрегативную устойчивость лиофобных золей.
- •10. Характеристика порошков как дисперсных систем. Какие порошки обладают более высокой текучестью – грубодисперсные или высокодисперсные? Какие порошки легче распылять гидрофильные или гидрофобные?
- •11. Влияние температуры на термодинамические параметры поверхностного слоя – Us , qs , σ, Ss. (Вывод и анализ уравнения Гиббса-Гельмгольца для поверхностного слоя).
- •12. Адгезия и когезия. Какими силами они обусловлены? Что понимается под работой адгезии и когезии? Вывод уравнений, используемых для вычисления работы адгезии (Дюпре) и работы когезии.
- •13. Что такое аэрозоли? Приведите примеры аэрозолей бытовых, атмосферных и промышленных.
- •14. Рассмотрите процесс смачивания в зависимости от соотношения работы адгезии и когезии (вывод и анализ уравнения Юнга-Дюпре).
- •15. Теория кинетики быстрой коагуляции м. Смолуховского: основные положения; вывод и анализ уравнения, представляющего кинетику изменения общего числа частиц в процессе коагуляции? (Схож с 74)
- •16. Каковы условия поднятия жидкостей в капиллярах? Какова роль этого явления в природе и технике?
- •19. Рассмотрите возможные механизмы возникновения двойного электрического слоя (дэс) на границе раздела твердое тело – раствор.
- •21. В чем заключается инверсия смачивания? Какое практическое значение имеет это явление?
- •22. Какие величины используют для количественного описания адсорбции? Дайте определение этих величин и покажите, как их можно вычислить в общем виде.
- •23. Почему в случае смачивания капилляра жидкость в нем поднимается, а при несмачивании, наоборот, опускается?
- •25. Какие поверхностные явления сопровождают технологические процессы? Перечислите и дайте их краткую характеристику.
- •26. Теория мономолекулярной адсорбции Ленгмюра: основные положения теории, вывод уравнения изотермы адсорбции и ее анализ.
- •29. Смачивание: покажите взаимосвязь между адгезией и способностью жидкости смачивать твердую поверхность. В чем состоит различие между явлениями адгезии и смачивания?
- •30. Чем объяснить, что концентрация кислорода в воздухе земной атмосферы уменьшается в два раза при удалении от поверхности Земли на 5 км, а суспензии гуммигута на высоте 30 мкм?
- •31. По каким признакам классифицируют дисперсные системы? Привести их классификацию по всем классификационным признакам.
- •32. В чем заключается сущность ионообменной адсорбции? Какое состояние называется ионообменным равновесием? Какая величина его характеризует?
- •33. Что такое расклинивающее давление и каковы причины его возникновения? Назовите составляющие расклинивающего давления и охарактеризуйте их.
- •34. Адсорбция на границе раздела раствор – газ (воздух). Вывод и анализ уравнения адсорбции Гиббса для разбавленных растворов бинарной системы.
- •35. Зависимость термодинамической реакционной способности от дисперсности.
- •37. Кинетическая устойчивость. Связь между кинетической устойчивостью и гипсометрическим законом.
- •38. Как, используя уравнение Шишковского, можно определить константы уравнения Ленгмюра (к и а).
- •40. Свойства поверхностей жидких и твердых тел. Каковы особенности адсорбции пав из растворов на поверхности твердого тела?
- •41. Дайте сравнительную характеристику мономолекулярной и полимолекулярной адсорбции. Приведите основные типы изотерм для полимолекулярной адсорбции.
- •42. Дайте характеристику двойного электрического слоя на границе раздела фаз твердое тело – раствор. Как изменяется потенциал в этом слое с расстоянием от поверхности твердой фазы?
- •43. Что понимается под термином “разрушение дисперсной системы”, какая устойчивость при этом теряется? Правила электролитной коагуляции лиофобных золей.
- •44. Капиллярные явления. Поднятия и опускания жидкости в капиллярах: уравнение Жюрена, его вывод и анализ.
- •46. Поверхностная энергия и равновесная форма тела: правило Гиббса-Кюри для твердых и жидких тел.
- •47. Электрокинетические явления 1-го рода, история их открытия и практическое приложение. Как по скорости электрофореза и электроосмоса можно вычислить электрокинетический потенциал?
- •48. Как объяснить зависимость, установленную правилом Дюкло-Траубе?
- •50. Дайте полную характеристику дисперсной системы. Классификационная характеристика этих систем по агрегатному состоянию дисперсной фазы и дисперсионной среды, по виду дисперсной фазы.
- •51. Представьте, что Вам необходимо сделать доклад по теме “Эмульсии”. Напишите план доклада и составьте к нему тезисы.
- •55. Каковы возможные механизмы образования на поверхности раздела фаз двойного электрического слоя.
- •57. Составьте задачу, для решения которой нужно использовать правило Панета-Фаянса.
- •58. Чем обусловлено светорассеяние в дисперсных системах и истинных растворах? Какими параметрами характеризуют рассеяние света в системе?
- •59. Электрокинетические явления 2-го рода: история их открытия, характеристика и практическое приложение.
- •61. Какова взаимосвязь давления насыщенного пара с кривизной поверхности: вывод и анализ уравнения Томсона-Кельвина.
- •63. Каков физический смысл термина “поверхностная активность”? к каким веществам применяется этот термин? Дайте их характеристику и приведите полную классификацию по всем классификационным признакам.
- •64. Дайте характеристику коллоидных растворов (золей) по всем классификационным признакам. Чем они отличаются от суспензий. Приведите примеры таких систем.
- •65. Что представляет собой релаксационный эффект, электрофоретическое торможение и поверхностная проводимость? Как их нужно учитывать при определении величины -потенциала?
- •70. Какая связь существует между уравнениями Гиббса и Ленгмюра? Напишите уравнение, выражающее эту взаимосвязь, и поясните физико-химический смысл входящих в него величин.
- •72. Что представляют собой потенциальные кривые взаимодействия между коллоидными частицами? Как на их основе объясняют явление коагуляции?
- •75. Что понимается под работой адсорбции? Как, используя это понятие, можно объяснить связь поверхностной активности пав с длиной углеводородного радикала в молекуле пав (правило Дюкло-Траубе).
65. Что представляет собой релаксационный эффект, электрофоретическое торможение и поверхностная проводимость? Как их нужно учитывать при определении величины -потенциала?
Электрофорез — перемещение частиц дисперсной фазы в дисперсионной среде под действием внешнего электрического поля. Частицы дисперсной фазы в зависимости от знака заряда перемещаются к катоду или аноду. Электрофорез открыл Ф. Рейсс в 1808 г.
Зная
скорость электрофореза, по уравнению
Гельмгольца-Смолуховского можно
вычислить величину электрокинетического
потенциала (ζ-потенциала):

где
 – напряженность электрического поля.
Она равна
,
В*м-1.
– напряженность электрического поля.
Она равна
,
В*м-1.
 – внешняя ЭДС, В и
– внешняя ЭДС, В и
 – расстояние между электродами, м;
– расстояние между электродами, м;
 и
и
 – диэлектрическая проницаемость
дисперсионной среды и электрическая
постоянная (
=8,854*
Ф*
);
– диэлектрическая проницаемость
дисперсионной среды и электрическая
постоянная (
=8,854*
Ф*
);
 – линейная скорость движения частиц
дисперсной фазы в электрическом поле;
– вязкость дисперсионной среды, Па*с.
Отношение
/
получило название электрофоретической
подвижности (
).
– линейная скорость движения частиц
дисперсной фазы в электрическом поле;
– вязкость дисперсионной среды, Па*с.
Отношение
/
получило название электрофоретической
подвижности (
).
На практике может наблюдаться несовпадение экспериментально установленных значений электрофоретической подвижности со значениями, рассчитанными по уравнению Гельмгольца-Смолуховского. Это несовпадение объясняется двумя явлениями:
1) Релаксационный эффект — нарушение симметрии диффузного слоя противоионов вокруг частицы при ее относительном движении в электрическом поле. Для восстановления (релаксации) системы требуется значительный промежуток времени. Последнее приводит к эффективной напряженности электрического поля, и значение величины ζ-потенциала оказывается заниженным;
2) Электрофоретическое торможение — сопротивление движению частицы обратного потока противоионов, который увлекает за собой жидкость, что приводит к уменьшению электрофоретической подвижности ( ).
Электроосмос – направленное движение дисперсионной среды относительно твердой поверхности в капиллярах и пористых телах (в т. ч. в фильтрах и мембранах) под действием внешнего электрического поля. Явление также обнаружил Ф. Рейсс в 1808 г.
При
вычислении величины электрокинетического
потенциала по скорости электроосмоса
используют следующее уравнение

где
 - объемная скорость электроосмоса,
;
- объемная скорость электроосмоса,
;
 - объемная удельная электропроводность,
См*
;
- объемная удельная электропроводность,
См*
;
 - сила тока, А.
- сила тока, А.
Если
радиус капилляра в микропористых
капиллярных системах сопоставим с
толщиной ДЭС, то
не будет будет соответствовать
электропроводности внутри капилляра
и в уравнении для расчета ζ-потенциала
по скорости электроосмоса вводят
поправку, учитывающую поверхностную
проводимость
 .
Поправочный коэффициент
называется коэффициентом эффективности
диафрагмы, который равен:
.
Поправочный коэффициент
называется коэффициентом эффективности
диафрагмы, который равен:

Поверхностная
проводимость (
)
— добавочная удельная электрическая
проводимость жидкости в капиллярной
системе по сравнению с проводимостью
жидкости вне нее. С учетом поверхностной
проводимости электрокинетический
потенциал будет равен

Поверхностная
проводимость м. б. также выражена через
среднюю удельную электропроводность
в тонких капиллярах:
 ,
См*
.
,
См*
.
66. Назовите основные группы ПАВ при их классификации по степени диссоциации в воде. Объясните, почему так важна проблема биоразлагаемости промышленных ПАВ? В чем заключается правило независимости поверхностного действия Ленгмюра при адсорбции ПАВ на границе раздела вода-воздух.
Основные группы ПАВ при их классификации по степени диссоциации в воде:
1)
Неионогенные (неионные) ПАВ, т.е. не
диссоциирующие в воде на ионы. К ним
относятся оксиэтилированные спирты,
кислоты, алкилфенолы, эфиры сахарозы и
др. Неионогенные ПАВ — соединения,
полученные на основе окиси этилена
![]() путем
присоединения ее к спиртам, карбоновым
кислотам, аминам.
путем
присоединения ее к спиртам, карбоновым
кислотам, аминам.
Например:
![]()
Полиоксиэтиленовая цепочка определяет гидрофильные свойства ПАВ. В молекулах неионогенных ПАВ радикал может содержать от 6 до 18 углеродных атомов, а "n" изменяется от нескольких единиц до 100.
Эти ПАВ по потреблению занимают второе место после анионных ПАВ (около 30 % от общего производства). Они не чувствительны к жесткости воды и могут использоваться в сочетании с другими типами ПАВ. При повышении температуры растворимость неионогенных ПАВ в воде уменьшается.
2) Ионогенные (ионные) ПАВ — диссоциируют в воде на ионы, одни из которых обладают адсорбционной (поверхностной) активностью, другие (противоионы) — адсорбционно неактивны. Эти ПАВ в свою очередь делятся на:
2.1)
Анионные, образующие в растворе
поверхностно-активные анионы и
гидратированные катионы, например, ионы
щелочных металлов:

К ним относятся:
— соли
карбоновых кислот RCOO—Ме+, где R{С8—С20},
Ме — Nа+, N ,
К+;
,
К+;
—
алкиларилсульфонаты
— соли ароматических сульфокислот
RArS Me+;
Me+;
— алкилсульфаты — соли эфиров серной кислоты ROS Me+;
— алкилсульфонаты
Анионные ПАВ составляют до 60 % от всего мирового производства ПАВ.
Главное достоинство анионных ПАВ — относительная простота их производства и небольшая стоимость. Они входят в состав большинства моющих средств. Главный недостаток анионных ПАВ - они плохо работают в жесткой воде. Чувствительность их к жесткости воды уменьшается в ряду: карбоксилаты > фосфаты > сульфаты, сульфонаты;
2.2)
Катионные ПАВ, у которых ответственность
за поверхностную активность несет
катион, например: бромид цетилтриметиламмония:![]()
К ним относятся обычно амины различной степени замещения и их соли, пиридиновые соединения.
Основную массу катионных ПАВ составляют азотсодержащие соединения. Широко используют также фосфониевые, сульфониевые, сульфоксониевые ПАВ. Область использования катионных ПАВ очень разнообразна: в качестве антистатиков и ингибиторов коррозии, для флотации минералов, в бактерицидных препаратах. Их высокая адсорбируемость обеспечивает модифицирование (изменение поверхностных свойств) твердых поверхностей различной химической природы. По потреблению катионные ПАВ занимают 3 место после анионных и неионогенных ПАВ и составляют около 10% от общего количества производимых ПАВ;
2.3) Амфотерные или амфолитные — эти соединения обладают обычно несколькими полярными группами, которые в растворе в зависимости от условий могут диссоциировать с образованием длинных цепочек анионов или катионов. У них поверхностно-активный ион имеет отрицательный заряд в щелочной среде и положительный — в кислой.
При pH < 4 они диссоциируют как катионные ПАВ, при pH > 9 - как анионные; в интервале pH 4 - 9 не диссоциируют.
Примером таких ПАВ являются аминокислоты, белки и различные природные ПАВ;
2.4) Цвиттер-ионные ПАВ. Они занимают промежуточное положение между ионогенными и неионогенными ПАВ. Молекулы этих ПАВ содержат положительно заряженную (обычно аммониевую) и отрицательно заряженную (обычно карбоксилат-ион) группу. К ним относятся N-алкилпроизводные аминокислот, имидазолины. Примером таких ПАВ могут служить бетаины и сульфобетаины состава:
![]()
где R — алкил с числом атомов углерода 8 — 12.
Основные их достоинства — они не вызывают раздражения кожи и глаз, поэтому их широко используют в моющих средствах (шампунях), лекарственных кремах и т.д. В последнее время потребление цвиттер-ионных ПАВ резко возросло. Они проявляют хорошую совместимость с другими ПАВ и демонстрируют синергизм, то есть усиливают поверхностную активность в смесях. ПАВ.
Почему так важна проблема биоразлагаемости промышленных ПАВ:
Биоразлагаемость – время снижения концентрации ПАВ под действием биоорганизмов в определенное число раз.
Современные ПАВ обычно производят посредством химического синтеза, используя нефтепродукты. При попадании таких веществ в природу в первую очередь оказывается пагубное влияние на флору и фауну, а, в конечном счете, на качество питьевой воды. Биоразлагаемость ПАВ определяет степень безопасности бытовой химии, моющих и чистящих средств для нашей окружающей среды.
Помимо сохранения экологической безопасности на нашей планете, а также положительного воздействия на здоровье человечества, биоразлагаемость имеет и исключительно экономический эффект. Использование синтетических чистящих средств, не включающих в себя биоразлагаемые ПАВ, вызывает возрастание нагрузки на очистные сооружения приблизительно в 1,5-2 раза, что впоследствии приводит к потребности в использовании более мощных, а, соответственно, и более дорогостоящих аппаратов для очистки воды.
В чем заключается правило независимости поверхностного действия Ленгмюра при адсорбции ПАВ на границе раздела вода-воздух:
Ленгмюр ввел понятие об ориентации молекул ПАВ в поверхностном слое.
Исходя из строения молекул ПАВ, Ленгмюр сформулировал принцип независимости поверхностного действия, заключающийся в том, что при адсорбции полярная группа молекулы, обладающая большим сродством к полярной фазе, втягивается в воду, в то время как неполярный радикал выталкивается в неполярную фазу. Происходящее при этом уменьшение свободной поверхностной энергии ограничивает размеры поверхностного слоя толщиной в одну молекулу. Образуется мономолекулярный слой.
При малых концентрациях ПАВ углеводородные радикалы «лежат» на поверхности полярной жидкости, а полярные группы погружены в неё. Затем, по мере роста концентрации ПАВ, они (неполярные радикалы) начинают подниматься. В насыщенном адсорбционном слое поверхность воды оказывается сплошь покрытой «частоколом Ленгмюра» из вертикально ориентированных молекул ПАВ. Значение поверхностного натяжения в этом случае приближается к значению, характерному для чистого ПАВ на границе с воздухом.

67. К каким дисперсным системам относятся грунты (сухие и оводненные), полимениральные горные породы, строительные материалы, керамика, сорбенты, катализаторы, пенопласты и другие пеноматериалы? Классифицируйте их по агрегатному состоянию дисперсной фазы и дисперсионной среды.
Системы с твердой дисперсионной средой: дисперсные системы, в которых газовые, жидкостные или твердые включения распределены в объеме твердой фазы, либо образуют непрерывную систему взаимосвязанных прослоек в непрерывной твердой фазе (в последнем случае деление на дисперсионную среду и дисперсную фазу может быть проведено только условно): грунты (сухие и оводненные), полиминеральные горные породы, строительные материалы, керамика, сорбенты, катализаторы, пенопласты и другие пеноматериалы.
68. Гидрофильные (или олеофобные), гидрофобные (или олеофильные) поверхности. Дайте их характеристику с использованием уравнения Юнга, после его предварительного вывода. Что такое углы натекания (наступающие) и отекания (отступающие) и чем они обусловлены?
Вывод уравнения Юнга:
Смачивание является разновидностью адгезии для границы раздела жидкость – тв. тело и выражает сродство адгезива к субстрату.
В отличие от адгезии, количество фаз, действующих при смачивании, м. б. различным и в зависимости от количества взаимодействующих фаз различают следующие виды смачивания:
1) Иммерсионное – наблюдается при полном погружении твёрдого тела в жидк., реализуется при смачивании порошков. В этом виде смачивания принимает участие 2 фазы: жидкость и тв. тело.
2) Контактное – при нём могут принимать участие 3 или 4 фазы.
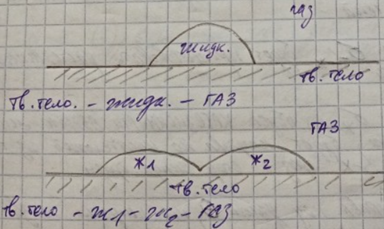
Рассмотрим контактное смачивание при условии, что на границе раздела фаз отсутствуют вещества, способные к адсорбции.

Линия АВ называется линией смачивания.
В точках А и В одновременно реагируют 3 фазы.
Замкнутая линия смачивания (АСВ) называется периметром смачивания.
В зависимости от соотношения сил, движущихся на границе раздела фаз, (тв. тело – газ, тв. тело – жидкость и жидкость – газ) жидкость, нанесённая на поверхность, будет принимать ту или иную форму.
Сила
на границе раздела
 (тв.
тело – газ) будет способствовать процессу
смачивания и растягивать каплю по
поверхности тв. тела.
(тв.
тело – газ) будет способствовать процессу
смачивания и растягивать каплю по
поверхности тв. тела.
Сила
на границе раздела
 будет препятствовать растеканию капли
по поверхности.
будет препятствовать растеканию капли
по поверхности.
Сила
на границе раздела
 ,
обусловленная кагезионными взаимодействиями
внутри жидкой фазы, будет направлена
по касательной из точки соприкосновения
3-х фаз в сторону жидкой фазы.
,
обусловленная кагезионными взаимодействиями
внутри жидкой фазы, будет направлена
по касательной из точки соприкосновения
3-х фаз в сторону жидкой фазы.
Эти
силы направлены под углом
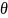 ,
который получил название краевой угол
смачивания, а также препятствуют
растеканию капли по поверхности.
,
который получил название краевой угол
смачивания, а также препятствуют
растеканию капли по поверхности.
Точка
А может перемещаться по поверхности,
но оторваться от неё не может. Поэтому
берутся не сами силы
,
а их проекция на плоскость, т.е.
 .
.
Краевой угол смачивания характеризует степень наклона поверхности жидкости к смоченной части поверхности твёрдого тела. Он представляет собой угол между поверхностью тв. тела и касательной к поверхности раздела жидкость – газ. Вершина краевого угла смачивания всегда может в точке соприкосновения 3-х фаз.
Краевой угол смачивания является безразмерной количественной характеристикой процесса смачивания.
В
состоянии равновесия:
 (1)
(1)
Из
(1) выразим краевой угол смачивания
 (2)
(2)
Уравнение (2), выражающее зависимость краевого угла смачивания от сил, участвующих в процессе смачивания, получило название уравнение Юнга. Оно было выведено в 1804 г. английским физиком Юнгом.
Анализ
уравнения Юнга
1. < 90°, cos > 0°, > , 0° < < 90°
Поверхность, которая смачивается водой, по отношению к воде, будет называться гидрофильной, а если будет смачивание неполярной жидкостью (М) – олеофильной.
2. = 0°, cos = 1.
В
этом случае о способности жидкости
смачивать поверхность судят по
коэффициенту растекания (уравнение
Гаркинса):
 , f > 0 – растекание происходит
f < 0 – растекание не происходит
, f > 0 – растекание происходит
f < 0 – растекание не происходит

3. > 90°, cos < 0°, < , 90° < < 180° – условие несмачивания.
При несмачивании поверхность тв. тела по отношению к жидкости, которая на него нанесена, будет называться гидрофобной (вода) или олеофобной (масло).
4. = 90°, cos = 0° – граница между смачиванием и несмачиванием.
Вышесказанное позволяет зависимость свойств поверхности от краевого угла смачивания представить следующим образом (ОТНОСИТЕЛЬНО ВОДЫ):
Ө |
cos Ө |
Процесс |
Поверхность |
Ө = 0⁰ |
cos Ө = 1 |
Растекание |
Гидрофильная (олеофобная) |
Ө < 90⁰ 0⁰ < Ө < 90⁰ |
cos Ө > 0 |
Смачивание |
Гидрофильная (олеофобная) |
Ө > 90⁰ 90⁰ < 0 < 180⁰ |
cos Ө < 0 |
Несмачивание |
Гидрофобная (олеофильная) |
Ө = 90⁰ |
cos Ө = 0 |
Граница между смачиванием и несмачиванием |
- |
Что такое углы натекания (наступающие) и отекания (отступающие) и чем они обусловлены:
При смачивании реальных твердых тел краевые углы по различным причинам отличаются в той или иной степени от равновесного краевого угла, определяемого уравнением Юнга.
Более того, при смачивании одной и той же твердой поверхности при одних и тех же значениях термодинамических параметров системы (температура, давление и т.д.) статические краевые углы могут иметь множество различных значений в зависимости от условий их формирования. Это обусловлено проявлением гистерезиса смачивания.
Гистерезисом смачивания называют способность жидкости образовывать при контакте с твердым телом несколько устойчивых (метастабильных) краевых углов, отличных по значению от равновесного.

Например, краевой угол натекания Өн, образованный при нанесении капли жидкости на твердую поверхность, оказывается значительно больше краевого угла отекания Өо, который возникает при приведении в контакт пузырька воздуха с той же поверхностью, находящейся в данной жидкости.
Гистерезис краевого угла наглядно проявляется, если поверхность твердого тела с нанесенной на нее каплей наклонена: при этом угол в нижней части капли Өн оказывается значительно больше угла в верхней части капли Өо (рис. 1.25).
69. В чем состоит сущность теории ДЛФО? Что называется расклинивающим давлением?
Современная физическая теория агрегативной устойчивости лиофобных дисперсных систем была развита советскими учеными Б. В. Дерягиным, Л. Д. Ландау и позднее независимо от них голландскими учеными Э. Фервеем и Я. Овербеком. В соответствии с первыми буквами фамилий авторов теория носит название ДЛФО.
В
теории ДЛФО в качестве основного
параметра, который характеризует
стабильность дисперсной системы,
рассматривают расклинивающее давление
(π) — избыточное давление, возникающее
в межфазной прослойке жидкости, по
сравнению с гидростатическим давлением
в большом объеме окружающей среды:
π(h)=
где
 – давление в межфазной жидкой прослойке,
— гидростатическое давление в окружающей
среде, h — толщина жидкой межфазной
прослойки.
– давление в межфазной жидкой прослойке,
— гидростатическое давление в окружающей
среде, h — толщина жидкой межфазной
прослойки.
Его необходимо приложить к поверхностям, которые ограничивают эту прослойку жидкости, чтобы ее толщина оставалась постоянной или могла быть обратимо изменена в термодинамически равновесном процессе.
С
термодинамической точки зрения
расклинивающее давление есть частная
производная энергии Гиббса по толщине
межфазной жидкой прослойки при постоянстве
своих естественных переменных и значении
химич. потенциала: π(h)=

Возникновение расклинивающего давления авторы теории объясняют тем, что из-за наличия броуновского движения коллоидные частицы лиофобной дисперсной системы могут очень близко подходить друг к другу. Для дальнейшего сближения частицы должны деформировать свои диффузные слои, чтобы произошло их взаимное перекрывание и взаимодействие. Однако жидкости сжимаются плохо и в ответ на деформацию с их стороны и появляются силы «расклинивающего давления». Причем, перекрывание происходит при условии, что h < 2 ( - толщина поверхностного слоя).
Расклинивающее давление м. б. положительно (π > 0). В этом случае давление в межфазной прослойке жидкости понижено, что препятствует вытеканию из нее жидкости и способствует преобладанию сил отталкивания между частицами (система агрегативно устойчива).
Расклинивающее давление м. б. отрицательно (π < 0), т.е. повышает давление в прослойке жидкости. Последнее ускоряет вытекание из нее жидкости и способствует преобладанию сил притяжения между частицами (коагуляции).
