
- •2. Особенности адсорбции на поверхности твердого адсорбента. Уравнение Фрейндлиха, его анализ и определение констант уравнения.
- •3. Что понимается под поверхностным слоем, поверхностной энергией и поверхностными явлениями. Какие параметры относятся к количественным характеристикам дисперсности? Дайте их полную характеристику.
- •4. Представьте, что Вам необходимо сделать доклад по теме: “Суспензия”. Напишите план доклада и в соответствии с ним составьте тезисы доклада.
- •5. Что понимается под поверхностным натяжением и как оно зависит от природы веществ, образующих поверхность раздела фаз?
- •6. Что такое капиллярное давление? Каковы причины его возникновения? Вывод и анализ уравнения Лапласа.
- •8. Поверхностное натяжение: причины возникновения, его физический смысл с термодинамической и силовой точек зрения, определение и методы измерения.
- •9. Что такое агрегативная устойчивость? Факторы, обеспечивающие агрегативную устойчивость лиофобных золей.
- •10. Характеристика порошков как дисперсных систем. Какие порошки обладают более высокой текучестью – грубодисперсные или высокодисперсные? Какие порошки легче распылять гидрофильные или гидрофобные?
- •11. Влияние температуры на термодинамические параметры поверхностного слоя – Us , qs , σ, Ss. (Вывод и анализ уравнения Гиббса-Гельмгольца для поверхностного слоя).
- •12. Адгезия и когезия. Какими силами они обусловлены? Что понимается под работой адгезии и когезии? Вывод уравнений, используемых для вычисления работы адгезии (Дюпре) и работы когезии.
- •13. Что такое аэрозоли? Приведите примеры аэрозолей бытовых, атмосферных и промышленных.
- •14. Рассмотрите процесс смачивания в зависимости от соотношения работы адгезии и когезии (вывод и анализ уравнения Юнга-Дюпре).
- •15. Теория кинетики быстрой коагуляции м. Смолуховского: основные положения; вывод и анализ уравнения, представляющего кинетику изменения общего числа частиц в процессе коагуляции? (Схож с 74)
- •16. Каковы условия поднятия жидкостей в капиллярах? Какова роль этого явления в природе и технике?
- •19. Рассмотрите возможные механизмы возникновения двойного электрического слоя (дэс) на границе раздела твердое тело – раствор.
- •21. В чем заключается инверсия смачивания? Какое практическое значение имеет это явление?
- •22. Какие величины используют для количественного описания адсорбции? Дайте определение этих величин и покажите, как их можно вычислить в общем виде.
- •23. Почему в случае смачивания капилляра жидкость в нем поднимается, а при несмачивании, наоборот, опускается?
- •25. Какие поверхностные явления сопровождают технологические процессы? Перечислите и дайте их краткую характеристику.
- •26. Теория мономолекулярной адсорбции Ленгмюра: основные положения теории, вывод уравнения изотермы адсорбции и ее анализ.
- •29. Смачивание: покажите взаимосвязь между адгезией и способностью жидкости смачивать твердую поверхность. В чем состоит различие между явлениями адгезии и смачивания?
- •30. Чем объяснить, что концентрация кислорода в воздухе земной атмосферы уменьшается в два раза при удалении от поверхности Земли на 5 км, а суспензии гуммигута на высоте 30 мкм?
- •31. По каким признакам классифицируют дисперсные системы? Привести их классификацию по всем классификационным признакам.
- •32. В чем заключается сущность ионообменной адсорбции? Какое состояние называется ионообменным равновесием? Какая величина его характеризует?
- •33. Что такое расклинивающее давление и каковы причины его возникновения? Назовите составляющие расклинивающего давления и охарактеризуйте их.
- •34. Адсорбция на границе раздела раствор – газ (воздух). Вывод и анализ уравнения адсорбции Гиббса для разбавленных растворов бинарной системы.
- •35. Зависимость термодинамической реакционной способности от дисперсности.
- •37. Кинетическая устойчивость. Связь между кинетической устойчивостью и гипсометрическим законом.
- •38. Как, используя уравнение Шишковского, можно определить константы уравнения Ленгмюра (к и а).
- •40. Свойства поверхностей жидких и твердых тел. Каковы особенности адсорбции пав из растворов на поверхности твердого тела?
- •41. Дайте сравнительную характеристику мономолекулярной и полимолекулярной адсорбции. Приведите основные типы изотерм для полимолекулярной адсорбции.
- •42. Дайте характеристику двойного электрического слоя на границе раздела фаз твердое тело – раствор. Как изменяется потенциал в этом слое с расстоянием от поверхности твердой фазы?
- •43. Что понимается под термином “разрушение дисперсной системы”, какая устойчивость при этом теряется? Правила электролитной коагуляции лиофобных золей.
- •44. Капиллярные явления. Поднятия и опускания жидкости в капиллярах: уравнение Жюрена, его вывод и анализ.
- •46. Поверхностная энергия и равновесная форма тела: правило Гиббса-Кюри для твердых и жидких тел.
- •47. Электрокинетические явления 1-го рода, история их открытия и практическое приложение. Как по скорости электрофореза и электроосмоса можно вычислить электрокинетический потенциал?
- •48. Как объяснить зависимость, установленную правилом Дюкло-Траубе?
- •50. Дайте полную характеристику дисперсной системы. Классификационная характеристика этих систем по агрегатному состоянию дисперсной фазы и дисперсионной среды, по виду дисперсной фазы.
- •51. Представьте, что Вам необходимо сделать доклад по теме “Эмульсии”. Напишите план доклада и составьте к нему тезисы.
- •55. Каковы возможные механизмы образования на поверхности раздела фаз двойного электрического слоя.
- •57. Составьте задачу, для решения которой нужно использовать правило Панета-Фаянса.
- •58. Чем обусловлено светорассеяние в дисперсных системах и истинных растворах? Какими параметрами характеризуют рассеяние света в системе?
- •59. Электрокинетические явления 2-го рода: история их открытия, характеристика и практическое приложение.
- •61. Какова взаимосвязь давления насыщенного пара с кривизной поверхности: вывод и анализ уравнения Томсона-Кельвина.
- •63. Каков физический смысл термина “поверхностная активность”? к каким веществам применяется этот термин? Дайте их характеристику и приведите полную классификацию по всем классификационным признакам.
- •64. Дайте характеристику коллоидных растворов (золей) по всем классификационным признакам. Чем они отличаются от суспензий. Приведите примеры таких систем.
- •65. Что представляет собой релаксационный эффект, электрофоретическое торможение и поверхностная проводимость? Как их нужно учитывать при определении величины -потенциала?
- •70. Какая связь существует между уравнениями Гиббса и Ленгмюра? Напишите уравнение, выражающее эту взаимосвязь, и поясните физико-химический смысл входящих в него величин.
- •72. Что представляют собой потенциальные кривые взаимодействия между коллоидными частицами? Как на их основе объясняют явление коагуляции?
- •75. Что понимается под работой адсорбции? Как, используя это понятие, можно объяснить связь поверхностной активности пав с длиной углеводородного радикала в молекуле пав (правило Дюкло-Траубе).
37. Кинетическая устойчивость. Связь между кинетической устойчивостью и гипсометрическим законом.
Кинетическая (седиментационная) устойчивость - это способность дисперсной системы сохранять равномерное распределение частиц дисперсной фазы по объему системы, то есть противостоять действию силы тяжести и процессам оседания или всплывания.
Наиболее наглядной мерой оценки кинетической устойчивости является скорость(U) осаждения частиц дисперсной фазы. Однако более строгая ее характеристика - это величина удельного седиментационного потока:
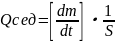 ,
,
где
 - это масса вещества дисперсной фазы,
переносимого в единицу времени через
единицу площади з асчет явления
седиментации.
- это масса вещества дисперсной фазы,
переносимого в единицу времени через
единицу площади з асчет явления
седиментации.
Так как в процессе седиментации со временем концентрация частиц дисперсной фазы в нижней части дисперсной системы становится больше, чем в верхней, то это приводит к возникновению градиента концентраций и удельного диффузионного потока (Qдиф), направленного вверх. Отношение удельных потоков Qсед и Qдиф можно использовать как строгую качественную характеристику кинетической устойчивости. Этот параметр позволяет разделить все дисперсные системы на три группы:
 ≫1
- система кинетически неустойчива;
≫1
- система кинетически неустойчива;
≪ 1 - система кинетически устойчива;
= 1 - в системе устанавливается диффузионно-седиментационное равновесие.
Также кинетическую устойчивость устойчивость делят на:
кинетическую седиментационную устойчивость - обеспечивается гидродинамическими факторами: вязкость, плотность среды, плотность и размеры частиц.
термодинамическую седиментационную устойчивость - связана с диффузионно - седиментационным равновесием, которое в большей степени проявляется в высокодисперсных системах. Мерой термодинамической седиментационной устойчивости является гипсометрическая высота.
Если между процессами седиментации и диффузии наступает равновесие, то устанавливается и определенное равновесное распределение частиц по высоте. Распределение концентрации частиц дисперсной фазы по высоте выражается уравнением Лапласа-Перрена (гипсометрический закон):

где
 - число частиц на исходном уровне и на
высоте h;
- число частиц на исходном уровне и на
высоте h;
 - объем, занимаемый частицей дисперсной
фазы;
- объем, занимаемый частицей дисперсной
фазы;
 -
плотности дисперсной фазы и дисперсионной
среды.
-
плотности дисперсной фазы и дисперсионной
среды.
Это
уравнение позволяет определить высоту,
на которой концентрация частиц дисперсной
фазы уменьшается в
 раз. Кроме того, его используют для
определения размеров частиц высокодисперсных
систем с применением центробежной силы.
раз. Кроме того, его используют для
определения размеров частиц высокодисперсных
систем с применением центробежной силы.
38. Как, используя уравнение Шишковского, можно определить константы уравнения Ленгмюра (к и а).
Зависимость
поверхностного натяжения водных
растворов ПАВ обладающих большой
поверхностной активностью по отношению
к воде, от их концентрации выражается
уравнением Шишковского:
σ=σ。‐
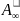 ・RT・ln(1
+ Kc),
・RT・ln(1
+ Kc),
∆σ = σ。- σ = ・RT・ln(1 + Kc),
где - емкость монослоя; К - константа адсорбционного равновесия, характеризующая сродство адсорбата к адсорбенту;σ。и σ - поверхностное натяжение растворителя и раствора; с - концентрация раствора.
Ленгмюр предложил теорию мономолекулярной адсорбции. Уравнение изотермы адсорбции было выведено для границе раздела твердое тело-газ, но может подходить и для жидкость-газ и твердое тело-жидкость. Исходные положения теории Ленгмюра следующие:
энергия адсорбции всех молекул одинакова, т.е. поверхность адсорбента энергетически эквипотенциальна;
адсорбция локализована на отдельных адсорбционных центрах, каждый из которых взаимодействует только с одной молекулой адсорбата. Таким образом ,при насыщении поверхности адсорбента адсорбатом образуется мономолекулярный слой;
адсорбированные молекулы образуют адсорбционный комплекс, неспособный свободно перемещаться по поверхности, и взаимодействуют друг с другом;
адсорбцию газа на твердом адсорбенте можно рассматривать как квазихимическую реакцию: молекула газа + активный центр ↔ адсорбционный комплекс.
Наиболее распространенным выражением изотермы адсорбции Ленгмюра являются уравнения:
А
=

А
=

где К - константа адсорбционного равновесия, выраженная через отношение констант скоростей процессов адсорбции и десорбции. Она характеризует сродство адсорбата к адсорбенту, т.е. их энергию взаимодействия. Чем сильнее это взаимодействие, тем больше константа адсорбционного равновесия. Константа К увеличивается в 3-3,5 раза при удлинении цепи на одно звено - СН2;
- предельная адсорбция или емкость монослоя, т.е. количество адсорбированного вещества, покрывающее поверхность адсорбента плотным монослоем.
Адсорбционное уравнение Ленгмюра можно представить относительно степени заполнения поверхности Ө - отношение величины адсорбции А к емкости монослоя .
Ө
=
 =
=
С ростом температуры константа адсорбционного равновесия К, а следовательно, степень заполнения адсорбента Ө и величины адсорбции А уменьшается.

На участке I зависимость адсорбции от концентрации линейна. Он соответствует очень малым концентрациям, при которых Кс≪1 и А = Кс. В этой области концентраций, когда количество свободных мест на поверхности велико, адсорбция линейно растет с ростом концентрации.
Участок II отвечает области средних заполнений поверхности адсорбента адсорбатом.
Участок III отвечает завершением процесса адсорбции, когда вся поверхность адсорбента покрывается мономолекулярным слоем адсорбата.
39. Что такое монодисперсная и полидисперсная система? Начертите интегральную и дифференциальную кривые распределения частиц по радиусам для полидисперсной системы. Поясните физический смысл этих кривых.
В монодисперсной системе частицы дисперсной фазы имеют одинаковые размеры и равномерно оседают с одинаковой скоростью, поэтому масса осевших частиц m прямо пропорциональна времени оседания τ.
ОА характеризует скорость оседания дисперсной фазы и зависит от концентрации суспензии, размера частиц, высоты столба. В(τ1) выражает количество осадка дисперсной фазы, выпавшего к моменту времени.
Точка А соответствует времени полного оседания частиц дисперсной фазы.

Полидисперсные системы - частицы дисперсной фазы имеют разные размеры. В этих системах невозможно установить истинное количество фракций, обладающих одинаковыми по размерам частицами и кривые седиментации - это плавные кривые.
Кривая
имеет начальный прямолинейный участок,
который отвечает оседанию частиц,
имеющие радиус rmax = K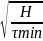 . τmax - время самых мелких частиц, τmin -
время самых больших частиц.
. τmax - время самых мелких частиц, τmin -
время самых больших частиц.
Интегральная кривая распределения частиц по радиусам для полидисперсной системы
Кривая интегральной функции распределения изображает содержание частиц разной степени дисперсности. Она имеет S-образную форму с характерной точкой перегиба, соответствующей размеру частиц, весовая доля которых в данной дисперсной системе максимальна и соответствует наивероятнейшему радиусу.
Эта кривая может иметь восходящий или нисходящий вид в зависимости от того, как определяют нарастающее суммарное содержание частиц (Qo). Если Qo определяют, начиная суммировать с самых крупных частиц, то интегральная кривая имеет нисходящий вид(а), а если с самых мелких, то восходящий (б).
С помощью интегральной кривой определяют процентное содержание фракций, то есть частиц с размерами, находящихся в заданном интервале.

Дифференциальная кривая распределения частиц по радиусам для полидисперсной системы
Более наглядное представление о распределении частиц в системе по размерам дает дифференциальная кривая, представляет функцию распределения (процентное содержание в системе фракций частиц) от радиуса частиц.
Где 1 - система, наиболее приближающаяся к монодисперсной; 2 - наиболее полидисперсная система; 3 и 4 - система, содержащая преимущественно мелкие и крупные частицы соответственно.
Фракция, отвечающая максимуму кривой распределения, соответствует наивероятнейшему радиусу полидисперсной системы. Чем уже интервал радиусов дифференциальной кривой распределения и чем выше ее максимум, тем система ближе к монодисперсной. Наоборот, чем кривая более растянута и чем ниже максимум, тем система более полидисперсна. Таким образом, дифференциальные кривые распределения частиц по радиусам являются важной характеристикой дисперсных систем, позволяющих судить о степени их полидисперсности.

