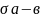- •Задача №3
- •Таким образом, величина « » может рассматриваться не только как удельная свободная поверхностная энергия, но и как сила, отнесённая к единице длины контура, ограничивающего поверхность.
- •Задача №2.1
- •Решение
- •Практика №4
- •Кагезия.
- •Смачивание
- •Анализ уравнения Юнга
- •Значение смачивания
- •Решение задач
- •Задание №2.2. Адсорбционные равновесия. Вариант 3
- •Практика №5.
- •Практика №6. «Капиллярные явления»
Решение
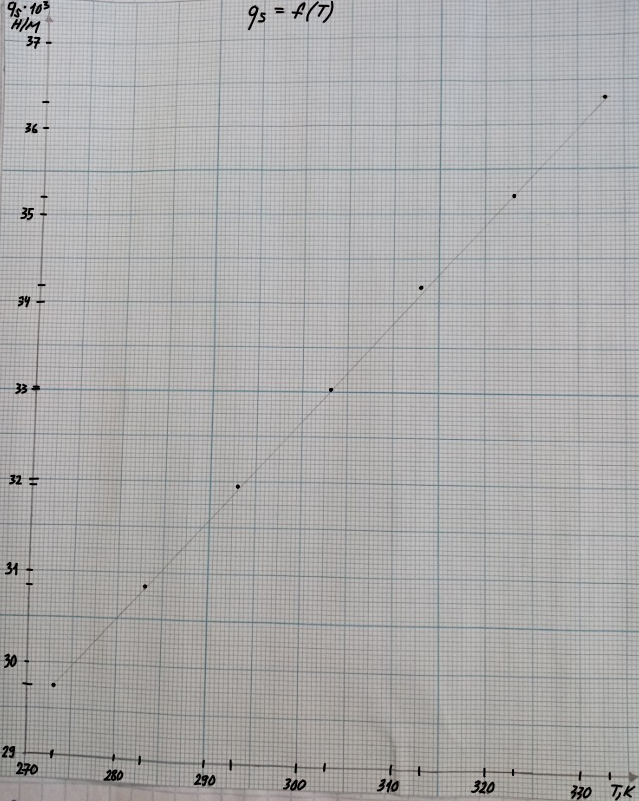
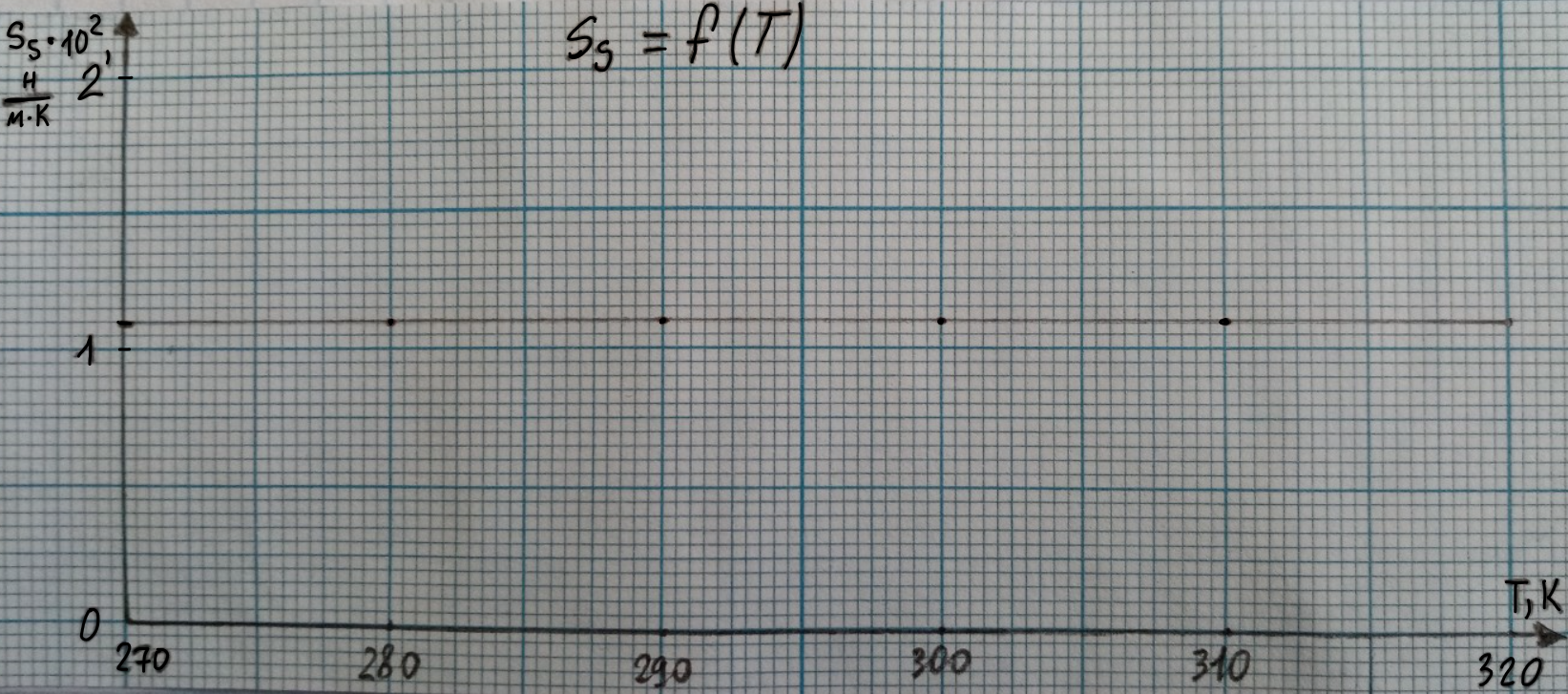
Для нахождения температурного коэффициента строим график зависимости = f(T)
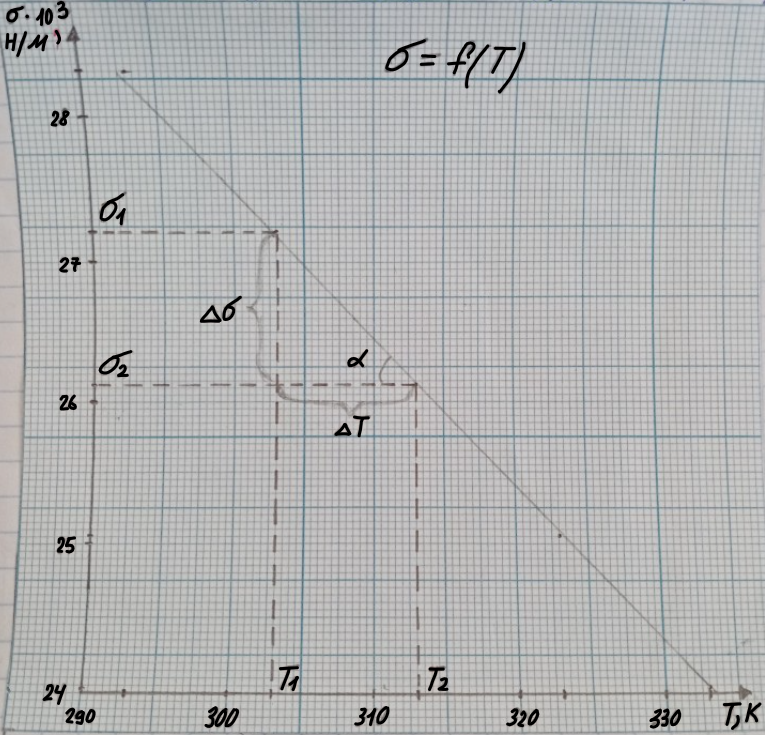
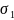 = 27,22*103 Н/м;
= 27,22*103 Н/м;
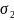 = 26,13*103 Н/м
= 26,13*103 Н/м
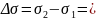 -1,09*103 Н/м
-1,09*103 Н/м
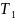 = 303 К;
= 303 К;
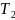 = 313 К
= 313 К
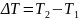 = 10 К
= 10 К
tg α =
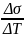 =
=
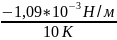 = 0,109*10-3
= 0,109*10-3
 =
=
Т. к. энтропия поверхностного слоя = - , то = -0,109*10-3 .
Теплота образования единицы поверхности
определяется по формуле
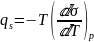 :
:
1) = -273*(-0,109*10-3) = 29,76*10-3 Н/м
2) = -283*(-0,109*10-3) = 30,85*10-3 Н/м
3) = -293*(-0,109*10-3) = 31,94*10-3 Н/м
4) = -303*(-0,109*10-3) = 33,03*10-3 Н/м
5) = -313*(-0,109*10-3) = 34,18*10-3 Н/м
6) = -323*(-0,109*10-3) = 35,21*10-3 Н/м
7) = -333*(-0,109*10-3) = 36,30*10-3 Н/м
Строим график зависимости = f(T).
Энтропия поверхностного слоя = . При вычислении будет постоянным и равным 1,09*102 .
Т. о., график зависимости = f (T) будет иметь вид:
Внутренняя полная поверхностная энергия Us может быть найдена по формулам:
Us
=
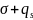 или Us
=
или Us
=
 .
Я воспользуюсь формулой Us
=
.
Я воспользуюсь формулой Us
=
1) -
2) -
3) Us
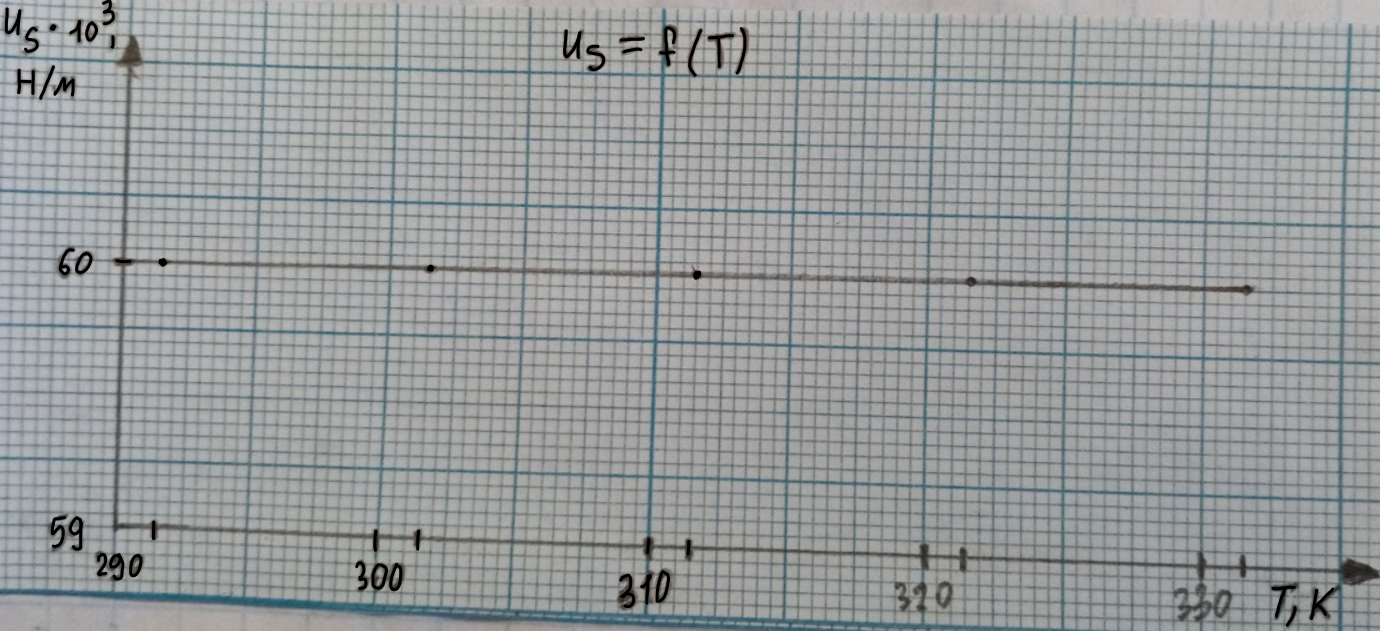
= 28,31*10-3+31,94*10-3 = 60,25*10-3
Н/м
 60*10-3 Н/м
60*10-3 Н/м
4) Us = 27,22*10-3+33,03*10-3 = 60,25*10-3 Н/м 60*10-3 Н/м
5) Us = 26,13*10-3+34,18*10-3 = 60,31*10-3 Н/м 60*10-3 Н/м
6) Us = 25,06*10-3+35,21*10-3 = 60,27*10-3 Н/м 60*10-3 Н/м
7) Us = 24,02*10-3+36,30*10-3 = 60,32*10-3 Н/м 60*10-3 Н/м
Строим график зависимости Us = f (T)
Критическую температуру более точно
вычисляют по уравнению Этвеша:
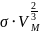 = К(
-Т)
= К(
-Т)
– Т =
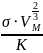
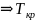 =
+Т
=
+Т
К = 2,1*10-7, М (n-ксилол) = 106*10-3 кг/моль, (n-ксилол) = 861,1 кг/м3
Тогда
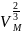 =
=
 24,7*10-4 м3/моль
24,7*10-4 м3/моль
Т. о., критическая температура (при
поверхностном натяжении
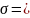 28,31
и температуре 20⁰С) равна
28,31
и температуре 20⁰С) равна
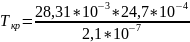 +293
626 К
+293
626 К
Справочное значение = 632 К, т.е. полученная мною = 626 К является верной.
Вывод: с помощью зависимости поверхностного натяжения жидкости от температуры (табл.) определил внутреннюю энергию Us, энтропию поверхностного слоя Ss, теплоту образования единицы поверхности и критическую температуру по уравнению Этвеша (для большей точности).
Практика №4
«Поверхностные явления: кагезия, адгезия, смачивание, растекание»
Эти явления обусловлены тем, что в гетерогенных системах могут возникать внутримолекулярные и межмолекулярные взаимодействия. Так как в соответствии со 2 законом термодинамики, самопроизвольно может протекать процесс, который сопровождается убылью эн-ии Гиббса. Перечисленные выше явления также сопровождаются убылью поверхностной эн-ии, кот.равна G= *S
Тогда
 (1)
(1)
Адгезия, к-зия и смачивание сопровождаются убылью свободной поверхности эн-ии при S=const
Кагезия.
Этот термин происходит от латинского «cohasus», что означает «слипание». Кагезия – взаимодействие между частицами различной природы внутри однородной гомогенной фазы. Это явление обуславливается внутримолекулярным взаимодействием под давлением сил аттракции – притяжения. К этим силам относится межмолекулярное взаимодействие, химические и водородные связи.
Количественно кагезия характеризуется
работой кагезии и обознается
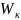 .
.
Работа кагезии – работа разрыва однородной объёмной фазы, отнесённые к единице площади разрыва.

–
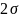 ж-г (мДж/м2, Дж/м2, мН/м, Н/м)
ж-г (мДж/м2, Дж/м2, мН/м, Н/м)
В общем виде
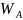 =
=
Под работой кагезии понимается прочность на разрыв.
Адгезия (от лат. Adhaesio, что означает «прилипание») – взаимодействие между поверхностями 2-х различных по природе фаз. При адгезии взаимодействие происходит между 2 фазами.
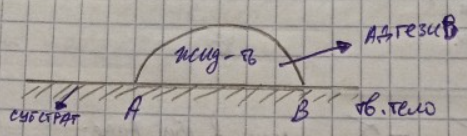
То, к чему прилипает – субстрат, а то, что прилипает – адгезия.
Адгезия протекает в 2 стадии:
I стадия – транспортная, перемещение адгезием к субстрату.
II стадия – непосредственные взаимодействие адгезива с субстратом.
Количественно адгезия характеризуется работой адгезии .
Работа адгезии – работа, необходимая для разделения 1-го м2 поверхности раздела фаз А-В наа 2 поверхности раздела А и В (например тв.тело – из и жидк.-газ)
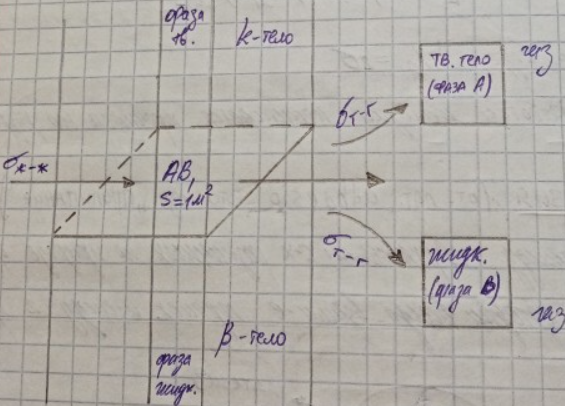
=
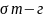 +
+
 -
-
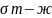 или в общем виде:
или в общем виде:
=
 +
+
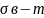 -
-