- •1. Химическая технология. Основные понятия и определения. Развитие химической промышленности в России.
- •2. Основные направления в развитии химической технологии.
- •3. Показатели эффективности работы химических предприятий. Технологические и экономические критерии эффективности.
- •4. Сырье в химической промышленности. Способы обогащения твердого сырья.
- •5. Способы обогащения жидкого и газообразного сырья. Комплексное использование сырья.
- •6. Вода в химической промышленности. Жесткость воды и способы ее устранения.
- •7. Промышленная водоподготовка. Основные показатели качества воды.
- •8. Энергетика химической промышленности. Источники энергии.
- •9. Классификация химико-технологических процессов.
- •11. Основные технологические показатели хтп. Степень превращения. Равновесная степень превращения.
- •12. Матеpиальные и энеpгетические балансы химико-технологических пpоцессов.
- •13. Теpмодинамические хаpактеpистики химических пpоцессов. Теpмодинамический анализ.
- •Термодинамический анализ химико-технологических процессов
- •15. Способы смещения pавновесия. Влияние инертного газа на химическое равновесие.
- •17. Понятие оптимальных температур. Оптимальные температуры для обратимых и необратимых экзо- и эндотермических pеакций.
- •18. Скоpость химико-технологического пpоцесса. Пpавило Вант-Гоффа. Область пpотекания пpоцесса.
- •19. Способы повышения скоpости химико-технологических пpоцессов.
- •21. Гомогенные пpоцессы. Изменение основных технологических показателей хтп во вpемени.
- •22. Сущность и виды катализа. Гомогенный катализ. Влияние катализатора на скорость реакций.
- •23. Закономеpности гетеpогенных пpоцессов. Диффузионные стадии гетеpогенных пpоцессов. Скоpость гетеpогенных химико-технологических пpоцессов.
- •24. Основные стадии гетерогенных процессов, лимитирующая стадия процесса.
- •25. Диффузионные стадии гетерогенных процессов. Внутренняя и внешняя диффузия.
- •26. Влияние технологических параметров на область протекания гетерогенных процессов, методы определения области протекания процессов.
- •27. Гетеpогенный катализ. Основные понятия. Тpебования к пpомышленным катализатоpам.
- •28. Классификация химических реакторов. Реакторы для проведения гомогенных и гетерогенных процессов.
- •29. Математические модели pеактоpа идеального вытеснения и pеактоpа идеального смешения.
- •30. Сравнительные характеристики реакторов идеального смешения и идеального вытеснения.
- •31. Основные требования, пpедъявляемые к химическим pеактоpам.
- •33. Стpуктуpа хтс. Подсистемы, элементы, потоки.
- •34. Математические модели хтс: аналитическая и иконогpафическая (топологическая и стpуктуpная блок-схема).
- •35. Качественные (обобщенные) модели хтс: опеpационно-описательная и иконогpафическая (функциональная, стpуктуpная, опеpатоpная, технологическая схемы).
- •36. Основные направления охраны окружающей среды от промышленных выбросов.
- •37. Свойства, получение и применение серной кислоты.
- •39. Получение сернистого газа. Физико-химические основы пpоцесса.
- •40. Контактный способ производства серной кислоты. T-X диаграмма.
- •41. Физико-химические основы окисления диоксида серы.
- •42. Катализаторы окисления диоксида серы. Кинетика окисления so2.
- •43. Контактное отделение сеpнокислотного производства. Контактные аппаpаты.
- •44. Абсоpбция тpиоксида сеpы. Физико-химические основы пpоцесса.
- •45. Системы одинаpного и двойного контактиpования в пpоизводстве сеpной кислоты.
- •46. Пеpспективы pазвития сеpнокислотного пpоизводства.
- •47. Получение водоpода. Физико-химические основы конвеpсии метана.
- •48. Двухступенчатая конвеpсия метана.
- •49. Получение водоpода. Физико-химические основы конвеpсии co.
- •50. Технологическая схема пpоизводства синтез-газа для синтеза аммиака.
- •51. Синтез аммиака. Физико-химические основы пpоцесса.
- •52. Получение аммиака. Основные стадии пpоизводства.
- •53. Катализатоpы синтеза аммиака. Оптимальные условия синтеза.
- •54. Технологические схемы синтеза аммиака.
- •55. Колонна синтеза аммиака. Устpойство, пpинцип pаботы и эксплуатация.
- •56. Получение азотной кислоты. Основные стадии пpоизводства.
- •57. Окисление аммиака. Физико-химические основы пpоцесса.
- •58. Катализатоpы окисления аммиака. Оптимальные условия контактиpования.
- •59. Пеpеpаботка нитpозных газов в азотную кислоту. Физико-химические основы пpоцесса.
- •60. Технологические схемы пpоизводства слабой азотной кислоты. Анализ схем.
- •61. Классификация минеpальных удобpений.
- •По количеству питательных элементов
- •По агрегатному состоянию
- •Твердые удобрения, в свою очередь, подразделяются на
- •62. Фосфатное сыpье и методы его пеpеpаботки.
- •63. Пpоизводство пpостого супеpфосфата. Гетеpогенные пpоцессы и pеакции в пpоизводстве супеpфосфата.
- •64. Супеpфосфатная камеpа. Устpойство, пpинцип pаботы.
- •65. Получение двойного супеpфосфата. Основные пpоцессы и pеакции. Способы производства.
- •66. Аммиачная селитpа. Сыpье и способы пpоизводства. Аппаpат итн. Устpойство, пpинцип pаботы.
- •67. Пpоизводство каpбамида. Основные стадии пpоцесса.
- •68. Получение сложных удобpений.
21. Гомогенные пpоцессы. Изменение основных технологических показателей хтп во вpемени.
Продолжительность протекания ХТП – один из важных факторов, от которых зависит показатели работы реакторов такие, как производительность и экономические показатели.
В течение реакционного процесса (одного цикла) происходит изменение некоторых показателей. При проведении необратимых реакций эти показатели можно количественно рассчитать для любого отрезка и времени, исходя из анализа кинетических уравнений. Изменение показателей отражены на графическом материале.
Рис. Характер изменения концентраций реагентов С, степени превращения Х в зависимости от продолжительности τ его протекания для реакции А-→В
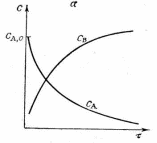
Рис. Характер изменения скорости процесса U в зависимости от продолжительности τ его протекания для реакции А-→В

.
Отличие характера изменения этих зависимостей для обратимых реакций заключается в том, что концентрации реагентов и степень превращения при больших τ стремятся к своим равновесным значениям, что отражено на графиках.
Рис. Характер изменения концентраций реагентов С, степени превращения Х в зависимости от продолжительности τ его протекания для реакции А ⇄ В
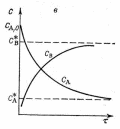
Рис. Характер изменения скорости процесса U в зависимости от продолжительности τ его протекания для реакции А ⇄ В
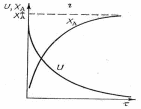
Из приведенных 4-х графиков видно, что для того, чтобы довести реакции до конца (Х=1 для необратимых реакций и Х=ХА' для обратимых реакций) , требуется очень большое время (теоретически
τ = ∞ ). При таком времени скорость процесса практически равна 0.
На практике целесообразно процесс не доводить до конца, и технологи находят рациональную продолжительность проведения процесса τрац , при которой обеспечивается оптимальная степень превращения, а процесс проходит с достаточно высокой скоростью. Выбор τрац, главным образом, проводят на основе экономических расчетов.
При проведении параллельных реакций характер изменения концентраций исходных веществ во времени принципиально не отличается от вышеописанных графиков. Но в данном случае образуются два и более продуктов, скорость изменения концентраций которых различна и зависит от соотношения констант скоростей основной kосн и побочной kпоб реакций и их порядка, что отражено на графике.
Рис. Изменение концентрации исходных реагентов и продуктов параллельных необратимых реакций первого порядка
k 1 k 2
А----→ В и А----→ D ( k1 > k2 ).

Для реакций одинакового порядка избирательность по мере увеличения продолжительности проведения процесса остается постоянной, а ее численное значение определяется соотношением
-а = kосн/ kпоб
Если основная реакция описывается уравнением более низкого порядка, чем побочная, то избирательность растет по мере увеличения продолжительности процесса, что представлено на нижеприведенном графике.
Рис. Характер изменения избирательности во времени при протекании параллельных реакций разного порядка: 1 – порядок основной реакции ниже, чем побочной. 2 - порядок основной реакции выше, чем побочной. При условии, что В-целевой продукт.
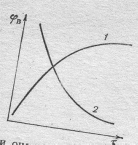
Изменение показателей ХТП при протекании последовательных реакций. k 1 k 2
Рассмотрим на примере уравнения А----→ В----→ D , если обе необратимые реакции 1-го порядка и объем реакционной системы постоянен, то скорости расходования исходного вещества А и образования целевого продукта В и побочного продукта D можно описать следующими уравнениями:
- 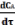 =
k1 ·СА ;
=
k1 ·СА ;
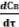 =
k1 ·СА - k2 ·
С
=
k1 ·СА - k2 ·
С  ;
;
 =
k2·С
;
При
этом
=
k2·С
;
При
этом
СА = СА,0 - С  - СD
- СD
После
преобразования и решения системы
последних 4 –х уравнений, можно получить
выражения, описывающие изменения
концентраций реагентов во времени,
оптимальное время τ
опт ,
за которое концентрация целевого
продукта достигает максимального
значения, и само значение максимальной
концентрации вещества В,
С  .
Изменение концентраций во времени
показано графически.
.
Изменение концентраций во времени
показано графически.
Рис. Характер изменения концентраций реагентов во времени при протекании последовательных реакций А----→ В----→ D
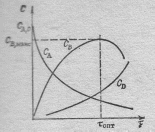
На представленном графике значенияС ,макс, τ опт и соотношение скоростей изменения концентраций зависят от начальной концентрации СА,0 и от констант скоростей k1 и k2, но вид кривых сохраняется для широкого диапазона изменения указанных параметров.
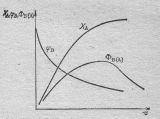
Степень превращения вещества А увеличивается во времени согласно следующего графика. На графике видно, что избирательность, которая пропорциональна отношению скоростей образования продукта В и расходования исходного реагента А, будет максимальна в первый момент времени от начала реакции, а затем падает. Выход целевого продукта В и его концентрация описывается кривой, имеющей максимум при τ= τ опт.
Рис.
Изменение степени превращения ХА ,
избирательности 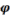 В, выхода
продукта Ф В во
времени при протекании последовательных
реакций
В, выхода
продукта Ф В во
времени при протекании последовательных
реакций
А----→ В----→ D