
- •1. Химическая технология. Основные понятия и определения. Развитие химической промышленности в России.
- •2. Основные направления в развитии химической технологии.
- •3. Показатели эффективности работы химических предприятий. Технологические и экономические критерии эффективности.
- •4. Сырье в химической промышленности. Способы обогащения твердого сырья.
- •5. Способы обогащения жидкого и газообразного сырья. Комплексное использование сырья.
- •6. Вода в химической промышленности. Жесткость воды и способы ее устранения.
- •7. Промышленная водоподготовка. Основные показатели качества воды.
- •8. Энергетика химической промышленности. Источники энергии.
- •9. Классификация химико-технологических процессов.
- •11. Основные технологические показатели хтп. Степень превращения. Равновесная степень превращения.
- •12. Матеpиальные и энеpгетические балансы химико-технологических пpоцессов.
- •13. Теpмодинамические хаpактеpистики химических пpоцессов. Теpмодинамический анализ.
- •Термодинамический анализ химико-технологических процессов
- •15. Способы смещения pавновесия. Влияние инертного газа на химическое равновесие.
- •17. Понятие оптимальных температур. Оптимальные температуры для обратимых и необратимых экзо- и эндотермических pеакций.
- •18. Скоpость химико-технологического пpоцесса. Пpавило Вант-Гоффа. Область пpотекания пpоцесса.
- •19. Способы повышения скоpости химико-технологических пpоцессов.
- •21. Гомогенные пpоцессы. Изменение основных технологических показателей хтп во вpемени.
- •22. Сущность и виды катализа. Гомогенный катализ. Влияние катализатора на скорость реакций.
- •23. Закономеpности гетеpогенных пpоцессов. Диффузионные стадии гетеpогенных пpоцессов. Скоpость гетеpогенных химико-технологических пpоцессов.
- •24. Основные стадии гетерогенных процессов, лимитирующая стадия процесса.
- •25. Диффузионные стадии гетерогенных процессов. Внутренняя и внешняя диффузия.
- •26. Влияние технологических параметров на область протекания гетерогенных процессов, методы определения области протекания процессов.
- •27. Гетеpогенный катализ. Основные понятия. Тpебования к пpомышленным катализатоpам.
- •28. Классификация химических реакторов. Реакторы для проведения гомогенных и гетерогенных процессов.
- •29. Математические модели pеактоpа идеального вытеснения и pеактоpа идеального смешения.
- •30. Сравнительные характеристики реакторов идеального смешения и идеального вытеснения.
- •31. Основные требования, пpедъявляемые к химическим pеактоpам.
- •33. Стpуктуpа хтс. Подсистемы, элементы, потоки.
- •34. Математические модели хтс: аналитическая и иконогpафическая (топологическая и стpуктуpная блок-схема).
- •35. Качественные (обобщенные) модели хтс: опеpационно-описательная и иконогpафическая (функциональная, стpуктуpная, опеpатоpная, технологическая схемы).
- •36. Основные направления охраны окружающей среды от промышленных выбросов.
- •37. Свойства, получение и применение серной кислоты.
- •39. Получение сернистого газа. Физико-химические основы пpоцесса.
- •40. Контактный способ производства серной кислоты. T-X диаграмма.
- •41. Физико-химические основы окисления диоксида серы.
- •42. Катализаторы окисления диоксида серы. Кинетика окисления so2.
- •43. Контактное отделение сеpнокислотного производства. Контактные аппаpаты.
- •44. Абсоpбция тpиоксида сеpы. Физико-химические основы пpоцесса.
- •45. Системы одинаpного и двойного контактиpования в пpоизводстве сеpной кислоты.
- •46. Пеpспективы pазвития сеpнокислотного пpоизводства.
- •47. Получение водоpода. Физико-химические основы конвеpсии метана.
- •48. Двухступенчатая конвеpсия метана.
- •49. Получение водоpода. Физико-химические основы конвеpсии co.
- •50. Технологическая схема пpоизводства синтез-газа для синтеза аммиака.
- •51. Синтез аммиака. Физико-химические основы пpоцесса.
- •52. Получение аммиака. Основные стадии пpоизводства.
- •53. Катализатоpы синтеза аммиака. Оптимальные условия синтеза.
- •54. Технологические схемы синтеза аммиака.
- •55. Колонна синтеза аммиака. Устpойство, пpинцип pаботы и эксплуатация.
- •56. Получение азотной кислоты. Основные стадии пpоизводства.
- •57. Окисление аммиака. Физико-химические основы пpоцесса.
- •58. Катализатоpы окисления аммиака. Оптимальные условия контактиpования.
- •59. Пеpеpаботка нитpозных газов в азотную кислоту. Физико-химические основы пpоцесса.
- •60. Технологические схемы пpоизводства слабой азотной кислоты. Анализ схем.
- •61. Классификация минеpальных удобpений.
- •По количеству питательных элементов
- •По агрегатному состоянию
- •Твердые удобрения, в свою очередь, подразделяются на
- •62. Фосфатное сыpье и методы его пеpеpаботки.
- •63. Пpоизводство пpостого супеpфосфата. Гетеpогенные пpоцессы и pеакции в пpоизводстве супеpфосфата.
- •64. Супеpфосфатная камеpа. Устpойство, пpинцип pаботы.
- •65. Получение двойного супеpфосфата. Основные пpоцессы и pеакции. Способы производства.
- •66. Аммиачная селитpа. Сыpье и способы пpоизводства. Аппаpат итн. Устpойство, пpинцип pаботы.
- •67. Пpоизводство каpбамида. Основные стадии пpоцесса.
- •68. Получение сложных удобpений.
17. Понятие оптимальных температур. Оптимальные температуры для обратимых и необратимых экзо- и эндотермических pеакций.
Эндотермическая реакция сопровождается поглощением теплоты. Следовательно, такие реакции невыгодно проводить в адиабатических условиях, так как по мере протекания реакции ее скорость будет падать как из-за увеличения степени превращения, так и из-за уменьшения температуры. Более разумно проводить эндотермические процессы в реакторах с подводом теплоты (изотермических или в реакторах с промежуточным тепловым режимом), поддерживая температуру, максимально допустимую по конструкционным соображениям. Необходимо при этом дополнительно провести оптимизацию температурного режима, сопоставив экономические показатели: увеличение прибыли вследствие роста производительности реактора и возрастания расходов на поддержание высокой температуры.
Для необратимых экзотермических реакций рост степени превращения сопровождается выделением теплоты, и, следовательно, в адиабатическом режиме это приведет к возрастанию температуры реакционной смеси. Уменьшение скорости реакции вследствие увеличения степени превращения будет частично компенсироваться ростом константы скорости реакции с возрастанием температуры. Проводя такую реакцию в проточном адиабатическом реакторе, можно обеспечить высокую скорость химической реакции и высокую производительность реактора в автотермическом режиме без использования посторонних источников теплоты. При этом теплота реакционной смеси, выходящей из реактора, служит для нагрева исходных реагентов на входе в реактор.
18. Скоpость химико-технологического пpоцесса. Пpавило Вант-Гоффа. Область пpотекания пpоцесса.
Скорость химической реакции определяется как скорость изменения числа молей произвольно выбранного реагента в реакционной системе.
При повышении температуры скорость большинства химических реакций существенно увеличивается, причем для гомогенных реакций при нагревании на каждые десять градусов скорость реакции возрастает в 2-4 раза.
В
соответствии с правилом
Вант-Гоффа для
каждой реакции можно применять так
называемый температурный коэффициент 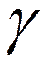 ,
который показывает, во сколько раз
возрастает константа скорости реакции
при повышении температуры на 10 0С.
,
который показывает, во сколько раз
возрастает константа скорости реакции
при повышении температуры на 10 0С.
Зная температурный коэффициент можно по приведенной ниже формуле рассчитать изменение скорости реакции при увеличении температуры от t1 до t2
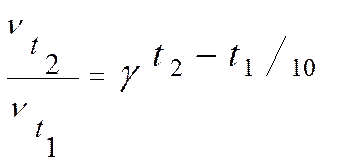 ,
,
где
ut2 и
ut1 -
скорости реакции при температурах t2 и
t1 соответственно; 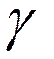 -
температурный коэффициент скорости
данной реакции.
-
температурный коэффициент скорости
данной реакции.
Например, если температурный коэффициент реакция
γ = 2, то при увеличении температуры на 100 градусов скорость реакции должна увеличиться: V398/V298 = 210 = 1024 раза.
Для гомогенных процессов диффузия не имеет существенной роли. Протекание процесса проходит в кинетической области. Для гетерогенных процессов диффузия во многих случаях, прежде всего, ограничивает скорость процесса, т.е. процесс проходит в диффузионной области.
19. Способы повышения скоpости химико-технологических пpоцессов.
Скорость технологического процесса по целевому продукту есть результирующая скоростей прямой, обратной и побочных реакций, а также турбулентной и молекулярной диффузии исходных веществ в зону реакции и продуктов из этой зоны.
Скорость производственного процесса определяет производительность соответствующих аппаратов или размеры и число их.
Скорость процесса рассчитывают по степени превращения исходного вещества, по выходу продукта за определенный промежуток времени или через константу скорости процесса.
Степень превращения определяют по основному исходному веществу. Основным исходным веществом называется вещество, по которому ведется расчет. Это, как правило, наиболее дорогое из веществ, присутствующих в исходной смеси.
Увеличение движущей силы процесса может быть достигнуто: а) возрастанием концентраций взаимодействующих компонентов в исходных материалах (сырье); б) повышением давления; в) регулированием температуры процесса; г) отводом продуктов реакции из реакционного объема с целью сдвига равновесия в сторону продукта.
Увеличение концентрации взаимодействующих компонентов в исходном сырье повышает концентрацию и пропорционально увеличивает скорость процесса. Способ увеличения концентрации взаимодействующих компонентов в исходном сырье зависит от агрегатного состояния материала. Увеличение содержания полезного составляющего в твердом сырье называется обогащением, а в жидком и газообразном -- концентрированием.
Повышение давления влияет на скорость процесса (скорость достижения равновесного состояния обратимых процессов) и состояние равновесия. Давление сильно влияет на скорость процессов, идущих в газовой фазе или же при взаимодействии газов с жидкостями и твердыми телами. В гомогенных процессах, протекающих в газовой фазе или в гетерогенных с участием газообразных компонентов, повышение давления уменьшает объем газовой фазы и соответственно увеличивает концентрации взаимодействующих веществ. Таким образом, повышение давления равносильно росту концентрации реагентов. Влияние давления определяется кинетическими уравнениями.
Регулирование температуры процесса как средство повышения движущей силы применяется главным образом в сорбционных и десорбционных процессах. Понижая температуру жидкой фазы, уменьшают парциальное давление паров газового (парового) компонента над ней, и соответственно увеличивают движущую силу и общую скорость процесса.
Отвод продуктов реакции из реакционной зоны увеличивает суммарную скорость обратимой реакции за счет уменьшения или увеличивает движущую силу гетерогенного процессов.
20. Гомогенные пpоцессы. Влияние давления на скоpость газофазных пpоцессов. Понятие оптимальных давлений для обратимых химических реакций.
Гомогенными называются процессы, которые происходят в однородной среде - жидкости или газообразной смеси, в которой поверхность раздела между отдельными ее частями или компонентами отсутствуюет. Гомогенные процессы в промышленности встречаются довольно редко. В самом деле гомогенную систему получить тяжело. Любое вещество содержит следы разных примесей, которые находятся в другой фазе. Так, даже в 1 мл дистиллированной воды содержится от 20000 до 30000 частичек пыли.
В гомогенных процессах реакции происходят в объеме, как правило, значительно быстрее чем в гетерогенных. Осуществление и управление технологическими гомогенными процессами значительно проще и легче, поэтому многие промышленные гетерогенные процессы стараются перевести в гомогенные
В промышленности для реализации гомогенных химико-технологических процессов довольно часто осуществляют операции, которые предшествуют химическому взаимодействию, а именно: поглощение газов жидкостями или конденсацию паров, растворение или плавление твердых материалов.
Влияние давления на скорость реакций и другие показатели гомогенных процессов наиболее сильно проявляется, когда реагирующие вещества находятся в газообразном состоянии.
- Для необратимых реакций увеличение давления приводит к пропорциональному росту концентрации реагирующих веществ, а, следовательно, увеличению движущей силы и скорости процесса в целом.
Например, при реакции аА + bВ → dD скорость можно записать уравнением:
U = k · СА а' ·Св b ' = k · [ Р А / ( RT ) ] а' · [ Р В / ( RT ) ] b ' = k ' · Р А а' ·Р В b ' ; (27)
В соответствии с законом парциальных давлений
РA = NA · Робщ ; Р В = N В · Робщ ;
Следовательно, скорость реакции можно представить, как функцию давления, при котором проводят процесс Робщ:
U = k ' · NA а' · N В b ' · Робщ а'+ b ' = k '·А· Р m общ ; (28)
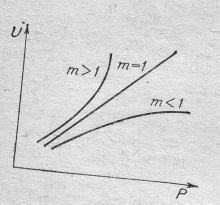
Из последнего уравнения следует, что с увеличением давления Робщ скорость гомогенного процесса растет пропорционально давлению в степени, равной порядку реакции.Чем выше порядок реакции, чем в большей степени влияние давления на скорость, что отмечено на графике.
Рис. Влияние давления Р на скорость газофазных необратимых реакций различного порядка m.
- Для необратимых реакций влияние давления на движущую силу процесса имеет более сложный характер, так как с увеличением Р растут не только концентрации реагирующих веществ, но и изменяются параметры равновесного состояния, входящие в состав выражения движущей силы. Это равновесные концентрации и равновесная степень превращения.
Движущая сила процесса пропорциональна разности фактической и равновесной концентраций реагента А для реакции аА + b В ⇄ dD, т. е.
СА ~ СА - СА *.
Если данная реакция протекает с уменьшением объема реагирующей смеси ( а + b > d ) , то с увеличением Робщ растетСА и снижаетсяС*А. Скорость реакции возрастает с увеличением давления, при котором протекает реакция. По сравнению с необратимыми реакциями того же порядка влияние роста давления на увеличение скорости обратимых реакций, протекающих с уменьшением объема, происходит в более значительной степени.
Если реакция протекает с уменьшением объема реагирующей смеси
( а + b < d ) , зависимость скорости реакции от давления имеет максимум, что отражено на графике.
Рис. Влияние давления на скорость обратимой реакции, протекающей с увеличением объема.
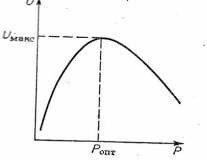
Оптимальное давление, при котором скорость реакции максимальна, зависит от степени приближения реагирующей смеси к равновесию.
C увеличением степени превращения оптимальное давление уменьшается.
Аналогично изменяются степень превращения исходных реагентов (Х) и выхода продуктов (Ф), согласно графических данных.
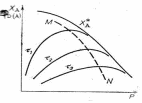
На графике линия MN , соединяющая максимумы на кривых
Х A ,Ф D ( A ) = f (Робщ) называется линией оптимальных давлений. Положение линии оптимальных давлений в координатах Х – Р показывает, что по мере увеличения степени превращения необходимо уменьшать общее или парциальные давления реагентов. На практике для уменьшения парциальных давлений реакционную смесь по мере увеличения степени превращения разбавляют инертным газом или паром.
При проведении параллельных или последовательных реакций влияние давления эквивалентно изменению концентраций реагирующих веществ. Например, повышение давления во всех случаях увеличивает скорость образования целевых и побочных продуктов. Если порядок основной реакции выше, чем побочной, то увеличивается выход целевого продукта и избирательность.
Для гомогенных процессов с жидкой фазой давление процесса оказывает влияние на изменение константы скорости реакции.
Но эта зависимость ощутима лишь при высоких давлениях. Например, полимеризацию этилена осуществляют при давлении свыше 100 МПа.
Порядок реакции по данному веществу, показатель степени при концентрации этого вещества в кинетическом уравнении
U = k · СА n А =·Св n Б
U – скорость реакции
n А , n Б – порядки реакции по веществам А и Б
k – константа скорости реакции.
Величина ( n А + n Б + …) называется общим или суммарным порядком реакции.
Порядок реакции n равен сумме показателей степени у концентраций в уравнении, выражающем зависимость скорости реакции от концентрации реагирующих веществ.
Например, для реакции
аА + бБ →rR + sS ± Q скорость прямой реакции выражается уравнением: U =k · СА а · СБ б порядок этой реакции равен n = а + б
Реакции разделяются на реакции первого, второго и третьего порядка. Могут быть реакции , в которых порядок выражается дробным числом, нулем и отрицательным числом.
Порядок каталитических реакций почти всегда ниже, чем их молекулярность. В присутствии катализатора обычно снижается порядок реакции, причем, чем активнее катализатор, тем ниже порядок реакции.
Поэтому кинетика каталитических реакций обычно описывается уравнениями, найденными эмпирически, и порядок таких каталитических реакций выражается как в виде целого, так и дробного числа.
Для обратимых реакций, рассматривая влияние давления на скорость необходимо учитывать термодинамические и кинетические факторы. При протекании обратимых реакций давление сказывается на концентрации реагирующих веществ и на состоянии равновесия (принцип Ле-Шателье).
