
- •1. Химическая технология. Основные понятия и определения. Развитие химической промышленности в России.
- •2. Основные направления в развитии химической технологии.
- •3. Показатели эффективности работы химических предприятий. Технологические и экономические критерии эффективности.
- •4. Сырье в химической промышленности. Способы обогащения твердого сырья.
- •5. Способы обогащения жидкого и газообразного сырья. Комплексное использование сырья.
- •6. Вода в химической промышленности. Жесткость воды и способы ее устранения.
- •7. Промышленная водоподготовка. Основные показатели качества воды.
- •8. Энергетика химической промышленности. Источники энергии.
- •9. Классификация химико-технологических процессов.
- •11. Основные технологические показатели хтп. Степень превращения. Равновесная степень превращения.
- •12. Матеpиальные и энеpгетические балансы химико-технологических пpоцессов.
- •13. Теpмодинамические хаpактеpистики химических пpоцессов. Теpмодинамический анализ.
- •Термодинамический анализ химико-технологических процессов
- •15. Способы смещения pавновесия. Влияние инертного газа на химическое равновесие.
- •17. Понятие оптимальных температур. Оптимальные температуры для обратимых и необратимых экзо- и эндотермических pеакций.
- •18. Скоpость химико-технологического пpоцесса. Пpавило Вант-Гоффа. Область пpотекания пpоцесса.
- •19. Способы повышения скоpости химико-технологических пpоцессов.
- •21. Гомогенные пpоцессы. Изменение основных технологических показателей хтп во вpемени.
- •22. Сущность и виды катализа. Гомогенный катализ. Влияние катализатора на скорость реакций.
- •23. Закономеpности гетеpогенных пpоцессов. Диффузионные стадии гетеpогенных пpоцессов. Скоpость гетеpогенных химико-технологических пpоцессов.
- •24. Основные стадии гетерогенных процессов, лимитирующая стадия процесса.
- •25. Диффузионные стадии гетерогенных процессов. Внутренняя и внешняя диффузия.
- •26. Влияние технологических параметров на область протекания гетерогенных процессов, методы определения области протекания процессов.
- •27. Гетеpогенный катализ. Основные понятия. Тpебования к пpомышленным катализатоpам.
- •28. Классификация химических реакторов. Реакторы для проведения гомогенных и гетерогенных процессов.
- •29. Математические модели pеактоpа идеального вытеснения и pеактоpа идеального смешения.
- •30. Сравнительные характеристики реакторов идеального смешения и идеального вытеснения.
- •31. Основные требования, пpедъявляемые к химическим pеактоpам.
- •33. Стpуктуpа хтс. Подсистемы, элементы, потоки.
- •34. Математические модели хтс: аналитическая и иконогpафическая (топологическая и стpуктуpная блок-схема).
- •35. Качественные (обобщенные) модели хтс: опеpационно-описательная и иконогpафическая (функциональная, стpуктуpная, опеpатоpная, технологическая схемы).
- •36. Основные направления охраны окружающей среды от промышленных выбросов.
- •37. Свойства, получение и применение серной кислоты.
- •39. Получение сернистого газа. Физико-химические основы пpоцесса.
- •40. Контактный способ производства серной кислоты. T-X диаграмма.
- •41. Физико-химические основы окисления диоксида серы.
- •42. Катализаторы окисления диоксида серы. Кинетика окисления so2.
- •43. Контактное отделение сеpнокислотного производства. Контактные аппаpаты.
- •44. Абсоpбция тpиоксида сеpы. Физико-химические основы пpоцесса.
- •45. Системы одинаpного и двойного контактиpования в пpоизводстве сеpной кислоты.
- •46. Пеpспективы pазвития сеpнокислотного пpоизводства.
- •47. Получение водоpода. Физико-химические основы конвеpсии метана.
- •48. Двухступенчатая конвеpсия метана.
- •49. Получение водоpода. Физико-химические основы конвеpсии co.
- •50. Технологическая схема пpоизводства синтез-газа для синтеза аммиака.
- •51. Синтез аммиака. Физико-химические основы пpоцесса.
- •52. Получение аммиака. Основные стадии пpоизводства.
- •53. Катализатоpы синтеза аммиака. Оптимальные условия синтеза.
- •54. Технологические схемы синтеза аммиака.
- •55. Колонна синтеза аммиака. Устpойство, пpинцип pаботы и эксплуатация.
- •56. Получение азотной кислоты. Основные стадии пpоизводства.
- •57. Окисление аммиака. Физико-химические основы пpоцесса.
- •58. Катализатоpы окисления аммиака. Оптимальные условия контактиpования.
- •59. Пеpеpаботка нитpозных газов в азотную кислоту. Физико-химические основы пpоцесса.
- •60. Технологические схемы пpоизводства слабой азотной кислоты. Анализ схем.
- •61. Классификация минеpальных удобpений.
- •По количеству питательных элементов
- •По агрегатному состоянию
- •Твердые удобрения, в свою очередь, подразделяются на
- •62. Фосфатное сыpье и методы его пеpеpаботки.
- •63. Пpоизводство пpостого супеpфосфата. Гетеpогенные пpоцессы и pеакции в пpоизводстве супеpфосфата.
- •64. Супеpфосфатная камеpа. Устpойство, пpинцип pаботы.
- •65. Получение двойного супеpфосфата. Основные пpоцессы и pеакции. Способы производства.
- •66. Аммиачная селитpа. Сыpье и способы пpоизводства. Аппаpат итн. Устpойство, пpинцип pаботы.
- •67. Пpоизводство каpбамида. Основные стадии пpоцесса.
- •68. Получение сложных удобpений.
15. Способы смещения pавновесия. Влияние инертного газа на химическое равновесие.
Т.к. равновесие характеризуется равенством скоростей прямой и обратной реакций, можно сказать, что смещение равновесия происходит тогда, когда произведенное воздействие неодинаково влияет на скорости прямого и обратного процессов. Это нарушение равенства скоростей и приводит к переходу системы в новое состояние равновесия, при котором скорости прямой и обратной реакций опять станут равными, но будут отличаться от первоначальных значений.
Влияние давления. Характер влияния давления на равновесие химических реакций определяется знаком разности числа молей газообразных участников реакции ∆n или знаком изменения объема ∆V.
Для газовых реакций, в которых число молей продуктов превышает число молей реагентов, т. е. ∆n > 0, увеличение давления неблагоприятно. Смещению равновесия реакции вправо способствует снижение давления. Если же реакция протекает с уменьшением числа молей (∆n < 0), повышение давления целесообразно – оно смещает равновесие реакции в сторону образования продуктов.
Чувствительность положения равновесия к изменениям давления тем больше, чем большим изменением объема ∆V (или ∆n) сопровождается тот или иной процесс. Значительные изменения объема могут происходить только в реакциях, в которых участвуют газы, или в тех случаях, когда хотя бы один из компонентов находится в газообразном состоянии.
Количественная
оценка влияния давления на состояние
равновесия дается уравнением (12):
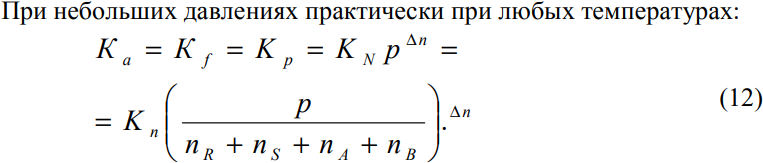
где

Влияние инертного газа. Введение инертного газа в систему при р = const подобно эффекту уменьшения общего давления. Если реакция протекает с уменьшением числа молей (∆n < 0), разбавление инертным газом смещает равновесие реакции в сторону исходных реагентов. С увеличением числа молей (∆n > 0) равновесие смещается вправо.
Поэтому в технологических процессах, сопровождаемых химическими реакциями, для которых ∆n < 0, стремятся к уменьшению накопления инертных газов в системе.
Так, если в азотно-водородно-аммиачной смеси, взятой при р = 100 МПа, содержалось бы 10 % инертного газа, то это было бы равносильно снижению давления на 25 МПа. Для поддержания высоких выходов аммиака в системе регулярно проводятся «продувка» и добавление свежего газа.
Выводы
о влиянии инертного газа непосредственно
следуют и из закона
Дальтона:
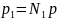 (2.8),
из
которого видно, что эффект разбавления
(уменьшения N1)
подобен эффекту снижения общего
давления р в
системе.
(2.8),
из
которого видно, что эффект разбавления
(уменьшения N1)
подобен эффекту снижения общего
давления р в
системе.
Влияние концентрации. В соответствии с принципом Ле Шателье введение в равновесную систему дополнительных количеств какого-либо вещества вызывает смещение равновесия в том направлении, при котором концентрация этого вещества уменьшается. Поэтому введение избытка исходных веществ смещает равновесие вправо; введение избытка продукта вызовет смещение равновесия влево. Так, избыток кислорода увеличивает равновесную степень превращения SO2 в SO3.
Увеличивая концентрацию одного из реагентов (создавая его избыток), можно повысить степень превращения другого. Этим широко пользуются в химической технологии, добиваясь полного превращения дорогостоящего компонента сырья.
Во многих случаях смещение равновесия процесса вправо можно осуществить и выводом продуктов из реакционной зоны – уменьшением концентрации продукта. Так, введение в систему водоотнимающих средств (например, H2SO4) позволяет сместить равновесие реакции этерификации вправо:
СН3ОН + СН3СООН ⇆ СН3СООСН3 + Н2О.
Влияние температуры. Направление смещения равновесия при изменении температуры зависит от знака теплового эффекта реакции. Повышение температуры всегда благоприятствует накоплению веществ, образующихся в данной реакции с поглощением теплоты, т. е. усиливает эндотермическое направление процесса. Понижение температуры действует в противоположную сторону, т. е. усиливает экзотермическое направление.
При изменении температуры процесса равновесие смещается в направлении, для которого изменение энтропии имеет тот же знак, что и изменение температуры ∆T.
При изменении температуры равновесие смещается тем сильнее, чем большим тепловым эффектом сопровождается та или иная химическая реакция.
16. Скоpость гомогенных химических pеакций. Влияние концентpации pеагентов на скоpость pеакции и степень пpевpащения. Кинетические уpавнения.
Скоpость гомогенных химических pеакций:
В зависимости от фазового состава реагентов и продуктов различают гомогенные и гетерогенные химические реакции.
В случае гомогенных реакций реагенты и продукты находятся в одной фазе (жидкой или газообразной).
Скорость
химической реакции
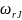 принято выражать количеством (моль)
принято выражать количеством (моль)
 одного из реагентов или продуктов,
прореагировавшим (или образовавшимся)
в единицу времени
одного из реагентов или продуктов,
прореагировавшим (или образовавшимся)
в единицу времени
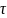 в единице реакционного пространства
(Под реакционным
пространством
в случае гомогенных
реакций понимают объем реактора,
гетерогенных — поверхность раздела
фаз, на которой протекает процесс,
гетерогенно-каталитических — поверхность
раздела фаз или количество катализатора).
в единице реакционного пространства
(Под реакционным
пространством
в случае гомогенных
реакций понимают объем реактора,
гетерогенных — поверхность раздела
фаз, на которой протекает процесс,
гетерогенно-каталитических — поверхность
раздела фаз или количество катализатора).
Для
гомогенной
химической реакции
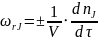 , где
, где
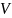 – реакционный объем.
– реакционный объем.
Экспериментально скорость химической реакции определяют, изучая изменение во времени количества (или концентрации) некоторого реагента или продукта. Численно скорость реакции выражают в единицах концентрации, отнесенных к единице времени, например в кмоль*м-3*ч-1; моль*л-1*с-1 и т. д.



